UPLC法测定注射用特利加压素中有关物质的含量
2020-07-23薛巧如袁进烨丁刘洋郑伟军邓锋
薛巧如 袁进烨 丁刘洋 郑伟军 邓锋


中圖分类号 R927.2 文献标志码 A 文章编号 1001-0408(2020)09-1108-05
DOI 10.6039/j.issn.1001-0408.2020.09.16
摘 要 目的:建立超高效液相色谱法(UPLC)法测定注射用特利加压素中有关物质的含量。方法:采用UPLC法测定5批注射用特利加压素制剂中有关物质的含量。色谱柱为Xtimate UPLC C18,流动相A为硫酸铵缓冲液(pH 2.3)-甲醇(90 ∶ 10,V/V),流动相B为硫酸铵缓冲液(pH 2.3)-甲醇(60 ∶ 40,V/V),梯度洗脱,流速为0.2 mL/min,检测波长为210 nm,进样量为5 μL。结果:注射用特利加压素中杂质A、B、C、D、F、H、I、K、L、N的检测质量浓度线性范围为0.43~3.86、0.44~3.95、0.44~3.97、0.45~4.08、0.45~4.05、0.50~4.50、0.47~4.26、0.47~4.23、0.46~4.13、0.44~3.96 μg/mL(r≥0.999 7);检测限分别为0.04、0.04、0.05、0.04、0.05、0.05、0.05、0.05、0.04 μg/mL,定量限分别为0.13、0.13、0.14、0.13、0.15、0.14、0.14、0.14、0.13 μg/mL;精密度、重复性、稳定性试验的RSD均小于8%;平均加样回收率分别为94.95%、97.81%、101.88%、95.26%、93.40%、102.48%、104.26%、102.31%、96.42%、90.42%,RSD%分别为 1.89%、 1.86%、0.68%、1.30%、1.98%、3.36%、1.26%、1.30%、1.19%、1.40%(n=9)。5批注射用特利加压素制剂中杂质总含量均小于4%。结论:建立的方法快速、简便、准确、专属性强,可用于注射用特利加压素中有关物质的定量分析。
关键词 超高效液相色谱法;注射用特利加压素;有关物质;含量测定
Content Determination of Related Substances in Terlipressin for Injection by UPLC
XUE Qiaoru,YUAN Jinye,DING Liuyang,ZHENG Weijun,DENG Feng(Guangdong Institute for Drug Control/NMPA Key Laboratory of Quality Control of Blood Products/Key Laboratory of Quality Control and Research of Blood Products, Guangzhou, 510663, China)
ABSTRACT OBJECTIVE: To establish UPLC method for the content determination of related substances in Terlipressin for injection. METHODS: UPLC method was used to determine the contents of related substances in 5 batches of Terlipressin for injection. The separation was performed on Xtimate UPLC C18 column with mobile phase A consisted of ammonium sulfate buffer (pH 2.3) -methanol (90 ∶ 10, V/V) and mobile phase B consisted of ammonium sulfate buffer (pH 2.3) -methanol (60 ∶ 40, V/V) (gradient elution) at the flow rate of 0.2 mL/min. The detection wavelength was set at 210 nm, and sample size was 5 μL. RESULTS: The linear range of impurity A, B, C, D, F, H, I, K, L and N were 0.43-3.86, 0.44-3.95,0.44-3.97,0.45-4.08,0.45-4.05,0.50-4.50,0.47-4.26, 0.47-4.23,0.46-4.13,0.44-3.96 μg/mL (r≥0.999 7), respectively. The detection limits were 0.04, 0.04, 0.05, 0.04, 0.05, 0.05, 0.05, 0.05, 0.04 μg/mL. The quantitation limits were 0.13, 0.13, 0.14, 0.13, 0.15, 0.14, 0.14, 0.14, 0.13 μg/mL, respectively. RSDs of precision, reproducibility and stability tests were all lower than 8%. The average recoveries were 94.95%, 97.81%, 101.88%, 95.26%, 93.40%, 102.48%, 104.26%, 102.31%, 96.42%, 90.42%, with RSDs of 1.89%, 1.86%, 0.68%, 1.30%, 1.98%, 3.36%, 1.26%, 1.30%, 1.19%, 1.40% (n=9), respectively. Total contents of impurities in 5 batches of Terlipressin for injection were all lower than 4%. CONCLUSIONS: Established method is rapid, simple, accurate and specific, which can be used for the quantitative analysis for related substances in Terlipressin for injection.
KEYWORDS UPLC; Terlipressin for injection; Related substance; Content determination
注射用特利加压素的主成分为醋酸特利加压素(Terlipressin),其化学名为L-甘氨酰-L-甘氨酰-L-甘氨酰-L-半胱氨酰-L-酪氨酰-L-苯丙氨酰-L-谷氨酰氨酰-L-天冬酰氨酰-L-半胱氨酰-L-脯氨酰-L-赖氨酰-L-甘氨酰胺醋酸盐(4→9-二硫环)[1]。醋酸特利加压素是人工合成的一种新型长效血管加压素,本身无活性,在体内氨基肽酶的作用下切除三甘氨酰基,从而缓慢释放活性代谢产物赖氨酸加压素,发挥疗效[2-3]。临床主要用于肝硬化静脉曲张出血的止血[4-5],在治疗难治性休克、肝硬化腹水也有较好的临床应用前景[6-7]。
醋酸特利加压素于20世纪80年代由德国辉凌公司研发并生产上市,目前,国内仅有1家企业研发生产。2017年版《欧洲药典》[8]新收载的醋酸特利加压素药品标准中采用高效液相色谱法分析特利加压素的9种降解杂质及3种工艺杂质(杂质A~L),但经本课题组前期验证后发现,杂质I和F不能有效分开,且无法检出杂质N。国家药典委员会于2015年3月发布的“关于注射用特利加压素国家标准的公示”[8]中该制剂的有关物质的检查项也采用高效液相色谱法,但并未规定对各杂质峰进行定性分析;后续本课题组采用此标准方法对各杂质进行定性分析后发现,醋酸特利加压素峰和杂质A、C峰的分离度小于1.5,杂质H、I、F不能有效分离,且无法检出杂质N。基于此,笔者拟建立超高效液相色谱(UPLC)法对注射用特利加压素中的10种杂质(杂质A、B、C、D、F、K、L、I、H、N)进行考察,以期控制该制剂的杂质,也为该制剂中有关物质的检测提供新的方法。注射用特利加压素中10种杂质的信息见表1。
1 材料
1.1 仪器
Vanquish 系列UPLC仪、全自动进样器、紫外检测器(美国Thermo Fisher Scientific 公司); e2695 型高效液相色谱仪、全自动进样器、2489紫外检测器(美国Waters公司);十万分之一电子天平(瑞士梅特勒-托利多仪器有限公司)。
1.2 药品与试剂
醋酸特利加压素对照品(中国食品药品检定研究院,批号:150701-201501,纯度:85.4%);杂质A(批号:RSCY-15401001,纯度:88.0%)、杂质B(批号:RSCY- 15402001,纯度:87.2%)、杂质C(批号:RSCY-15403001,纯度:85.0%)、杂质D(批号:RSCY-15404001,纯度:91.6%)、杂质F(批号:RSCY-15405001,纯度:95.3%)、杂质K(批号:RSCY-15408001,纯度:95.3%)、杂质L(批号:RSCY-15409001,纯度:94.7%)、杂质I(批号:RSCY- 15407001,纯度:90.7%)、杂质H(批号:RSCY-15406001,纯度:92.3%)、杂质N(批号:RSCY-15411001,纯度:89.4%)均为甲企业自制;注射用特利加压素制剂1(甲企业,批号:P10371C)、制剂2(甲企业,批号:M1503C)、制剂3(甲企业,批号:P13208C)、制剂4(乙企业,批号:1227181104)、制剂5(乙企业,批号:1127190301)的规格均为1 mg/支(相当于特利加压素0.86 mg);甲醇为色谱纯,硫酸铵为分析纯,水为超纯水。
2 方法与结果
2.1 色谱条件
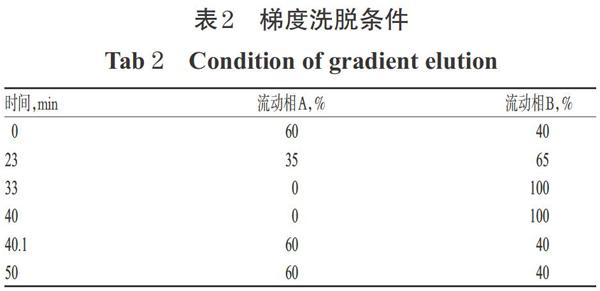
色谱柱为Xtimate UPLC C18(100 mm×2.1 mm,1.8 μm);硫酸铵缓冲液(取硫酸铵6.6 g,加1 000 mL水溶解,用硫酸调节pH至2.3,下同)-甲醇(90:10,V/V)为流动相A,硫酸铵缓冲液-甲醇(60 ∶ 40,V/V)为流动相B,梯度洗脱 50 min;流速为0.2 mL/min;进样量为5 μL;检测波长为210 nm;柱温为40 ℃。梯度洗脱条件见表2。
2.2 溶液的制备
2.2.1 系统适用性溶液的制备 精密称取杂质A、B、C、D、F、H、I、K、L、N对照品各适量,用0.9%氯化钠溶液制成每1 mL中约含0.1 mg各杂质的溶液,作为混合杂质对照品母液;精密称取醋酸特利加压素对照品25 mg,加入上述对照品母液1 mL,用0.9%氯化钠溶液定容至50 mL,即得系统适用性溶液。
2.2.2 混合对照品溶液的制备 精密称取醋酸特利加压素对照品12 mg,用0.9%氯化钠溶液定容至100 mL,摇匀,制成每1 mL约含0.1 mg特利加压素的溶液,作为特利加压素对照品溶液;精密量取上述溶液1.0 mL,加入“2.2.1”项下混合杂质对照品母液1.0 mL,用0.9%氯化钠溶液定容至50 mL,即得混合对照品溶液。
2.2.3 供试品溶液的制备 取注射用特利加压素制剂1支,精密加入0.9%氯化钠溶液2 mL溶解,制成每1 mL中的含有特利加压素0.43 mg的供试品溶液。
2.3 系统适用性试验
取“2.2.1”项下系统适用性溶液,按“2.1”项下色谱条件进样分析,记录色谱图。结果,各物质相邻峰间的分离度较好,理论板数均大于3 000。系统适用性试验色谱图见图1,特利加压素及各杂质的保留时间、分离度和理论板数见表3。
2.4 专属性试验
2.4.1 輔料干扰试验 取甘露醇5.08 g,加水400 mL溶解,加稀盐酸调节pH至3.51,然后加水稀释至500 mL,摇匀,即得空白辅料溶液;精密量取5 μL空白辅料溶液,按“2.1”项下色谱条件进样分析,记录色谱图,详见图2。结果,注射用特利加压素的辅料及溶剂对特利加压素的测定无干扰。
2.4.2 破坏性试验 取1支注射液用特利加压素制剂3,加入2 mL 0.9%氯化钠溶液溶解,作为未破坏样品溶液。另取6份制剂3,按以下条件进行破坏——(1)酸破坏:取1支注射液用特利加压素制剂3,加入1 mol/L盐酸溶液1 mL溶解,于室温放置1 h后,加1 mol/L氢氧化钠溶液1 mL中和,即得酸破坏溶液。(2)碱破坏:取1支注射液用特利加压素制剂3,加 1 mol/L氢氧化钠溶液1 mL溶解,于室温放置20 min后,加1 mol/L盐酸溶液1 mL中和,即得碱破坏溶液。(3)高温破坏:取1支注射液用特利加压素制剂3,置于80 ℃恒温箱中放置1 d后,加入0.9%氯化钠溶液2 mL溶解,即得高温破坏溶液。(4)高湿破坏:取1支注射液用特利加压素制剂3,敞口置于高湿(恒温干燥器,下部放置硫酸铵饱和溶液)室温环境中24 h后,加0.9%氯化钠溶液2 mL溶解,即得高湿破坏溶液。(5)光照破坏:取1支注射液用特利加压素制剂3,于室温条件下光照[光照强度为(4 500±500) lx]48 h后,加0.9%氯化钠溶液2 mL溶解,即得光破坏溶液。(6)氧化破坏:取1支注射液用特利加压素制剂3,加入3%过氧化氢溶液2 mL溶解,于室温放置5 h后,即得氧化破坏溶液。将上述未破坏样品溶液与6种破坏试验样品溶液,按“2.1”项下色谱条件进样分析。结果显示,在不同破坏条件下,特利加压素峰与降解产物峰均能有效分离,其中酸破坏、碱破坏、氧化破坏试验样品中杂质明显增多,但光照破坏、高温破坏、高湿破坏试验样品中各杂质较少,表明特利加压素在酸性、碱性和氧化条件不稳定,易降解。破坏性试验图谱见图2。
2.5 线性关系考察
精密量取“2.2.1”项下混合杂质对照品母液和“2.2.2”项下特利加压素对照品溶液适量混合,分别用0.9%氯化钠溶液稀释制成每1 mL中含特利加壓素和杂质A、B、C、D、F、K、L、I、H、N均约为0.4、1.2、2.0、3.0、4.0 μg的系列溶液。吸取上述系列溶液,按“2.1”项下色谱条件进样分析,记录峰面积。分别以特利加压素和各杂质的质量浓度为横坐标(x)、相应峰面积为纵坐标(y)进行线性回归,结果详见表4。
2.6 检测限与定量限考察
取“2.2.2”项下混合对照品溶液适量,加入0.9%氯化钠溶液逐步稀释,按“2.1”项下色谱条件进样分析,记录峰面积。以信噪比为3 ∶ 1、10 ∶ 1分别计算检测限和定量限。结果,特利加压素和杂质A、B、C、D、F、K、L、I、H、N的检测限及定量限见表2。
2.7 精密度试验
取“2.2.2”项下混合对照品溶液适量,按“2.1”项下色谱条件连续进样6次,记录峰面积。结果,特利加压素和杂质A、B、C、D、F、H、I、L、K、N峰面积的RSD均小于1%(n=6),表明该方法精密度良好。
2.8 重复性试验
取注射液用特利加压素制剂1,平行6份操作,按“2.2.3”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样分析,记录峰面积,并以外标法计算各杂质的含量。结果,杂质A、B、C、D、F、H、I、L、K、N的含量分别为0.3%、0.2%、0.04%、0.02%、0.7%、0.3%、1.7%、0.2%、0.1%、0.1%,RSD分别为3.1%、3.9%、7.1%、5.2%、6.6%、7.3%、7.7%、6.2%、7.7%、2.1%(n=6)。
2.9 稳定性试验
取注射液用特利加压素制剂1,按“2.2.3”项下方法制备供试品溶液,于室温放置0、2、8、16、24、48 h时,按“2.1”项下色谱条件进样分析,记录峰面积。结果,杂质A、B、C、D、F、H、I、L、K、N峰面积的RSD均小于1%(n=6)。这表明供试品溶液在室温下放置48 h的稳定性良好。
2.10 加样回收率试验
精密量取“2.2.1”项下混合杂质对照品母液1 mL,分别用0.9%氯化钠稀释至200、100 mL,摇匀,分别作为50%回收测定用加标溶液1和100%回收测定用加标溶液2;另精密量取“2.2.1”项下混合杂质对照品母液1.2 mL,用0.9%氯化钠稀释至100 mL,摇匀,作为120%回收测定用加标溶液3。取9支已知杂质含量的注射液用特利加压素制剂1,每3支分别加入4 mL上述回收测定用加标溶液1、2、3,摇匀,按“2.1”项下色谱条件进样分析。结果,杂质A、B、C、D、F、H、I、K、L、N的平均加样回收率为94.95%、97.81%、101.88%、95.26%、93.40%、102.48%、104.26%、102.31%、96.42%、90.42%,RSD%分别为 1.89%、 1.86%、0.68%、1.30%、1.98%、3.36%、1.26%、1.30%、1.19%、1.40%(n=9)。
2.11 样品中有关物质的含量测定
取注射用特利加压素制剂1~5,按“2.2.3”项下方法制备供试品溶液,量取供试品溶液和“2.2.2”项下混合对照品溶液,按“2.1”项下色谱条件进样分析,记录峰面积。杂质A、B、C、D、F、H、I、K、N含量按外标法计算,未知杂质含量按主成分自身对照品法计算,结果见表5。
3 讨论
3.1 杂质来源分析
醋酸特利加压素属于有活性的多肽类药物,是心血管疾病与泌尿系统疾病的治疗药物[9]。多肽类药物具有活性强、不稳定、易降解的特点,质量控制的项目应重点关注有关物质检查项。多肽药物的有关物质主要分为4类:工艺杂质如断裂肽、缺失肽和错结肽等产物;降解杂质如多肽脱酰胺、氧化、还原、二硫键错配等的产物;聚合物如二聚体及多聚体;光学杂质如消旋体、非对映异构体[10]。其有关物质与其组成氨基酸的结构和特性有关,如组氨酸(His)、半胱氨酸(Cys)、苯丙氨酸(Phe)等易消旋,天冬酰胺(Asn)、谷氨酰胺(Gln)等易水解,蛋氨酸(Met)、半胱氨酸(Cys)、色氨酸(Trp)等易氧化等[11-12]。基于此,笔者再结合各杂质结构特点推测醋酸特利加压素的杂质A、B、C为降解杂质,杂质D、F、H为氧化杂质,杂质I、K、L为水解杂质,杂质N为聚合杂质。
3.2 色谱系统选择
本课题组前期考察了不同色谱柱[Ultimate UHPLC Lp-C18、Ultimate UHPLC AQ-C18、Xtimate UPLC C18、Acquity UPLCTM BEH C18]、不同柱温(25、30、35、40 ℃)、检测波长范围(210~280 nm)对特利加压素和各杂质的分离效果,结果发现,选择Xtimate UPLC C18色谱柱、柱温为40 ℃、检测波长为210 nm时能有效分离特利加压素和各杂质。
3.3 UPLC法測定有关物质含量的优点
采用2017年版《欧洲药典》中的高效液相色谱法检测特利加压素的有关物质时发现,杂质I和杂质F相对保留时间相同,无法得到有效分离,且杂质N无法检出。本试验建立的UPLC法可较好地解决上述问题。结果显示,杂质I和杂质F的分离度可达到1.3;杂质N可检出,保留时间为25 min左右。与原HPLC法[8]比较,UPLC法缩短了注射用特利加压素中有关物质的分析时间,减少了有机试剂的使用,大大节约了成本,后续可为注射用特利加压素有关物质的检测提供新方法。
参考文献
[ 1 ] 刘倩,李震,张媛,等.首批醋酸特利加压素化学对照品的研制[J].中国药事,2019,33(4):402-407.
[ 2 ] 戚虎昶,凌静,卢芳芳.特利加压素临床研究进展[J].解放军药学学报,2012,28(2):169-172.
[ 3 ] 蔡文昌. N-α-三甘氨酰-8-赖氨酸-加压素对残肝再生的作用及其机制的研究[D].上海:中国人民解放军海军军医大学,2018.
[ 4 ] 李晓路,李磊.特利加压素在肝硬化食管胃静脉曲张出血中的应用[J].临床肝胆病杂志,2019,35(10):2308-2311.
[ 5 ] 李海英,邵献洁.醋酸奥曲肽注射液联合特利加压素治疗肝硬化上消化道出血的疗效观察及护理[J].实用医技杂志,2015,22(12):1357-1359.
[ 6 ] 黎发家.肝叶切除术后预防性使用特利加压素30例报道[J].中国卫生产业,2013,10(5):88.
[ 7 ] SENDAR C,SILVA RUIZ MDP,FERRER RIOS MT, et al. Noradrenaline as an alternative medical treatment to terlipressin in the management of hepatorenal syndrome type 1[J]. Gastroenterol Hepatol,2018,41(7):440-441.
[ 8 ] 国家药典委员会.关于注射用醋酸特利加压素国家标准的公示[EB/OL].(2015-03-03)[2018-06-13]. http://www. chp.org.cn/view/402887ab4d273651014d2737aaaa07eb?a=BZHXYP.
[ 9 ] European Pharmacopoeia Committee. European Pharmacopoeia[S]. 2017 version. Strasbourg:the European Directorate for the Quality of Medicines & Health Care of the Council of Europe,2017:4623-4624.
[10] 王克全,徐寒梅.多肽类药物的研究进展[J].药学进展,2015,39(9):642-650.
[11] 田文静,任雪,廖海明,等.多肽类药物质量控制研究进展[J].药物分析杂志,2013,33(7):1115-1120.
[12] 胡玉玺,蒋煜,韩天娇.制备工艺和过程对合成多肽药物有关物质的影响[J].中国新药杂志,2017,26(18):2143- 2148.
(收稿日期:2020-01-30 修回日期:2020-03-11)
(编辑:唐晓莲)
