海鲈鱼糜加工及凝胶形成过程中蛋白质的变化机理
2020-07-23刘芳芳林婉玲李来好吴燕燕杨少玲杨贤庆
刘芳芳,林婉玲,李来好,吴燕燕,杨少玲,黄 卉,杨贤庆,林 织
(1.中国水产科学研究院南海水产研究所,国家水产品加工技术研发中心,农业农村部水产品加工重点实验室,广东 广州 510300;2.上海海洋大学食品学院,上海 201306;3.广东顺欣海洋渔业集团有限公司,广东 阳江 529800)
鱼糜是指己经去皮的鱼肉经过漂洗、脱水、精滤后得到的蛋白质浓缩物,有“浓缩的肌原纤维蛋白”之称[1]。鱼糜制品是以冷冻鱼糜或新鲜鱼糜为原料,添加辅料擂溃成鱼浆,然后成型、加热,制成具有弹性的凝胶体[2]。蛋白质凝胶是影响鱼糜制品品质的关键,其构象变化决定着凝胶特性。目前,热诱导鱼糜形成凝胶是较为普遍的凝胶形成方式。热诱导蛋白质凝胶是一个复杂的过程[3],加热可以改变蛋白质的二级结构,使α-螺旋结构部分向β-折叠和无规卷曲转化[4-5],同时也可诱导蛋白质性质及组成发生变化[6],如使蛋白质溶解度降低等[7]。漂洗、斩拌等加工工艺对蛋白质构象以及蛋白质之间的化学作用力有一定影响,漂洗可以使蛋白质溶解度以及巯基含量显著降低[8],蛋白质二级结构发生改变,肌球蛋白二级结构中的β-折叠含量减少[9]。但是,目前研究主要集中在漂洗和斩拌工艺对蛋白质组成、凝胶持水性、凝胶强度和质构特性等的影响[10-11],关于鱼糜加工及凝胶形成过程中蛋白质间化学作用力对蛋白质的二级结构的影响却鲜见报道。漂洗、斩拌等工艺对蛋白质构象、维持蛋白构象的化学作用力的影响以及他们之间相互变化关系鲜见研究,另外漂洗和斩拌对鱼糜微观结构的影响也鲜见报道。因此,研究鱼糜加工工艺及加热过程中蛋白质特性的变化,对揭示鱼糜凝胶形成机理具有重要的意义。
海水鱼因含有较高的盐溶蛋白而具有较好的凝胶特性,海鲈鱼(Perca fluviatilis)是我国重要的经济海水养殖鱼类之一,2017年全国海水养殖海鲈鱼产量为15.66万 t,比2016年增长13.56%,年产量逐年提升。但随着海鲈鱼产量增大及压塘问题的产生,对海鲈鱼加工品进行多样化开发己经迫在眉睫。海鲈鱼具有肉质洁白和骨刺较少的特点,并且富含蛋白质及人体必需氨基酸[12],很适合作为开发鱼糜产品的原料,生产海鲈鱼糜等产品也是海鲈鱼产量快速增长的需要。目前关于海鲈鱼糜的研究集中在高压处理鱼糜对凝胶强度的影响[13]、外援添加物[14]对鱼糜凝胶强度的影响以及混合鱼糜[15]的研究,更倾向于工艺的研究,而关于海鲈鱼糜凝胶机理的研究报道较少。本研究以海鲈鱼为原料,研究其鱼糜加工及凝胶形成过程中的蛋白质二级结构、三氯乙酸(trichloroacetic acid,TCA)-可溶性肽及蛋白质间化学作用力等特性的变化,揭示海鲈鱼糜加工及凝胶形成过程中蛋白质变化机理,为海鲈鱼糜的开发应用和海鲈鱼产业的发展提供理论支持。
1 材料与方法
1.1 材料与试剂
海鲈鱼购自广州市黄沙水产市场,平均体质量2.5 kg,购买后1 h内运往实验室,立即宰杀制作鱼糜,本实验制作鱼糜所用海鲈鱼均属同一批鱼。
食盐、白砂糖(食品级) 广州海珠区客村华润万家超市;氢氧化钠、尿素、氯化钠、TCA(均为分析纯)广州领驭生物科技有限公司;BeyoColorTM彩色预染蛋白 上海碧云天生物技术有限公司;微量总巯基测试盒 南京建成生物工程有限公司;三羟甲基氨基甲烷(tris(hydroxymethyl)aminomethane,Tris)(分析纯)美国Sigma公司;β-巯基乙醇、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)(电泳级) 上海麦克林生化科技有限公司。
1.2 仪器与设备
绞肉机 广东省佛山市顺德区陈村镇恒基隆五金机械厂;打浆机 湖南省长沙固利食品机械有限公司;IKA-T25组织匀浆机 德国IKA公司;HH-4快速恒温数显水浴箱 常州澳华仪器公司;Sunrise-basic吸光酶标仪 德国Tecan公司;Alpha1-4冷冻干燥机 德国Christ公司;IRAffinity-1傅里叶红外光谱仪 日本岛津公司。
1.3 方法
1.3.1 鱼糜凝胶制备工艺
原料处理→采肉→漂洗(水洗1 次、0.2%盐洗1 次,每次4 min,肉液比1∶4(g/mL))→挤压脱水(保证含水量低于80%)→斩拌(空斩5 min后加入质量分数1%食盐和质量分数1%白砂糖继续斩拌10 min,斩拌温度在4~10 ℃)→灌肠→低温加热(40 ℃加热30 min形成凝胶化鱼糜)→高温加热(将低温加热形成的凝胶化鱼糜,经过90 ℃加热30 min后形成鱼糜凝胶)。
1.3.2 pH值的测定
参考GB 5009.237—2016《食品pH值的测定》[16]。
1.3.3 水分含量的测定
参考GB 5009.3—2016《食品中水分的测定》[17]。
1.3.4 化学作用力测定
参照Tan等[18]方法稍作修改。称取1 g样品加10 mL A1提取液(0.6 mol/L NaCl),在5 000 r/min匀浆2 min,于4 ℃放置1 h,并在4 ℃、18 600 r/min离心25 min,上清液于4 ℃保存。上述离心所得沉淀加10 mL A2提取液(1.5 mol/L尿素和0.6 mol/L NaCl的混合液),5 000 r/min匀浆2 min,于4 ℃放置1 h,4 ℃、18 600 r/min离心25 min,上清液4 ℃保存。将上述离心沉淀加10 mL A3提取液(8 mol/L尿素和0.6 mol/L NaCl的混合液),在5 000 r/min匀浆2 min,于4 ℃层放置1 h,4 ℃、18 600 r/min离心25 min,上清液4 ℃保存,重复此步骤,并将2 次离心得到的上清液合并,4 ℃保存。继续向沉淀加10 mL A4提取液(0.5 mol/L β-巯基乙醇、0.6 mol/L NaCl和8 mol/L尿素的混合液,pH 7),在5 000 r/min匀浆2 min,4 ℃放置1 h,4 ℃、18 600 r/min离心,上清液4 ℃保存。上述各步离心后所得上清液分别加入等体积质量分数为20% TCA,3 950 r/min离心15 min,弃上清液,向沉淀中加入1 mL 1 mol/L NaOH溶液于4 ℃放置,采用双缩脲法测定其蛋白质的含量。离子键、氢键、疏水相互作用、二硫键的贡献分别以溶解于A1、A2、A3、A4蛋白质的相对质量分数表示。
1.3.5 蛋白质溶解度测定
参考刘海梅[19]方法,将1 g鱼糜样品溶解于20 mL 20 mmol/L Tris-HCl缓冲液(含0.01 mg/mL SDS,8 mol/L尿素和0.02 mg/mL β-巯基乙醇,pH 8.0)中,均质,混合液100 ℃加热2 min后,于室温搅拌4 h,然后10 000 r/min离心30 min后取上清液10 mL,添加0.5 mg/mL冷TCA至终质量浓度为0.1 mg/mL,混合液于4 ℃放置18 h,10 000 r/min离心3 min,沉淀物用10% TCA冲洗并溶解于0.5 mol/L NaOH溶液中。蛋白质含量用双缩脲法测定,溶解度表示为样品在溶剂中测得的蛋白质总量占总蛋白(凝胶直接溶解于0.5 mol/L NaOH溶液测得)的百分比。
1.3.6 总巯基含量测定
参照南京建成公司总巯基含量测试盒说明书进行。
1.3.7 TCA-可溶性肽测定
参考Benjakul等[20]方法并稍作修改。取2 g制备好的鱼糜样品至18 mL提前预冷的5% TCA溶液中,11 000 r/min均质2 min,4 ℃静置1 h,置于冷冻离心机中10 000 r/min离心15 min。根据双缩脲法测定上清液中的TCA-可溶性肽含量,以样品中Tyr物质的量计算,结果用μmol/g表示。
1.3.8 红外光谱法测定蛋白质的二级结构变化
参照胡熠等[21]方法,将样品冷冻干燥,取约2 mg干粉和200 mg KBr在研钵中充分研磨后取适量压片,压片完成后,用傅里叶红外光谱仪在400~4 000 cm-1的波数范围进行全波段扫描测定吸光度,确定鱼糜加工及凝胶形成过程。
1.3.9 电镜扫描
将样品切成小块,用2.5%戊二醛固定液浸泡24 h以上,再用0.1 mol/L磷酸缓冲液(pH 7.2)浸泡清洗20 min,重复4 次。依次用30%、50%、70%、90%、100%乙醇脱水15 min,最后用叔丁醇浸泡,每次15 min,重复3 次。冷冻干燥后镀金,最后进行电镜扫描观察。
1.4 数据分析
2 结果与分析
2.1 pH值及水分含量的变化
鱼肉pH值对鱼糜凝胶性能有显著的影响。pH值低于6.3时,会阻碍肌球蛋白三磷酸腺苷酶对肌球蛋白和肌动蛋白的结合;高于8.0时,蛋白质分子之间的静电斥力会增强,影响凝胶作用;pH 6.5~7.5有利于鱼糜凝胶的形成,超过这个范围时则容易造成蛋白质变性[22]。本研究的海鲈鱼在鱼糜加工及凝胶形成的过程中,pH值范围为6.39~6.77(表1),原料pH值略低于最适范围,但经过漂洗,鱼糜pH值显著增大。研究表明,清水漂洗可以不同程度地提高鱼肉的pH值,盐洗可使鱼肉pH值接近中性[23]。经过斩拌、加热形成凝胶后,pH值减小,这与鱼肉自身营养组成具有一定的关系。在斩拌过程中,脂肪酸释放导致pH值减小,但均在形成凝胶的最适pH值范围内。凝胶化鱼糜与斩拌鱼糜pH值差异不显著(P>0.05),而鱼糜凝胶相比于凝胶化鱼糜,pH值显著增大(P<0.05),这主要由于随着加热温度的升高,酸性基团特别是羧基减少,形成酯结合的侧链(R—CO—O—R’)[24],pH值增大;另外高温加热造成pH值增大与蛋白质变性、蛋白质结构变化、游离氨基增多也有一定的关系。
水作为鱼糜中含量最高的成分,在鱼糜凝胶形成过程中起着重要的作用。海鲈鱼糜加工及凝胶过程中含水量的变化如表1所示。海鲈鱼肉含水量为75.16%,经漂洗后,鱼糜的含水量上升至79.32%,主要是由于漂洗后鱼肉蛋白吸水膨胀。由于在斩拌时加入食盐和白砂糖,斩拌后鱼糜含水量显著降低(P<0.05)。后期经过40 ℃和90 ℃加热形成凝胶的过程中,鱼糜含水量变化不显著(P>0.05),但比斩拌鱼糜略高。鱼糜在凝胶形成过程中,蛋白质变性聚集形成空间三维网状结构,能够捕获更多的水分[25]。在鱼糜加工过程中,水分状态不断发生着变化,并且不易流动水与蛋白质的二级结构有一定的相关性,而蛋白质二级结构主要依靠蛋白质间化学作用力维持,因此,进一步研究鱼糜加工及凝胶形成过程中蛋白质间化学作用力的变化有利于进一步揭示鱼糜加工过程中蛋白质的变化机理。

表1 鱼糜加工及凝胶过程中pH值和含水量的变化Table 1 Changes in pH and water content during surimi processing and gelation
2.2 化学作用力的变化
在鱼糜凝胶形成过程中,蛋白质变性聚合形成空间三维网络结构。由图1可知,离子键和氢键在整个过程中呈下降趋势,说明离子键和氢键是主要维持蛋白质的天然结构,而不是维持凝胶三维网络的主要作用力。在鱼糜凝胶形成过程中,首先需要盐离子打破离子键,分散蛋白质,后经加热使得蛋白质变性聚集。由图1可知,相比于原料而言,鱼糜经过漂洗后离子键含量增大,斩拌后又减小,经过加热加工,离子键含量显著减小(P<0.05);氢键主要维持蛋白质二级结构中的α-螺旋结构,与蛋白质凝胶化、茹弹性有一定的关系,氢键在蛋白质受热变性时发生断裂,在鱼糜凝胶冷却以后会重新形成,起到稳定结合水、促使凝胶变硬的作用[26]。
疏水相互作用和二硫键在整个过程中呈上升趋势。在凝胶形成过程中,蛋白质变性并有序聚集形成三维网状结构,并且依靠离子键、氢键、疏水相互作用和二硫键等化学作用力达到平衡,其中疏水相互作用和二硫键发挥着主要的作用。疏水相互作用主要是蛋白质受热发生变性,疏水基团暴露,增强了相邻分子非极性基团的相互作用,发生聚集形成凝胶,对于未受热的蛋白质,这些基团被包埋在α-螺旋结构中。如图1所示,经过漂洗,海鲈鱼糜的疏水相互作用增加31%,这主要是因为漂洗会引起蛋白质的部分氧化,而蛋白质氧化会使蛋白质内部疏水结合被打破,疏水基团暴露,表面疏水性增加[27];斩拌后,疏水相互作用相比漂洗过程增加17%;40 ℃加热,对疏水相互作用影响相对较小;90 ℃加热形成鱼糜凝胶后,疏水相互作用显著增大(P<0.05)。疏水相互作用的形成主要是依靠加热,有研究表明,鱼肉在60 ℃时疏水相互作用达到最大,并且由于鱼种的不同,疏水相互作用最适形成温度也有所差异[28]。因此,在本实验中,40 ℃凝胶化鱼糜疏水相互作用显著小于90 ℃加热后形成的鱼糜凝胶(P<0.05)。
蛋白质的聚集与二硫键的生成紧密相关[29],形成于鱼糜加工的各个阶段。加热是热诱导凝胶形成过程中巯基氧化形成二硫键的主要原因,并且不同鱼类,二硫键形成的最适温度也不同[30-31]。如图1所示,漂洗鱼糜相比于鱼肉原料,二硫键显著增加,这主要是由于半胱氨酸属于氧化敏感氨基酸,并且含有巯基,经过氧化易形成二硫化物,在漂洗过程中活性氧攻击蛋白质,从而形成有利于蛋白质聚集的共价相互作用力二硫键。经斩拌后,二硫键相比漂洗过程仅增加8%,增加幅度较小;40 ℃和90 ℃加热后,二硫键分别相比于斩拌过程增加27%和93%,这说明加热是二硫键形成的主要原因,并且海鲈鱼二硫键最佳形成温度高于40 ℃。
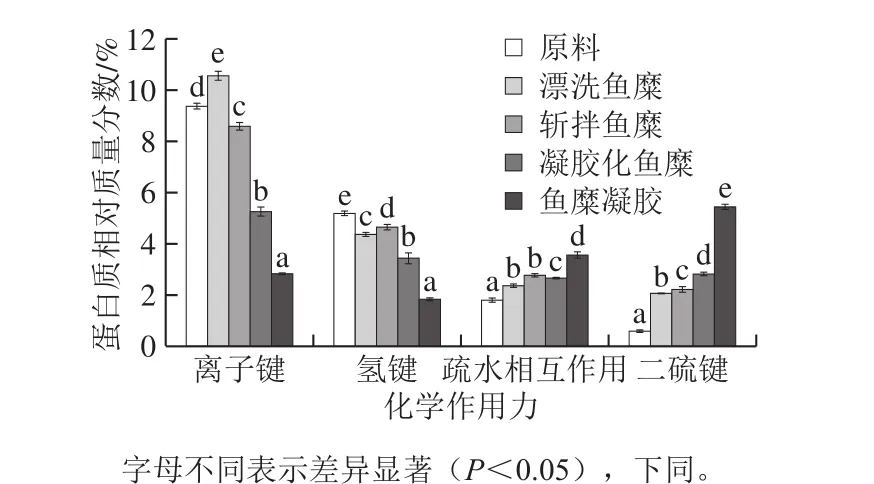
图1 鱼糜加工及凝胶过程中化学作用力的变化Fig. 1 Changes in chemical forces during surimi processing and gelation
2.3 非二硫共价键的变化
蛋白质的溶解度可以反映凝胶网络结构中形成的非二硫共价键的多少,非二硫共价键ε-(γ-Glu)-Lys的形成主要是转谷氨酰胺酶(transglutaminase,TGase)催化肌球蛋白重链的Glu残基的γ-酰胺基与Lys残基的ε-氨基之间发生交联作用,非二硫共价键也是鱼糜网络结构形成的主要化学作用力,赋予鱼糜较高的弹性和强度[32]。由图2可知,在鱼糜加工及凝胶形成过程中,蛋白质溶解度先降低后升高。在前期加工过程中蛋白质溶解度持续降低,40 ℃凝胶化鱼糜相比于原料,溶解度降低了60%,说明形成了非二硫共价键。目前己有研究表明,在4~40 ℃温度范围内,TGase均能催化形成非二硫共价键,增强凝胶强度[33]。而经过高温加热形成鱼糜凝胶时,蛋白溶解率显著增大,非二硫共价键含量低于低温凝胶化时的含量。刘海梅等[34]在鲢肌球蛋白胶凝过程化学键变化中研究发现,蛋白质溶解度随着温度的上升先降低后升高,呈V型分布,当温度过高时,非二硫共价键的形成则受到抑制,与本研究结论一致。
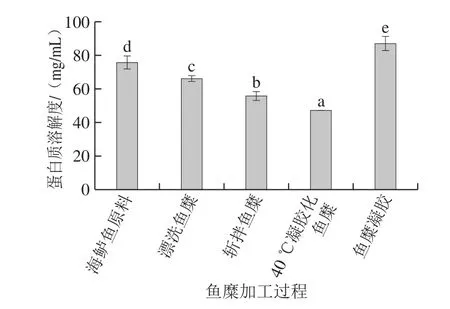
图2 鱼糜加工及凝胶过程中蛋白质溶解度的变化Fig. 2 Changes in protein solubility during surimi processing and gelation
2.4 巯基的变化
在蛋白凝胶形成过程中,巯基含量的降低意味着其被氧化生成二硫键[35]。有研究表明,低温(65 ℃)加热对牛肉蛋白的巯基没有显著影响,而高温加热会导致巯基含量下降[36]。如图3所示,巯基含量总体呈下降趋势;经过漂洗,巯基含量相比原料下降了28%;而斩拌、40 ℃加热对巯基含量影响不显著(P>0.05);90 ℃高温加热后,巯基含量再次显著下降,相比凝胶化鱼糜下降率为43%,与2.2节研究结果一致,进一步说明了海鲈鱼糜在加工及凝胶形成过程中,凝胶特性的形成与巯基减少和二硫键的增多有关。
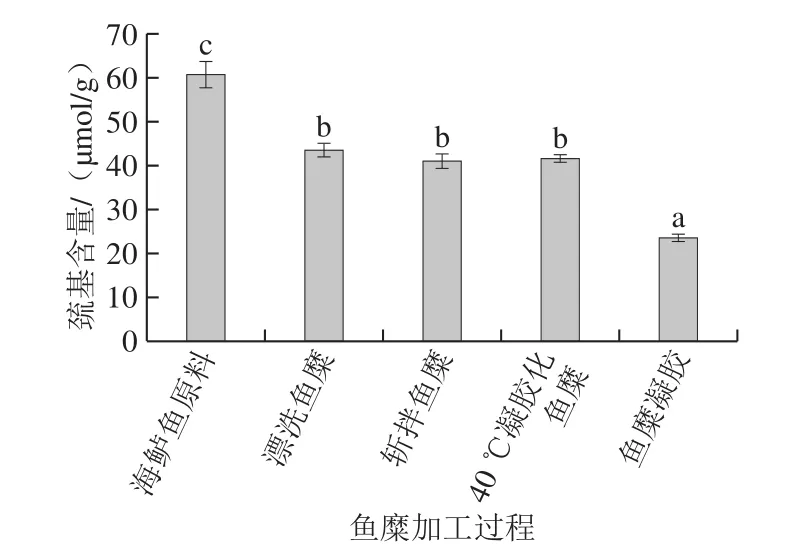
图3 鱼糜加工及凝胶过程中巯基含量的变化Fig. 3 Changes in sulfhydryl group content during processing and gelation of surimi
2.5 TCA-可溶性肽含量的变化
TCA-可溶性肽反映鱼糜凝胶中小分子肽的含量,从而反映蛋白质在内源性组织蛋白酶作用下的水解程度,其含量与蛋白质降解程度呈负相关[37]。由图4可知,漂洗造成TCA-可溶性肽含量显著降低(P<0.05),其主要原因是蛋白质的降解与组织蛋白酶有关,而漂洗可以除去鱼肉组织蛋白酶,从而有效抑制蛋白质的降解,使TCA-可溶性肽含量从99.58 μmol/g下降至16.58 μmol/g。钱娟等[38]己证明清水漂洗可以有效抑制蛋白质的降解。斩拌对蛋白质降解程度无明显影响,而经过40 ℃低温加热后,TCA-可溶性肽含量显著增大(P<0.05),这是由于加热使得漂洗未除尽的内源蛋白酶活性增强,从而加速蛋白质的降解,导致TCA-可溶性肽含量增大68%。经过90 ℃高温加热形成凝胶后,TCA-可溶性肽含量显著降低(P<0.05),因为此时蛋白凝胶形成,由于蛋白质间相互作用的关系,使得蛋白质内部形成稳定的结构,被降解程度降低,TCA-可溶性肽含量随之减少。
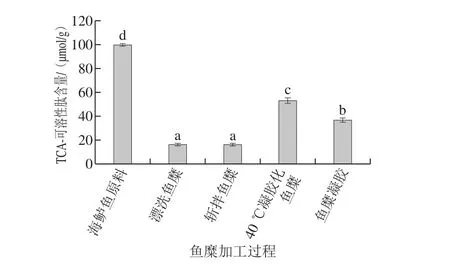
图4 鱼糜加工及凝胶过程中TCA-可溶性肽含量的变化Fig. 4 Changes in TCA-soluble peptide content during processing and gelation of surimi
2.6 蛋白质二级结构的变化
酰胺I带(1 600~1 700 cm-1)常用来分析蛋白质二级结构的变化规律[39],通常认定1 600~1 640 cm-1波数范围是β-折叠;1 640~1 650 cm-1波数范围是无规卷曲;1 650~1 660 cm-1波数范围是α-螺旋;1 660~1 695 cm-1波数范围是β-转角。本实验中,红外光谱图采用Peakfit 4.12软件对酰胺I带进行去卷积、二阶导和高斯拟合处理,最终使各子峰分开,利用面积比确定蛋白质二级结构变化规律。
由表2可知,总体上β-折叠和无规卷曲呈先下降后上升再下降的趋势,α-螺旋含量持续下降,β-转角先上升后下降再上升。漂洗过后相比于鱼肉原料,β-折叠含量下降13%,β-转角含量上升39%,α-螺旋和无规卷曲含量变化不显著(P>0.05)。袁凯等[8]研究表明,在4 ℃条件下,随着漂洗次数增加,β-折叠含量持续下降;卢岩[40]研究发现,随着H2O2浓度增加,β-折叠和α-螺旋结构明显减少,证实了氧化会导致蛋白质二级结构发生改变。因此漂洗过程中,蛋白质氧化是导致蛋白质二级结构改变的主要原因。斩拌是鱼糜凝胶制备的一道重要工序,斩拌过程中,剪切力和NaCl溶解的共同作用会促进蛋白质高级结构的展开[41],Kang Zhuangli等[42]研究表明,猪肉糜中随着NaCl添加量的增加,β-折叠相对含量有升高趋势。本实验中,经过斩拌,β-折叠和无规卷曲结构显著上升(P<0.05),α-螺旋和β-转角显著下降(P<0.05),表明斩拌使α-螺旋解旋形成β-折叠和无规卷曲结构;经过40 ℃低温加热,相比斩拌鱼糜,β-折叠和β-转角含量分别增加8%和6%,无规卷曲含量下降12%,α-螺旋结构无明显变化;而当凝胶化鱼糜经90 ℃高温加热形成凝胶后,β-折叠、无规卷曲和α-螺旋含量都下降,β-转角含量显著增加(P<0.05)。有研究表明,高温加热时α-螺旋解旋主要形成β-折叠和无规卷曲结构[19]。贾丹[43]研究发现,青鱼鱼糜经过90 ℃高温加热后,β-转角结构明显增加,而鲢鱼鱼糜无规卷曲结构显著增加。其原因主要由于不同鱼种的蛋白构象存在差异,从而导致高级结构和功能特性的差异。
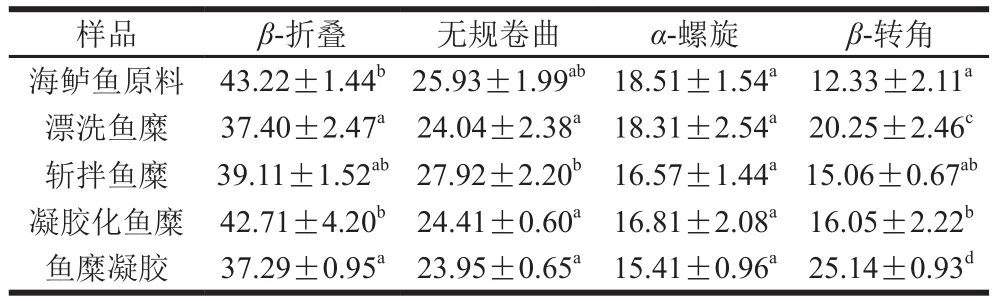
表2 鱼糜加工及凝胶过程中蛋白质二级结构的变化Table 2 Changes in protein secondary structures during surimi processing and gelation%
2.7 相关性分析
蛋白质构象通过蛋白质间化学作用力维持,有研究指出,α-螺旋是依靠肌原纤维蛋白分子内氢键形成的,β-折叠是依赖蛋白质分子间氢键形成的[44];氢键和离子键主要维持蛋白质的天然结构,疏水性相互作用是蛋白质变性形成紧凑结构的主要驱动力。如表3所示,化学键之间相关关系极显著(P<0.01),疏水键和巯基与水解度显著相关(P<0.05);α-螺旋结构与离子键、氢键和巯基相关系数分别为0.545、0.54、0.534,均显著正相关,与疏水键和二硫键显著负相关,相关系数分别为-0.620、-0.562。β-转角与离子键显著负相关,与氢键和巯基极显著负相关(P<0.01),与疏水键和二硫键极显著正相关(P<0.01),相关系数为0.966。无规卷曲和β-折叠与蛋白质间化学键无显著相关性(P>0.05);蛋白质二级结构不同构象间也有一定的相关性,β-转角与β-折叠和无规卷曲显著负相关(P<0.05)。
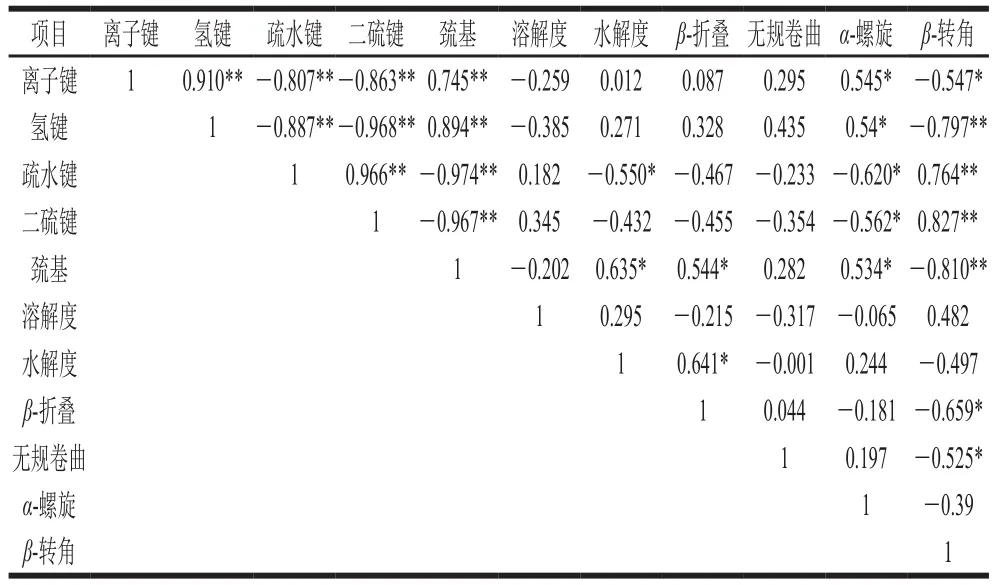
表3 鱼糜加工及凝胶过程中理化指标相关性分析Table 3 Correlation analysis of physicochemical indicators during surimi processing and gelation process
2.8 微观结构变化

图5 鱼糜加工及凝胶过程中微观结构的变化Fig. 5 Microstructure changes during surimi processing and gelation
本研究发现蛋白质在漂洗、斩拌以及加热过程中都发生变化,并且这些变化与蛋白质的聚合有一定的相关关系,而鱼糜的凝胶形成是在蛋白质间化学作用力的共同作用下形成的,并且鱼糜凝胶结构的变化是蛋白质解聚、聚合的表观。因此,对鱼糜凝胶微观结构的研究,有利于进一步研究鱼糜加工及凝胶形成过程中蛋白质的聚合过程。由图5可知,漂洗对鱼糜网络结构无明显影响,而经过斩拌后,原本疏松的鱼糜网络结构开始局部出现较大的网孔结构。在低温加热后,凝胶化鱼糜开始有蛋白颗粒堆积,并且网孔结构更为明显,孔径也明显减小,但是相比于90 ℃加热后形成的稳定鱼糜凝胶,低温凝胶化没有形成明显的三维网络结构。90 ℃加热形成的鱼糜凝胶结构紧密,且可明显看到聚集簇的形成,进一步说明了凝胶的形成是天然蛋白质先发生变性解聚然后在蛋白质间相互作用下聚合的过程。
3 结 论
本实验通过海鲈鱼糜加工及凝胶形成过程中理化性质的变化,发现造成pH值改变的主要过程是漂洗和高温加热,而含水量的变化主要是由于漂洗和斩拌过程对水分的调节;90 ℃加热后离子键、氢键含量显著下降,疏水相互作用和二硫键形成的最适温度均高于40 ℃,漂洗和斩拌对化学键的影响比加热较小;蛋白质水解度和蛋白质溶解度在整个过程中都呈现先减小后增加的趋势;漂洗对β-折叠和β-转角影响显著,斩拌、40 ℃加热和90 ℃对α-螺旋、无规卷曲、β-折叠和β-转角影响显著(P<0.05);各指标相关性分析可知,离子键和氢键与α-螺旋正相关,氢键的断裂伴随着稳定结构α-螺旋解旋形成相对不稳定的无规卷曲和β-转角,离子键、氢键、疏水键和二硫键与二级结构中的α-螺旋和β-转角有显著相关性,与β-折叠和无规卷曲无明显相关性,非二硫共价键与蛋白质二级结构均无明显相关性。
