肺曲菌病患者外周血中NLRP3-RIP2-NF-κB 信号通路的表达及意义
2020-07-21黄应翔
黄应翔
(福建省老年医院呼吸与危重症医学科 福州350009)
曲霉菌广泛存在于自然界中,为条件致病菌,可在肺或上呼吸道大量繁殖生长并全身播散致病。 肺曲霉病(Pulmonary Aspergillosis, PA)是一种临床常见的肺部真菌感染性疾病,临床分为3型:肺曲霉球、变态反应性曲霉病、侵袭性肺曲霉病(Invasive Pulmonary Aspergillosis, IPA)[1]。其中,IPA 严重威胁着免疫受损患者的生命,IPA 早期症状隐匿,痰培养阳性率低(<10%)。
核苷酸结合寡聚化结构域样受体蛋白3(Nucleotide Binding Oligomerization Domain-like Receptor Protein 3, NLRP3)受体是一种细胞质内的模式识别受体, 参与多种疾病炎症反应和免疫应答[2]。 文献报道在应激、炎症、免疫反应状态下,NLRP3可表达于多种炎性细胞内,NLRP3激活后可定位到质膜启动下游因子受体相互作用蛋白(RIP2)、核因子-κB(NF-κB)活化,促进多种细胞因子分泌,发生一系列级联式炎症反应,该信号通路贯穿于整个炎症过程[3]。 由于对NLRP3在曲霉菌感染中发挥作用的研究尚少,NLRP3、RIP2及NF-κB 三者在肺曲霉病发病机制中扮演的角色尚不明确。 本研究旨在探讨NLRP3、RIP2、NF-κB 在肺曲菌病患者外周血中的表达情况,探讨其相关致炎机制。 现报道如下:
1 资料与方法
1.1 一般资料 选取2016年5月~2019年10月福建省老年医院收治的肺曲菌病患者62例为研究对象,分为侵袭性肺曲霉菌病组(IPA 组)24例和非侵袭性肺曲霉菌病组(NIPA 组)38例,并选取同期20例非真菌感染者作为对照组。 其中男45例,女37例;年龄54~81岁,平均(57.68±15.35)岁。 所有患者采血前签署知情同意书,本次研究通过我院医学伦理委员会审核。
1.2 纳入标准 根据2008年美国感染病学会曲霉病诊治临床实践指南的分级诊断标准,将肺曲霉病分为确诊、拟诊和疑诊3级[4]。 确诊患者需要组织病理学依据或者符合正常无菌部位标本曲霉培养阳性标准,拟诊需同时满足宿主因素、临床表现和微生物学证据条件,疑诊需满足宿主因素外,还需有临床表现或微生物学证据中一项。 非侵袭性肺曲霉病组包括慢性肺曲霉病、过敏性肺曲霉病、慢性坏死性肺曲霉病。
1.3 检测方法
1.3.1 标本处理 入院后留取各组患者外周血5ml,2500r/min 离心10min, 将上清转移至新的EP管保存。 再用PBS 洗涤血小板2次,以800r/min 离心10min 获得沉淀, 加入1ml-1Trizol 重悬。 按Trizol 一步法提取总RNA,加20μl 无RNA 酶的水溶解,按照Takara 公司逆转录试剂说明书要求合成cDNA,标本存于-80℃。
1.3.2 实时荧光定量PCR 法检测NLRP3、RIP2和NF-κB mRNA 水平 每组取1ml 的外周血标本,加入200ul 的Trizol 裂解液中, 先提取总RNA,并按照逆转录试剂说明书逆转录为cDNA, 依据GenBank 设计NLRP3、RIP2、NF-κB、β-actin 引物序列。 见表1。 扩增PCR 反应体系,反应条件:94℃预变性1min 30s;94℃变性30s,57℃退火30s,72℃延伸30s,循环40次;最后72℃延伸5min。每份标本3个复孔, 复孔间Ct 值差异<0.5, 以β-actin为内参,Ct 值减去内参的Ct 值作为△Ct, 用2-△△Ct 表示目的基因的表达量。

表1 依据GenBank 序列设计引物
1.3.3 Western Blot 法检测NLRP3、RIP2、NF-κB 蛋白表达 每条泳道上样后,在聚丙烯酰胺凝胶电泳,转膜,封闭后分别加入一抗、二抗孵育,ECL 发光试剂显色后摄像,图像分析,测定灰度值,以NLRP3、RIP2、NF-κB 与对应的内参β-actin 蛋白灰度值对比作为相对表达量。
1.3.4 ELISA 检测外周血超敏C 反应蛋白 (hs-CRP)与白细胞介素-6(IL-6)表达水平 严格根据人hs-CRP 和IL-6的ELISA 试剂盒说明书进行操作。
1.4 观察指标比较三组NLRP3、RIP2、NF-κB mRNA 及蛋白表达水平,三组外周血hs-CRP 与IL-6表达水平, 采用Spearman 相关性分析分析NLRP3mRNA 与RIP2、NF-κB、IL-6、hs-CRP 之间的相关性。
1.5 统计学处理 采用SPSS25.0统计学软件分析数据。 数据符合正态分布,计量资料采用(±s)表示,多组间比较采用单因素方差分析。不符合正态分布的数据,采用Spearman 相关性分析。 以P<0.05为差异有统计学意义。
2 结果
2.1 三组NLRP3、RIP2和NF-κB mRNA 表达水平比较 所有标本重复3次,并计算各组均值,将3组数据进行比较,差异有统计学意义(P<0.05)。 IPA组、NIPA 组NLRP3、RIP2、NF-κB mRNA 表达水平均高于对照组,且IPA 组高于NIPA 组,差异有统计学意义(P<0.05)。 见表2。
表2 三组NLRP3、RIP2、NF-κB mRNA 表达水平比较(±s)

表2 三组NLRP3、RIP2、NF-κB mRNA 表达水平比较(±s)
注:与对照组比较,*P<0.05;与NIPA 组比较,#P<0.05。
组别 n NLRP3mRNA RIP2mRNA NF-κB mRNA对照组NIPA 组IPA 组FP 2024381.34±0.353.45±0.85*7.57±1.71*#22.3610.0091.59±0.337.93±1.93*12.09±3.21*#18.4820.01812.43±3.3136.63±9.11*59.73±13.03*#19.4530.011
2.2 三组NLRP3、RIP2和NF-κB 蛋白表达水平比较 将三组数据进行比较,差异有统计学意义(P<0.05)。IPA 组、NIPA 组NLRP3、RIP2、NF-κB 蛋白表达水平均高于对照组,且IPA 组高于NIPA 组,差异有统计学意义(P<0.05)。 见表3。
表3 三组NLRP3、RIP2、NF-κB 蛋白表达水平比较(±s)
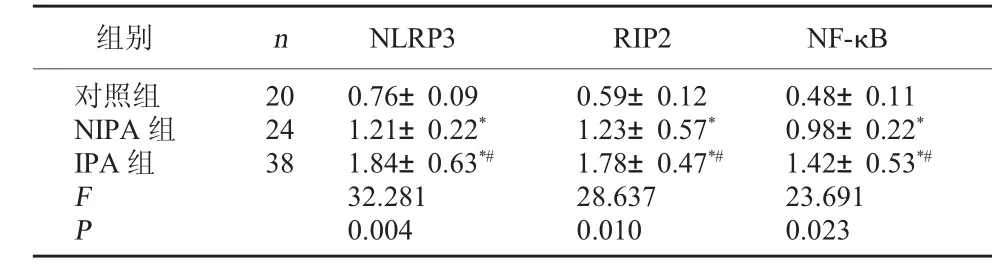
表3 三组NLRP3、RIP2、NF-κB 蛋白表达水平比较(±s)
注:与对照组比较,*P<0.05;与NIPA 组比较,#P<0.05。
组别 n NLRP3 RIP2 NF-κB对照组NIPA 组IPA 组FP 2024380.76±0.091.21±0.22*1.84±0.63*#32.2810.0040.59±0.121.23±0.57*1.78±0.47*#28.6370.0100.48±0.110.98±0.22*1.42±0.53*#23.6910.023
2.3 三组IL-6、hs-CRP 水平比较 将三组数据进行比较,差异有统计学意义(P<0.05)。IPA 组、NIPA组炎症介质IL-6、hs-CRP 水平均高于对照组,且IPA 组高于NIPA 组,差异有统计学意义(P<0.05)。见表4。
表4 三组IL-6与hs-CRP 水平比较(±s)

表4 三组IL-6与hs-CRP 水平比较(±s)
注:与对照组比较,*P<0.05;与NIPA 组比较,#P<0.05。
组别 n IL-6(ng/ml) hs-CRP(mg/L)对照组NIPA 组IPA 组F P 2024386.32±1.3719.47±4.85*25.53±6.02*#19.5220.0173.98±0.8912.46±3.42*19.27±4.25*#22.7520.008
2.4 NLRP3mRNA 与RIP2、NF-κB、IL-6、hs-CRP的相关性分析 Spearman 相关性分析显示,NLRP3mRNA 水平与下游基因RIP2、NF-κB mRNA 水平呈正相关(相关指数r=0.676,P<0.001;r=0.513,P<0.001);炎症介质IL-6、hs-CRP 水平与NLRP3mRNA水平呈正相关(相关指数r=0.467,P<0.001;r= 0.621,P<0.001)。 随着炎症介质水平的升高,NLRP3mRNA 表达水平亦上升。
3 讨论
曲霉菌是一类条件致病性真菌,对机体致病的曲霉包括烟曲霉、黄曲霉、黑曲霉、土曲霉、构巢曲霉等,肺是曲霉菌最常累及的部位[5]。 肺曲霉病可分布在不同临床科室,临床特点缺乏特异性,实验室检查阳性率低,故极易被漏诊。 曲霉菌侵入呼吸道,随即吸入的分生孢子可以激活肺泡中性粒细胞和巨噬细胞产生固有免疫,存活下来的曲霉菌株可触发炎性细胞的吞噬作用。 肺泡中炎性细胞在介导肺炎症反应中具有重要作用,激活多种信号通路,释放炎症介质,启动炎症反应和免疫应答[6]。 本研究通过观察NLRP3-RIP2-NF-κB 信号途径在肺曲霉病患者外周血中的表达情况,进一步探讨肺曲霉菌的发病机制,以期为临床靶向治疗提供依据。
NLRP3激活后可定位到细胞质膜,RIP2激酶作为其下游激活物, 进一步启动NF-κB 因子活化,调节相关靶基因转录,促进一系列炎症介质分泌[3]。关于炎性小体NLRP3在肺曲霉病患者中的表达情况的研究尚少, 故本研究通过观察肺曲霉病患者外周血中NLRP3、RIP2、NF-κB 的表达情况,进一步讨论炎性小体在肺曲霉病患者发病机制中发挥的作用。 我们发现IPA 组和NIPA 组NLRP3、RIP2、NF-κB mRNA 和蛋白的表达水平均较对照组高,NLRP3mRNA 水 平 与 下 游 基 因RIP2、NF-κB mRNA 水平呈正相关(P<0.001)。 说明炎性小体NLRP3参与肺曲霉患者的发病过程,发病机制可能是通过激活下游信号RIP2, 进一步活化NF-κB,诱导下游炎症介质、黏附分子及相关细胞凋亡蛋白等转录、表达[7]。 在肺曲霉菌侵袭的状态下,经过上述一系列级联式反应活化肺泡巨噬细胞和诱导炎性细胞聚集,促进肺泡巨噬细胞自噬,导致细胞凋亡或坏死,恶性循环使炎症反应扩大化,最终加重肺损伤,这与国外Gresnigt MS 等[8]人报道结果相一致。 可见本研究结果提示NLRP3为肺曲霉菌发病过程的重要始动因子,且参与了发病过程的调控,将其作为防治肺曲霉病的重要靶点具有一定的临床价值。
IL-6、hs-CRP 作为下游重要的炎症介质, 启动调节急性应激反应,加重炎症损伤,其水平与疾病的严重程度密切相关。IL-6是一类趋化炎症介质,主要由巨噬细胞、中性粒细胞产生, 具有多种生物学特点,能够刺激参与细胞增殖、分化并提高其功能,促进炎症损伤,加重肺部感染。 hs-CRP 作为一种急性时相反应蛋白,在肺部真菌感染的早期CRP 与细胞膜形成复合物沉积于血管内皮细胞, 促进炎性渗出[9]。 我们研究发现肺曲霉病患者炎症介质IL-6与hs-CRP 水平与正常对照组比较明显升高,尤其IPA组患者升高明显(P<0.001);相关性分析提示炎症介质IL-6、hs-CRP 水平与NLRP3mRNA 水平呈正相关(P<0.001)。 说明炎症介质IL-6、hs-CRP 升高与肺曲霉菌感染严重程度具有一定关系, 可以将NLRP3受体定量水平及下游炎症介质作为评估肺部曲霉菌感染严重程度的辅助效应指标。
综上所述, 外周血中NLRP3基因表达水平升高在肺曲霉病的发生、发展过程中发挥着重要作用。其机制可能与NLRP3-RIP2-NF-κB 信号途径有关,激活下游炎症介质hs-CRP、IL-6等释放, 可导致炎症反应加重。 可考虑将NLRP3受体水平及下游炎症介质作为诊断曲霉菌感染严重程度的辅助指标,但关于肺曲霉病的具体发病机制仍需进一步研究。
