依那普利对肾间质纤维化大鼠模型的治疗作用研究
2020-07-20邢诒喜陈维飞姚奇岑林千祺黄美琼张瑞城
邢诒喜,陈维飞,姚奇岑,林千祺,梁 金,黄美琼,张瑞城
0 引言
肾脏间质纤维化是慢性肾脏病(Chronic kidney disease,CKD)发展至终末期肾病的必经之路,阻止肾脏间质纤维化即是保护肾功能、防治慢性肾病的主要药物治疗靶点[1]。依那普利(Enalapril)是临床上常用的血管紧张素转换酶抑制剂(Angiotensin converting enzyme inhibitor,ACEI)[2],主要用于高血压、心力衰竭的治疗[3],临床应用中发现,ACEI药物具有肾保护作用[4]。本研究应用单侧输尿管梗阻(Unilateral urethral obstruction,UUO)大鼠模型探讨依那普利对肾脏间质纤维化的抑制作用,并探讨其相关机制。
1 材料和方法
1.1 主要试剂 依那普利片为江苏扬子江制药公司产品(批号:18102455),水合氯醛钠为美国Sigma公司产品(批号:1810023313),P65、TGF-β1、Smad3、Histone、β-actin抗体以及辣根过氧化物酶标记二抗购自美国Abcam公司(货号:ab30186、ab22174、ab02871、ab30185、ab20117),Masson 染色试剂盒购自美国Solarbio公司(批号:20180914),奥林巴斯显微镜为日本Olympus公司产品(BX53MRF-S),双垂直(DYCZ-25D)和转印电泳仪(DYCZ-40G)为北京市六一仪器厂产品。
1.2 实验动物 60只清洁级SD雄性大鼠购自海南医学院动物实验中心,6~8周龄,体重180~210 g,清洁级环境下适应性饲养3 d后,进行UUO模型制作。
1.3 实验造模、给药 参考本课题组的方法构建UUO大鼠模型[5],简述如下:使用数值表法将60只SD大鼠随机分为假手术组、模型组、低剂量[10 mg/(kg·d)]依那普利组(低剂量组)和高剂量[20 mg/(kg·d)]依那普利组(高剂量组),每组15只。60只SD大鼠给予10%水合氯醛钠腹腔注射麻醉,假手术组暴露肾脏并分离出左侧输尿管后不结扎,关腹,缝合皮肤切口,模型组、依那普利组用4 号无菌丝线双重结扎左侧输尿管,关腹,缝合皮肤切口。假手术组和模型组每天给等量生理盐水灌胃,依那普利组给予相应剂量依那普利灌胃,持续14 d。
1.4 肾组织的HE和Masson染色 14 d后,断颈处死各组大鼠,取出患侧肾脏组织送我院病理科制作石蜡切片,常规HE染色,200×光镜下选取 10 个视野(左上、左下、右上、右下、中间各2个)计算肾小管损伤评分,肾小管上皮细胞空泡变性、萎缩、坏死<10% 1分、<25% 2分、<50% 3分、<75% 4分、≥75% 5分。Masson 染色严格按照试剂盒说明书操作,Image 多媒体彩色病理图像分析软件采集图像,计算Masson 染色阳性面积占整个视野面积的百分比,计算肾间质纤维化评分,百分比<10% 1分,<25% 2分、<50% 3分、<75% 4分、≥75% 5分。
1.5 Western blot检测 14 d后,断颈处死各组大鼠,取出50 mg患侧肾脏组织,液氮下研磨,加入蛋白裂解液,混匀后,100 ℃水浴20 min,蛋白定量后每份样品取10 μg总蛋白进行SDS-PAGE凝胶电泳,蛋白电转移至PVDF膜,1∶1 000稀释入P65、TGF-β1、Smad3、Histone、β-actin抗体,4 ℃孵育过夜,加入二抗,使用碱性磷酸酯酶显色后,曝光目的条带。Bandscan 5.0软件扫描各条带,对照内参histone和β-actin计算各目的条带的相对灰度值。
1.6 统计学处理 应用SPSS 18.0软件进行统计学分析,两组均数间比较采用t检验,多组均数间比较采用单因素方差分析,组间两两比较采用LSD-t检验,计数资料比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 肾脏的组织病理学改变 从图1可见,假手术组肾组织结构正常,模型组、依那普利组肾小球萎缩,肾小管扩张,上皮细胞空泡变性、坏死,可见蛋白管型,间质炎性细胞浸润。假手术组、模型组、低剂量组和高剂量组肾小管损伤评分分别为0.12±0.02、4.12±0.61、3.11±0.34、2.47±0.26,四组间比较差异有统计学意义(F=10.81,P<0.01),其中依那普利组肾小管损伤评分显著低于模型组(P<0.01),高剂量组显著低于低剂量组(P<0.01)。
2.2 肾脏间质的Masson 染色结果分析 从图2可见,模型组间质纤维显著增多,依那普利组间质纤维显著减少。假手术组、模型组、低剂量组和高剂量组肾间质纤维化评分分别为0.26±0.05、3.64±0.53、2.48±0.36、1.83±0.22,四组间差异有统计学意义(F=11.317,P<0.01),其中,依那普利组肾间质纤维化评分显著低于模型组(P<0.01),高剂量组低于低剂量组(P<0.01)。
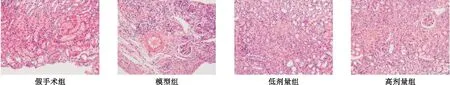
图1 四组肾组织HE染色(200×)
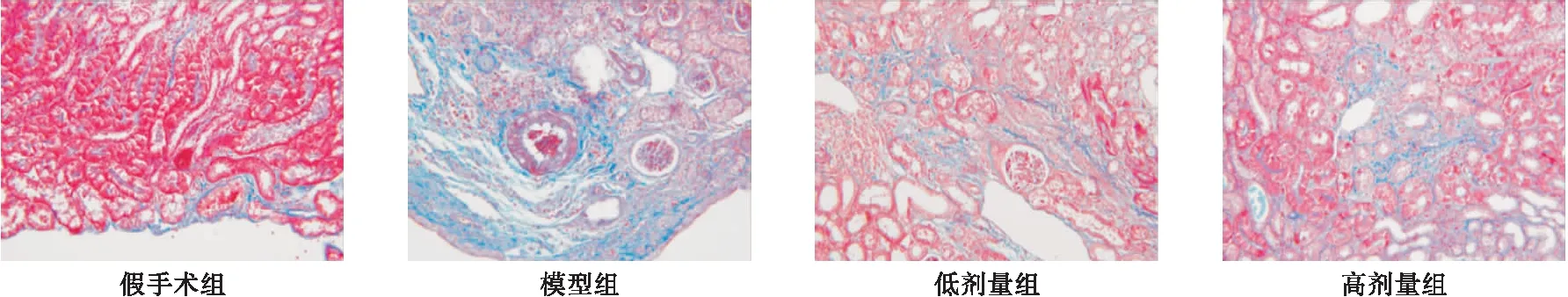
图2 四组肾间质Masson染色(200×)
2.3 依那普利对NF-κB/TGF-β1/Smad3通路的影响 从表1可见,四组P65、TGF-β1和Smad3蛋白相对灰度值比较差异有统计学意义(P<0.01),其中依那普利组P65、TGF-β1和Smad3蛋白相对灰度值显著低于模型组(P<0.01),高剂量组显著低于低剂量组(P<0.01)。图3显示了相应蛋白表达的变化。
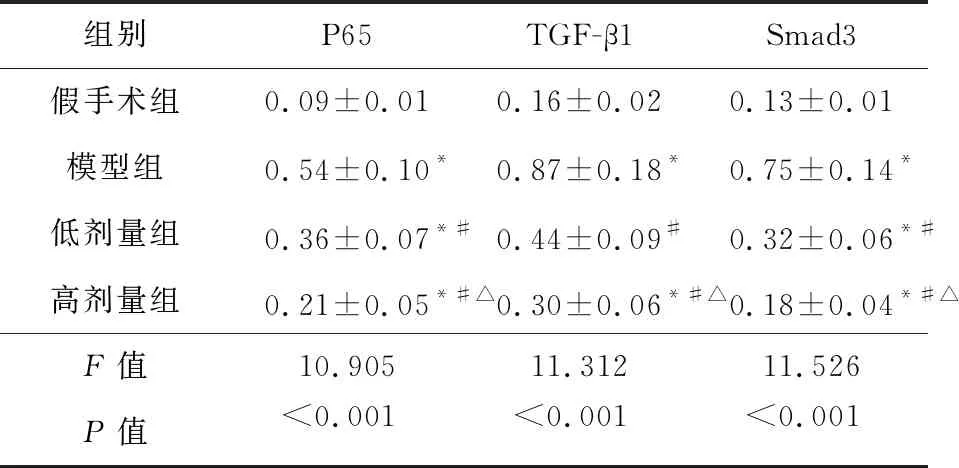
表1 四组P65、TGF-β1和Smad3蛋白相对灰度值比较

图3 蛋白的Western blot检测
3 讨论
肾纤维化是CKD疾病慢性进展的主要病理变化,延缓肾间质纤维化成为CKD疾病治疗首要考虑的问题[6]。临床使用中发现,ACEI抑制剂使用者肾间质纤维化指标优于未使用者[7],但对其作用机制未做深入研究,杨慧等[8]研究发现,依那普利可以阻止肾间质纤维化模型大鼠的肾小管上皮细胞凋亡,肾小管上皮细胞既是慢性炎症的受害者,同时受损的上皮细胞也可以分泌细胞因子参与到炎症中,保护上皮细胞,阻止炎症的级联放大[9]。本研究通过构建UUO大鼠模型,发现依那普利组肾小管损伤评分显著低于模型组,也说明依那普利对肾小管上皮细胞发挥保护作用,Masson染色分析依那普利组肾间质纤维化评分显著低于模型组,也说明依那普利可以抑制肾间质纤维化进程。
CKD疾病肾间质纤维化涉及到多种信号通路的激活[10],其中TGF-β1在肾间质纤维化中起到关键的作用[11],TGF-β1借助Smads家族中的转导分子转移到核内发挥基因调控作用[12]。Smad3是一个受体激活型小分子蛋白,可以促进TGF-β1信号转导[13-14]。本研究显示,模型组TGF-β1和Smad3蛋白显著高于假手术组,说明了肾间质纤维化TGF-β1/Smad3信号通路的激活,而依那普利组TGF-β1和Smad3蛋白低于模型组,说明依那普利可以抑制TGF-β1/Smad3信号通路。NF-κB是炎症和纤维化调控的上游通路,可以调节TGF-β1表达,P65是NF-κB通路中的关键蛋白,P65入核增多说明NF-κB通路的激活。本研究显示,模型组P65蛋白显著高于假手术组,说明NF-κB通路的激活,而依那普利组P65蛋白低于模型组,说明依那普利可以抑制NF-κB通路信号通路,对TGF-β1/Smad3的抑制有可能是通过抑制NF-κB通路实现的,具体机制还有待进一步的实验研究来阐明。
