表观遗传学药物FK228治疗肝癌的实验研究
2020-07-20刘魏然王宇喆韩天壮陈志忠尹化斌
刘魏然,王宇喆,韩天壮,陈志忠,钱 亭,尹化斌
0 引言
肝癌是严重危害人类健康的主要疾病之一[1],由于肝癌发病隐匿,绝大多数患者确诊时已处于中晚期,失去了最佳的手术机会,需要进行以化疗为主或为辅的综合治疗。目前常用的化疗药物包括蒽环类、氟尿嘧啶及顺铂类等,但由于其毒副反应大,患者的耐受性及敏感性差,因此寻找一种有效的化疗药物成为热点。
组蛋白去乙酰化酶抑制剂(Histone deacetylase inhibitor,HDACi)作为一种新的化疗药物,可以抑制组蛋白去乙酰化酶(Histone deacetylases,HDACs)的活性,在抗肿瘤方面表现出了强大的作用[2]。表观遗传学药物FK228是一类由紫色色素杆菌产生、主要分布在细胞核内、结构独特、高效、低毒、作用广谱的双环Ⅰ类HDACi[3]。目前,FK228已经被美国FDA 批准用于治疗外周及皮肤T-细胞淋巴瘤。为此,我们研究了FK228对人肝癌细胞HepG2体内外抑制作用,并初步探讨其作用机制,为临床治疗肝癌提供实验和理论依据。
1 材料与试药
1.1 实验动物和细胞系 BALB/c裸鼠,4~5周龄,均为雄性,体重约14~16 g,购于上海斯莱克实验动物有限公司,饲养于上海国睿生命科技有限公司。人肝癌细胞HepG2购自中国科学院干细胞库。
1.2 主要试剂 DMEN培养基为美国Sigma公司生产,胎牛血清(Fetal bovine serum,FBS)为美国Gibco公司产品,FITC Annexin V凋亡检测试剂为美国BD公司产品,CCK-8试剂盒和Matrigel基质胶均购于上海励韬生物科技有限公司,FK228购于上海陶素生化科技有限公司,5-FU购于上海旭东海普药业有限公司。
2 实验方法
2.1 细胞培养 人肝癌细胞株HepG2用含20%FBS的DMEM培养基,在5% CO2、37 ℃、饱和湿度条件下培养,细胞呈贴壁生长。
2.2 细胞增殖检测及药物的半数抑制浓度测定 取对数生长期的HepG2细胞,以5×103个/100 μl接种于96孔板中,常规培养24 h。实验分为4组,FK228组、5-FU组、联合组、正常对照组(药物溶剂对照)。FK228组设1.25、2.5、5、10、20、40 μg/L 6个浓度梯度,5-FU组设6.25、12.5、25、50、100、200 μg/ml 6个浓度梯度,联合组取5 μg/L的FK228和25 μg/ml的5-FU共同作用细胞,每个浓度设3个复孔。加药后将96孔板放入培养箱中继续培养48 h,然后向每孔加入10 μl的CCK-8试剂,继续培养2 h,用酶标仪检测450 nm处的吸光度(A)值。细胞生长抑制率=(Ac-As)/(Ac-Ab)×100%,细胞存活率=1-细胞抑制率,其中Ac表示对照孔的吸光度值,As表示实验孔的吸光度值,Ab表示空白孔的吸光度值,实验重复3次。
2.3 细胞凋亡检测 取对数生长的HepG2细胞,用胰酶消化后吹打成细胞悬液,以每孔5×105个细胞接种于六孔板,常规培养24 h。实验分4组:FK228组、5-FU组、联合组、正常对照组(药物溶剂对照),加药后,将六孔板放入培养箱,继续培养48 h后,收集各组细胞及细胞培养液。用遇冷的PBS洗涤2遍后,重悬细胞于Binding Buffer中,加入 FITC Annexin V 5 μl和PI 5 μl后,常温下避光作用15 min后用流式细胞仪检测细胞凋亡。实验重复3次。
2.4 HepG2细胞荷瘤鼠模型的建立 5周龄左右的BALB/c裸鼠于右侧腋窝皮下接种含Matrigel基质胶的HepG2细胞混悬液(0.2 ml/只,5×107个HepG2细胞/ml)。待瘤块长至一定大小后,处死荷瘤裸鼠。无菌条件下取出荷瘤鼠瘤块,于无菌磷酸盐缓冲液(Phosphatebuffered saline,PBS)中剪成1~2 mm3小块,再接种于20只裸鼠腋窝皮下,观察接种情况。
2.5 体内抑制实验 待肿瘤体积长至100~150 mm3后,将成瘤的20只裸鼠随机分成4组,即对照组、5-FU组、FK228组、联合组,每组5只。分组当天即给药,5-FU组的给药量为20 mg/kg,FK228组的给药量为1 mg/kg,对照组给等量的含溶剂的生理盐水,分别于第1、4、8、11天给药;联合组给药量按照FK228和5-FU单药组的剂量和频率进行给药。给药周期为21 d,每隔5 d用游标卡尺测量肿瘤大小,并计算肿瘤体积V=ab2/2,其中a表示肿瘤的长径,b表示肿瘤的短径。
2.6 免疫组化染色 21 d后处死裸鼠,立即取出裸鼠的肿瘤组织,用10%福尔马林溶液进行固定。将固定好的肿瘤组织进行脱水、包埋成石蜡组织块,将其制成切片后根据实验步骤进行caspase 3凋亡染色和CD31血管染色。凋亡的肿瘤细胞的胞质会被染成棕黄色,每组内每张切片随机挑选200倍视野进行拍照,拍照时尽量让组织充满整个视野,并且保证每张照片的背景光一致。应用Image-Pro Plus 6.0软件选取照片中相同的棕黄色作为判断阳性结果的统一标准,对每张照片进行分析,得出阳性的累积光密度(Integrated optical density,IOD)值。CD31表达于血管内皮,肿瘤内的血管内皮细胞内会出现棕黄色颗粒。肿瘤的微血管密度(Micro-vessel density,MVD)分析参照Weidner 等校对计数方法,先在低倍光镜下扫查整个切片,寻找3个血管高密度区,即“热点”;然后在200倍光镜下计数3个视野的血管数目平均值作为MVD值。
2.7 统计学方法 所有数据均采用SPSS 22.0统计分析软件与Graphpad 6.0分析软件进行分析,多组间计量资料的比较采用单因素方差分析,检验水准α=0.05。
3 结果
3.1 单独应用FK228与5-FU和两药联合应用对肝癌细胞HepG2生长的影响 FK228与5-FU对肝癌细胞HepG2均有明显的生长抑制作用,且均呈剂量依赖性。见图1。FK228的半数抑制浓度(IC50)为(4.20±0.24)μg/L;5-FU的IC50值为(117.50±8.40)μg/ml,表面FK228在极低浓度对HepG2就有较强的杀伤力。将浓度为5 μg/L的FK228和25 μg/ml的5-FU联合作用于细胞48 h,结果显示,与对照组相比,FK228可以抑制细胞活性,且与单药组相比,联合用药组的细胞存活率明显减低,差异具有统计学意义(P<0.01),见图2。
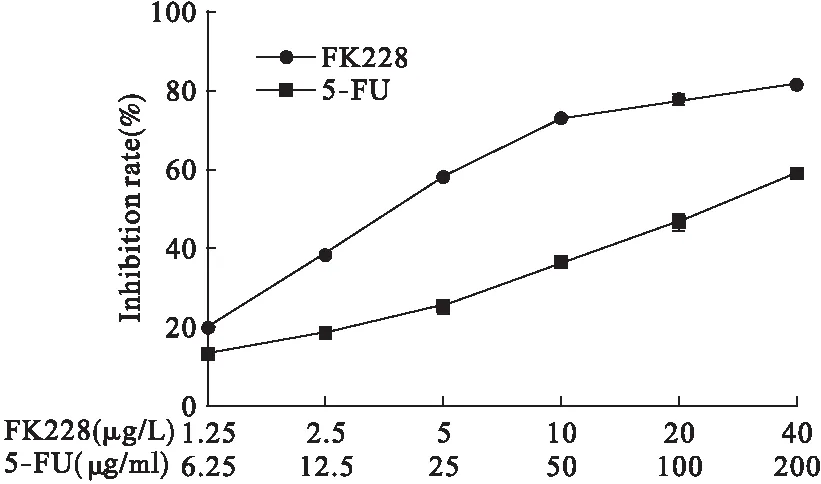
图1 FK228与5-FU对肝癌细胞HepG2的抑制作用
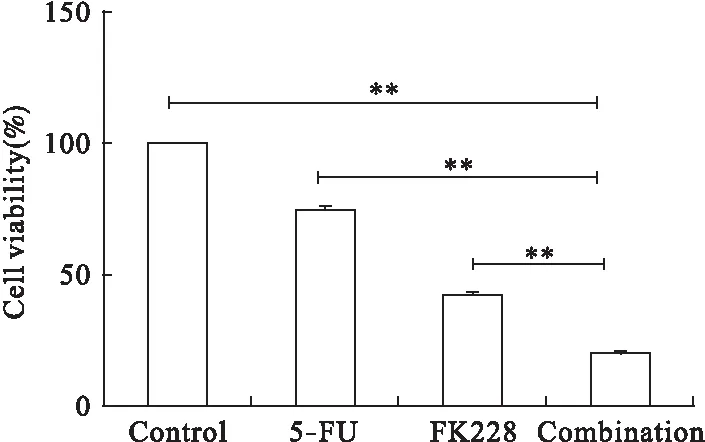
图2 FK228和5-FU单用与联合应用对肝癌细胞HepG2的生长活性影响
3.2 FK228与5-FU联合应用促进肝癌细胞HepG2的凋亡 流式细胞仪检测结果显示,与对照组相比,FK228、5-FU单独作用均可显著诱导肝癌细胞HepG2的凋亡,且联合用药后细胞的总体凋亡率较单药组相比明显增加,差异有统计学意义(P<0.05),而FK228与5-FU相比,两药对肝癌细胞HepG的体外促凋亡作用差异无统计学意义(P>0.05),见图3、图4。
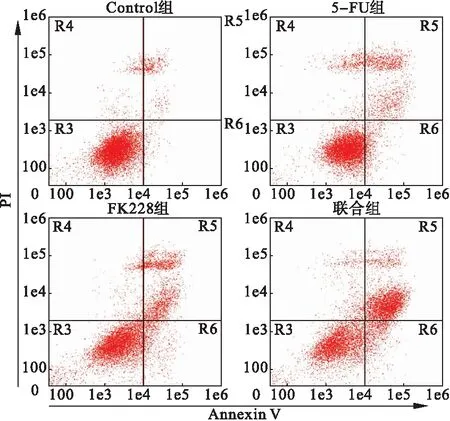
图3 采用PI/Annexin V双染法检测肝癌细胞HepG2凋亡的流式结果

图4 采用PI/Annexin V双染法检测肝癌细胞HepG2凋亡的流式结果
3.3 FK228对裸鼠皮下HepG2移植瘤的生长抑制作用 各组肿瘤治疗后的体积变化如图5所示,在治疗后的第21天,FK228组、5-FU组、联合给药组及对照组的肿瘤体积分别为(344.71±118.87)、(351.97±73.46)、(220.36±72.12)、(639.76±241.47) mm3。FK228组、5-FU组、联合给药组的裸鼠肿瘤体积均小于对照组,差异有统计学意义(P<0.05或P<0.01)。表明经FK228的治疗,裸鼠肿瘤的增长减慢,且联合用药后对裸鼠肿瘤的生长抑制作用更加明显。

图5 各治疗组的裸鼠皮下肝癌体积随时间变化曲线
3.4 FK228和5-FU联合给药促进肝癌细胞HepG2的体内凋亡及抑制肿瘤的血管生成 免疫组化结果显示,与对照组相比,FK228对肝癌细胞HepG2的体内促凋亡作用并不明显(P>0.05),但与5-FU联合应用后,促凋亡作用较单独用药组明显增强(P<0.05)。与对照组相比,FK228可以明显抑制肿瘤内的血管生成(P<0.05);5-FU单独使用时,其MVD值与对照组比较差异无统计学意义,与FK228联合后,可以明显抑制肿瘤内的血管生成。表明FK228与5-FU联合用药后,可能通过促进肝癌细胞HepG2的凋亡及抑制肿瘤的血管生成,从而抑制裸鼠皮下移植瘤的生长。见图6、图7。
4 讨论
FK228因其特殊的缩酯环肽结构,可有效透过细胞膜,通过抑制组蛋白去乙酰化酶抑制剂而发挥抗肿瘤作用。尽管目前FK228仅被批准用于淋巴瘤的治疗,但对其他人癌细胞系的体外实验和对人瘤嫁接物及鼠瘤的体内实验中,FK228均显示了良好的抗肿瘤活性[4]。FK228的体外抗肿瘤作用极其显著(IC50在纳克水平),研究已证明,FK228对多种肿瘤细胞如肺癌、肝癌、肾细胞癌、前列腺癌、乳腺癌、结肠癌等作用效果良好[5-10]。
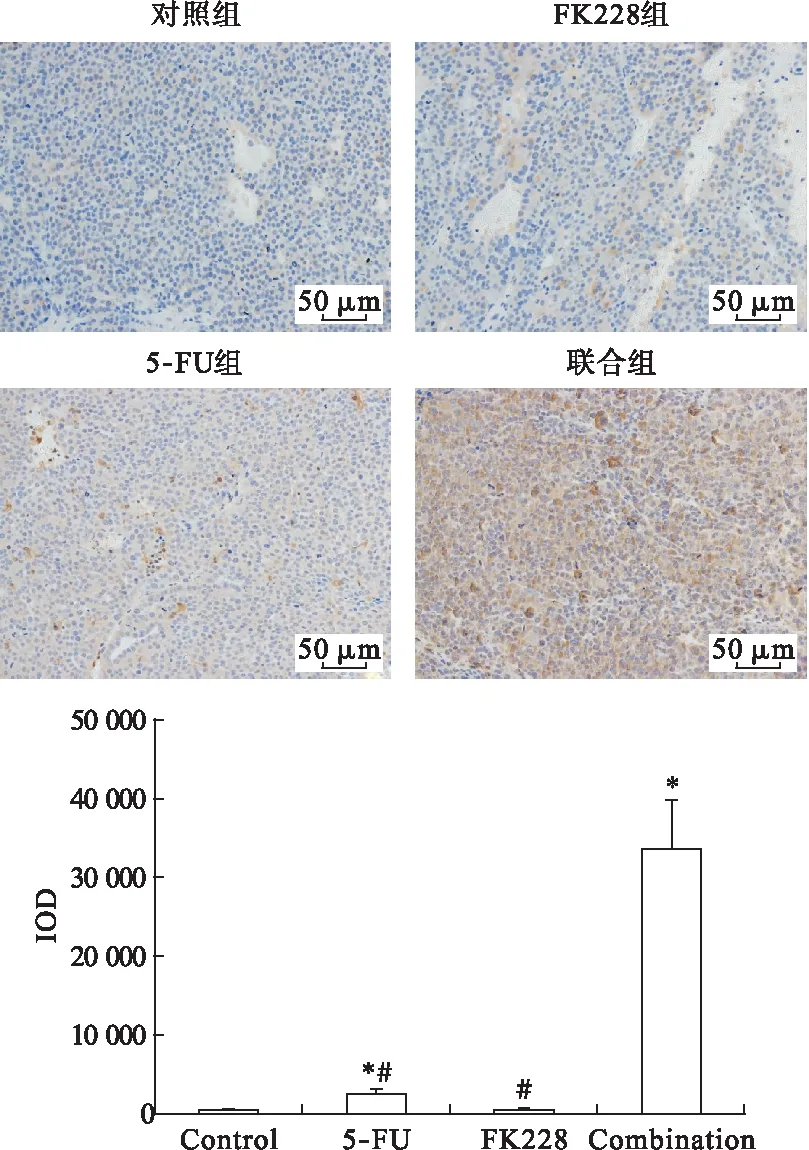
图6 各组肿瘤组织的caspase-3染色结果(200×)

图7 各治疗组肿瘤组织的CD31染色结果(200×)
本实验通过CCK-8法证明了FK228与5-FU可以体外抑制肝癌细胞HepG2的增殖,呈剂量依赖性,且联合用药后细胞的生长抑制率明显增加;5-FU对HepG2细胞48 h的IC50分别为(117.50±8.40)μg/ml,而FK228的IC50值为(4.20±0.24)μg/L。通过构建裸鼠皮下移植瘤模型发现,FK228具有较强的体内抑制HepG2移植瘤生长的作用,且与5-FU联合应用抑制作用明显增加。
目前,HDACi发挥抗肿瘤的确切作用机制尚不明确,研究者普遍认为HDACi通过抑制HDACs的活性,可以引起染色质重塑和基因表达的改变,从而发挥不同的生物学效应,其中的一个重要机制就是引起肿瘤细胞的凋亡[11-12]。研究表明,FK228可以引起多种肿瘤细胞的凋亡,特别是与其他抗肿瘤药物联合用药时[13-15]。Valdez等[15]将FK228与氟达拉滨、氯法拉滨、白消安联合作用于淋巴瘤患者的PEER和SUPT1细胞时,发现与其他任何单药、两药或三药联合相比,增加了FK228的四药联合,可通过引起组蛋白修饰、DNA损伤、降低谷胱甘肽的水平、增加活性氧产物的水平、下调药物的转运蛋白MRP1的表达及抑制多种生存信号途径,从而对恶性T细胞表现出更加明显的促进凋亡和抑制生长作用。本研究分别通过体内、外实验证明了FK228可以引起肝癌细胞HepG2的凋亡,与5-FU联合应用后,对肝癌细胞的体、内外促凋亡作用明显增强,但对促凋亡的机制并未进行深入研究。Sun等[16-20]研究表明,FK228可以通过激活Erk/MAPK途径和JNK/MAPK途径引起肝癌细胞的凋亡,且呈时间和浓度依赖性。越来越多的研究表明,HDACi可以通过降低血管内皮生长因子(VEGF)的表达和提高宿主免疫功能而抑制肿瘤的血管生成,但目前仍不能确定这些生物学效应对HDACi抗肿瘤是否起到关键的作用。本研究也证实了与对照组和5-FU组相比,FK228可以抑制裸鼠皮下HepG2肝癌内的血管生成,但是对FK228是通过何种作用机制引起肿瘤内的血管生成减少并未进行深入研究,也不能确定抑制肿瘤的血管生成是否对FK228抗肿瘤起到关键的作用,因此仍需进一步的探讨。除此之外,FK228还可以通过阻滞细胞周期、诱导细胞分化、促进自体吞噬等,进一步达到抗肿瘤的目的[21]。
总之,FK228与5-FU联用一方面通过不同作用机制药物的联合提高肝癌对5-FU的敏感性,另一方面在保证疗效的前提下,减少5-FU的用量,从而降低其毒副作用。本研究仅初步探讨了FK228和5-FU联合应用对肝癌细胞HepG2的体内、外抑制作用,对两药联合的不同形式、两药联合最适合的剂量比及两药联用的具体作用机制等还有待于进一步研究。
