马铃薯不同基因型试管薯形成能力比较及遗传位点分析
2020-07-17杨艳佩朱才华
杨艳佩,朱才华,柳 俊,周 俊
(1.华中农业大学生命科学技术学院,湖北 武汉 430070;2.园艺植物生物学教育部重点实验室,湖北 武汉 430070;3.农业与农村部马铃薯生物学与生物技术重点实验室,湖北 武汉 430070;4.华中农业大学园艺林学学院,湖北 武汉 430070)
马铃薯(Solanum tuberosum L.)广泛种植于全世界150多个国家和地区,近十年来的世界种植面积维持在1 800万hm2以上[1],总产量仅次于玉米、水稻和小麦,是世界第四大粮食作物。中国马铃薯种植面积自20 世纪90 年代以来一直居于世界第一位,目前的种植面积已经超过570 万hm2,总产接近1 亿t[1],成为农业产业结构调整和重点贫困地区精准扶贫的主要支柱产业之一。然而,因病毒引起的种薯退化而导致减产是马铃薯生产面临的主要问题之一,也是中国马铃薯生产的主要制约因素之一[2,3]。生产脱毒种薯是解决这一问题的主要途径,马铃薯试管薯(Microtubers)在这样的形势下应运而生,并以其特有的优势(易贮易运、生产不受季节限制)成为种薯生产的核心环节[4]。此外,试管薯在组织结构、生长发育、遗传稳定性等方面与常规块茎并没有本质上的差异[5],因此已成为马铃薯遗传转化[6,7]和功能基因研究[8-10]的模式体系。然而,马铃薯不同基因型的试管薯形成能力差异较大,影响了试管薯的应用。
围绕试管薯形成的研究,早期主要集中在环境(光照、温度)、营养、激素等外因对其的影响上。大量研究结果表明,短日照、低温和高蔗糖浓度是诱导试管薯形成的关键因素[11-13],其中高蔗糖浓度是试管薯形成的必须条件,短日照和低温促进试管薯形成,长日照和高温则抑制试管薯的形成。与此同时,不同的基因型对环境等诱导条件的反应差异很大,表明遗传基础这一内因也对试管薯的形成至关重要。早在20世纪80年代末90年代初就有研究报道,马铃薯早熟品种在全黑暗条件、8 h光周期诱导条件以及16 h 光周期非诱导条件下均能形成试管薯,而中晚熟品种只能在全黑暗和短日照的诱导条件下形成试管薯、特晚熟品种仅在全黑暗条件下形成试管薯。即使是处于相同的诱导条件下,早熟品种的试管薯形成能力也强于晚熟品种,或表现在早熟品种结薯更早[14],或表现为早熟品种形成的试管薯更大[15,16]。上述结果说明基因型在试管薯诱导中起着重要的作用,不同基因型的马铃薯在试管块茎形成能力、形成时间以及块茎的数量和重量等方面都有很大差异。
上述研究多是在少数基因型(品种)中探讨遗传基础对试管薯形成的影响,然而,除了明确基因型差异在很大程度上能影响试管薯形成之外,这种影响是否普遍存在、是否有规律可循等都并不清楚。本研究比较了4个杂交组合后代共222个基因型材料在相同诱导条件下的试管薯形成情况,并基于SSR分子标记分析了与结薯时间、结薯率及单薯重等相关的遗传位点,旨在探索基因型影响马铃薯块茎形成的遗传规律及特点,为马铃薯新品种选育奠定基础。
1 材料与方法
1.1 植物材料
本研究所用222个马铃薯基因型材料来源于4个杂交组合391002.14 × 391679.12(D)、393075.54 ×391679.12(E)、393046.7×391679.12(F)和393046.7×391679.7(K),所有组合均于2001 年从国际马铃薯中心(CIP)引进,其系谱号清单见表1。
1.2 试管薯形成表型鉴定
试管苗的扩繁与试管薯的诱导培养方法参考周俊[17]的描述。试管苗扩繁所用培养基为MS[18]基础培养基添加4%蔗糖和8 g/L 的琼脂(不添加任何激素),培养条件:温度(20±1)℃、光照时间16 h/d、光强2 000 lx。试管薯的诱导方法与试管苗的扩繁方法类似,无菌条件下取上述培养4周的试管苗的第2、3、4节单茎段(去除顶芽),接种于试管薯诱导培养基(MS 基础培养基+ 8%蔗糖+ 8 g/L 的琼脂+0.2%活性炭),置于温度(20±1)℃,光照时间8 h/d条件下培养60 d。
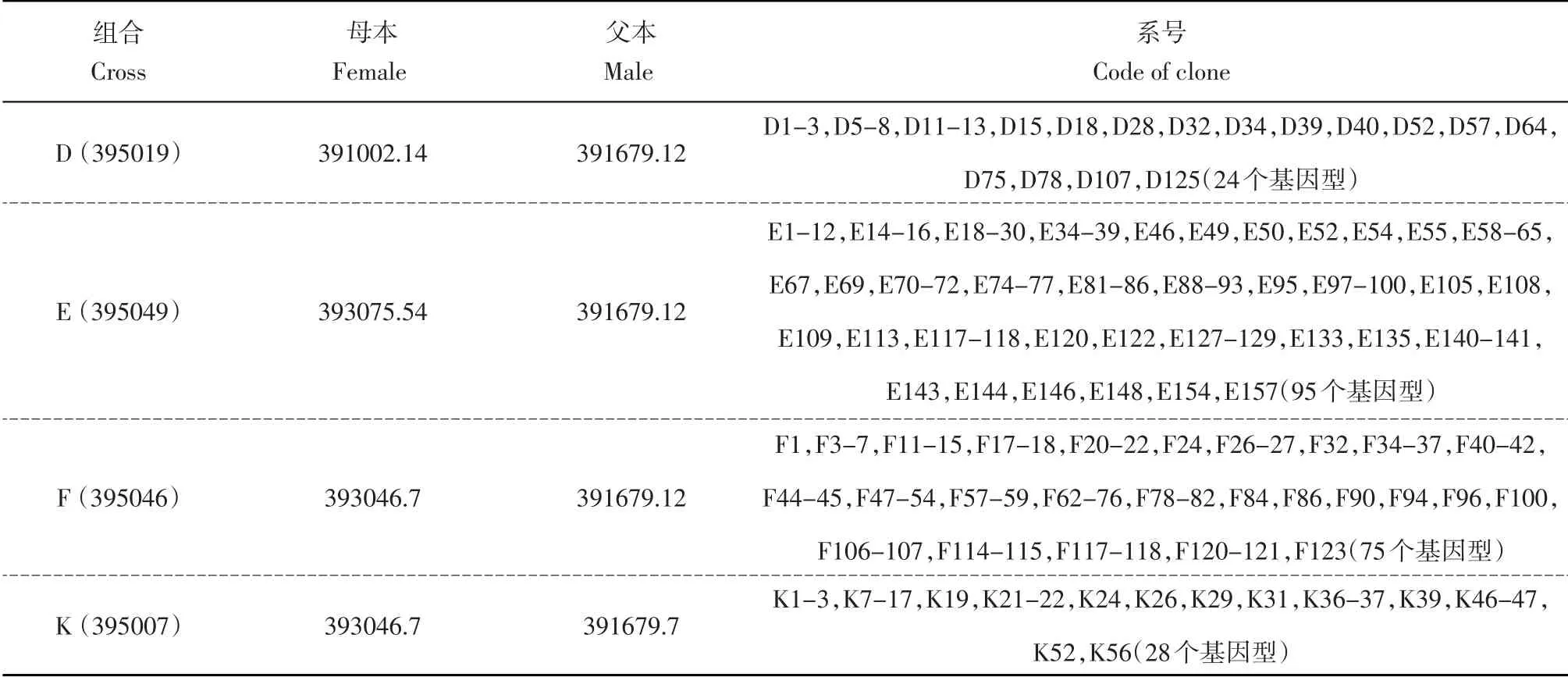
表1 采用的4个杂交组合后代材料系谱号清单Table 1 List of the clones from four crosses
试验设置了3个生物学重复,每个重复有10盒共90个植株,最后统计结果以90株平均值为基数。诱导结薯处理约2周之后每隔3 d观察初始匍匐茎形成时间和初始结薯时间。培养60 d后,取出植株洗净培养基晾干,记录单株结薯率(每盒结薯株数占存活株数比例,反应试管薯形成能力)、单株结薯数(每盒结薯个数与存活株数比值,反应结薯多少的差异)、单薯重(每盒总薯重与结薯数比值,反应试管薯膨大能力)以及有柄薯比例(每盒所结试管薯中有柄薯所占比例,反应试管薯形成方式的差异)。数据分析采用SPSS 25.0统计分析软件。
1.3 SSR分子标记扩增及检测
所有材料的DNA抽提都是基于CTAB抽提法[19],提取培养4 周的试管苗叶片的基因组DNA。研究共计对131 对SSR(Single sequence repeats)引物进行了多态性筛选,引物信息来自于马铃薯基因组数 据 库 (http://solanaceae.plantbiology.msu.edu/pgsc_download.shtml)以及前人的报道[20-23]。引物序列由上海生工生物技术服务有限公司合成。
所有引物的PCR 反应体系及程序设置参考周俊[17]的描述。所用PCR仪器包括DNA Engine Tetrad 2 Peltier Thermal Cycler(MJ Research, Inc.)和TGRADIENT(Biometra),PCR产物的检测采用6%变性(7 mol/L 尿素)PAGE(聚丙烯酰胺凝胶电泳,Polyacrylamide gel electrophoresis,19∶1)分离,在DYCZ-20C型DNA序列分析电泳仪(北京市六一仪器厂)上1 000 V恒压电泳2~3 h,电泳后银染检测[24]。
引物扩增片段的大小以DNA分子量标准ΦX174 HaeⅢdigest(NEB)和DNA ladder 100为标准,利用Quantity One®Version 4.6.2(Universal Hood Ⅱ,BIO-RAD)中的point-to-point semi-log 回归模型进行估计。针对每个等位位点进行标记的读取与记录,将群体中扩增出等位基因条带的个体记为“1”,没有扩增出条带的个体记为“0”,数据缺失记为“9”。标记的命名包含引物名称(STI、STM 或者STG)和位点个数,如STI049-2表示SSR引物STI049扩增得到的第二条等位条带。基于SPSS 25.0统计分析软件中的方差分析(ANOVA)和非参数检验2种方法,比较不同标记基因型数量性状均值的差异,进行标记与表型之间的相关性分析。
2 结果与分析
2.1 不同组合试管薯形成能力比较
2.1.1 4个组合的结薯方式存在差异
从匍匐茎发生率和结薯率来看(图1A),4 个组合之间差异不明显,组合D 和K 的匍匐茎发生率和结薯率均达到了100%;组合F 匍匐茎发生率为100%,结薯率为98.7%(75 个基因型中仅1 个没有形成试管薯);组合E 匍匐茎发生率为98.9%(95 个基因型中仅1 个没有形成匍匐茎),结薯率为95.8% (95 个基因型中有4 个没有形成试管薯)。但是在试管薯形成的过程中,观察到2 种不同的结薯方式(图1B)。一种是遵循常规方式,先经过匍匐茎的发生、伸长,然后匍匐茎顶端膨大形成的试管薯,称为有柄薯,如图1B 中实心箭头所示。另一种是不经过匍匐茎的伸长而直接在植株腋芽部位膨大成薯,称为无柄薯,如图1B 中空心箭头所示。通过对4 个组合有柄薯比例的比较,不难看出4 个组合均存在有柄薯和无柄薯2种结薯方式,但是不同组合中2 种结薯方式所占的比例差异很大。其中组合E 的有柄薯比例最高(87.6%),组合F 和K 次之(分别是74.1%和74.8%),组合D 最低(68.3%),说明结薯方式的差异可能是受到遗传背景的影响。
2.1.2 4个组合试管薯形成相关性状的比较
对4个组合在诱导结薯过程中的匍匐茎发生和试管薯形成的变化趋势进行比较,结果表明4个组合的匍匐茎发生变化趋势比较相似(图2A),形成时间均集中在培养2~5周,其中组合F和D的匍匐茎形成比其他2个组合更早更快,但总体差异不明显。4个组合的平均初始匍匐茎形成时间分别为24.6 d(D)、27.4 d(E)、23.6 d(F)和26.4 d(K),除了F与E之间的差异达到显著水平,其他组合之间的差异均不显著(表2)。
与匍匐茎发生的变化趋势类似,组合F和D的试管薯形成仍然早于其他2个组合且形成时间相对集中(图2B)。培养3周时开始有试管薯形成,第4周时组合F 和D 中结薯基因型比例分别为45%和33%,第6周时分别达到88%和92%。组合E的试管薯形成明显晚于其他组合,培养5周时其结薯基因型比例仅16%,第6 周才达到53%,甚至到第9 周还有个别基因型形成试管薯。组合K在各个时间点的结薯基因型比例均居中。4个组合的平均初始结薯时间分别为32.0 d(D)、41.8 d(E)、31.0 d(F)和37.4 d(K),F 和D 显著早于K,K 显著早于E,F、D与E之间的差异达到显著水平(表2)。
表2还展示了块茎形成相关的其他几个重要性状,结果显示不同组合的单株结薯率、单株结薯数以及单薯重性状均存在明显差异。从单株结薯率来看,组合D(75.5%)显著高于组合E(51.3%)、显著高于组合K(39.5%),组合F(63.0%)介于D和E之间并与二者无显著差异。单株结薯数的比较结果与单株结薯率一致,组合D(0.8)显著高于组合E(0.6)、显著高于组合K(0.4),组合F(0.7)介于D和E之间并与二者无显著差异。在单薯重这一性状上,组合D(86.5 mg)和E(78.3 mg)显著高于组合F(52.0 mg)和K(58.3 mg)。
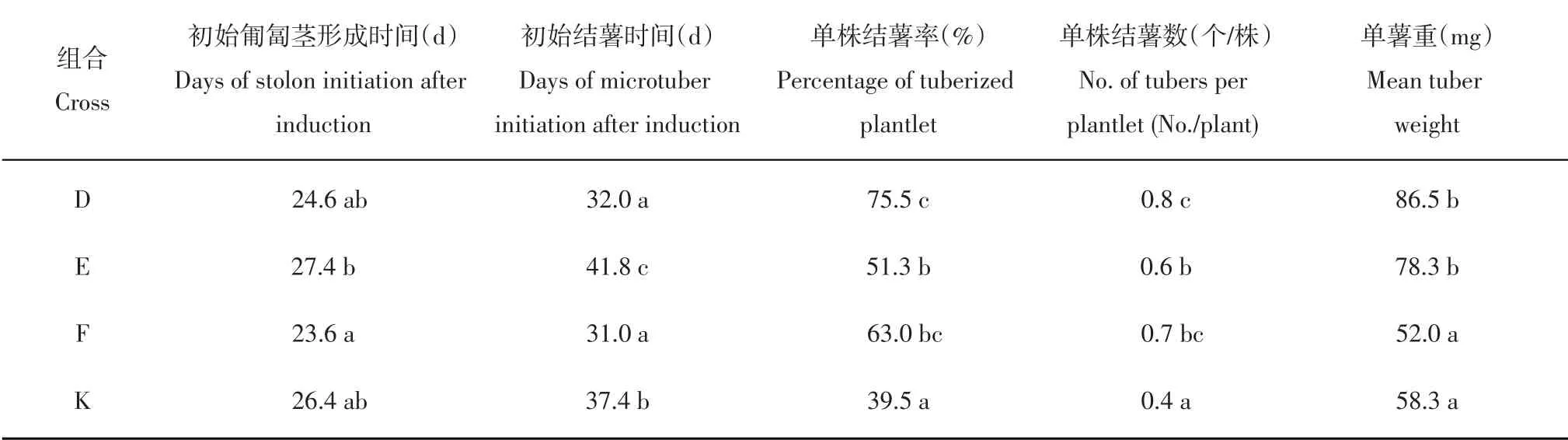
表2 不同组合所有基因型各性状的平均值及比较Table 2 Mean values of each cross for various traits
2.1.3 组合内不同基因型试管薯形成的差异
对4个组合内各个基因型的试管薯形成相关性状进行统计分析和比较,结果显示不同基因型在结薯相关性状上均存在不同程度的差异,其差异程度因组合而异。就匍匐茎和试管薯形成而言,组合E 的95 个基因型中有1 个没有形成匍匐茎、4个没有结薯,组合F 的75 个基因型中有1 个没有结薯,组合D和K全部形成匍匐茎并结薯。从结薯时间来看,组合D较为集中,最早和最晚结薯的基因型分别是24 和48 d 结薯;组合K 次之(25 和60 d);组合E(16 和65 d)和F(17 和67 d)的结薯时间分布则差异较大。从单株结薯率来看,也是组合D较 为 集 中(20.31% ~100%), 组 合E(2.78% ~100%)、F(1.26%~100%)、K(1.9%~94.97%)的分布类似,但是组合E(0.03~1.36 个/株)和F(0.01~1.52个/株)的单株结薯数的分布差异较组合D(0.20~1.10 个/株)和K(0.02~0.95个/株)更大。从单薯重来看,组合E(19.6~199.5 mg)的分布差异最大,其他3个组合D(26.6~139.6 mg)、F(16.5~100.1 mg)、K(23.8~111.7 mg)的分布类似。

表3 四个组合的SSR引物多态性检测结果Table 3 Polymorphism detection of SSR makers in four crosses
2.2 SSR标记与结薯性状的相关分析
选用文献报道的131对SSR引物(分布于马铃薯12条染色体)对4个组合群体进行扩增,结果显示组合D筛选出24对能扩增出多态性目标片段的SSR引物,共产生80个多态性标记;组合E也筛选出24对引物,共产生114个多态性标记;组合F筛选出20对引物,共产生64个多态性标记;组合K筛选出17对引物,共产生55个多态性标记(表3)。最终利用这313个多态性标记对4个组合进行结薯性状与标记的相关分析,结果列于表4。
总体上看,组合D中与结薯时间相关的标记共计36个,分布于9条染色体上(1、2、3、4、6、7、8、11和12);与单株结薯率相关的标记3个,位于第1、3和7号染色体上;与单株结薯数相关的标记2个,位于第1和7号染色体上;与单薯重相关的标记共计28 个,分布于9 条染色体上(1、2、3、4、6、7、8、11和12)。组合E中与结薯时间相关的标记共计13个,分布于7条染色体上(2、4、6、7、8、11和12);与单株结薯率相关的标记4 个,位于第7、10 和11 号染色体上;与单株结薯数相关的标记2个,位于第7和11号染色体上;与单薯重相关的标记共计7个,位于第2、3、7和11号染色体上。组合F中5个标记与结薯时间相关,位于第2、3、8和11号染色体上;4个标记与单株结薯率相关,位于第5、8和11号染色体上;1个标记与单株结薯数相关,位于第11 号染色体上;5 个标记与单薯重相关,位于第5和8号染色体上。组合K中仅1个标记与结薯时间相关,位于第9号染色体上;2个标记同时与单株结薯率、单株结薯数相关,位于第1和2号染色体上;3个标记与单薯重相关,位于第8和11号染色体上。
对各个组合内不同表型间的相关性标记进行比较,可以看出组合D中与初始结薯时间和单薯重这两个表型相关的标记不仅数目多、相关系数高,而且二者之间存在很多共有标记。表4显示组合D中与初始结薯时间相关的标记共计36个,其中21个呈负相关即与结薯时间早相关、15个呈正相关即与结薯时间晚相关;与单薯重相关的标记共计28个,其中14 个呈正相关、14 个呈负相关。二者之间共有标记多达25 个,其中13 个标记同时与早结薯以及单薯重更大相关、12 个标记同时与晚结薯以及单薯重更小相关。此外,与单株结薯率相关的3个标记同时也与结薯时间及单薯重相关。然而,其他3个组合中的结薯时间和单薯重的相关标记之间并不存在交集。
对相同表型在不同组合中的相关标记进行比较,结果显示同一表型在不同组合中的相关标记差异很大,仅有3个标记同时与两个组合的某个表型呈显著相关。其中,标记StI018-1与组合D和F的初始结薯时间均呈极显著相关,标记StI044-2则与二者的单薯重均呈显著相关;标记StI024-1与组合D 和E 的初始结薯时间均呈显著相关,标记STI018-1则与二者的单薯重均呈显著相关。而同一表型在组合E与F,以及组合K与其他组合之间均不存在共有标记。
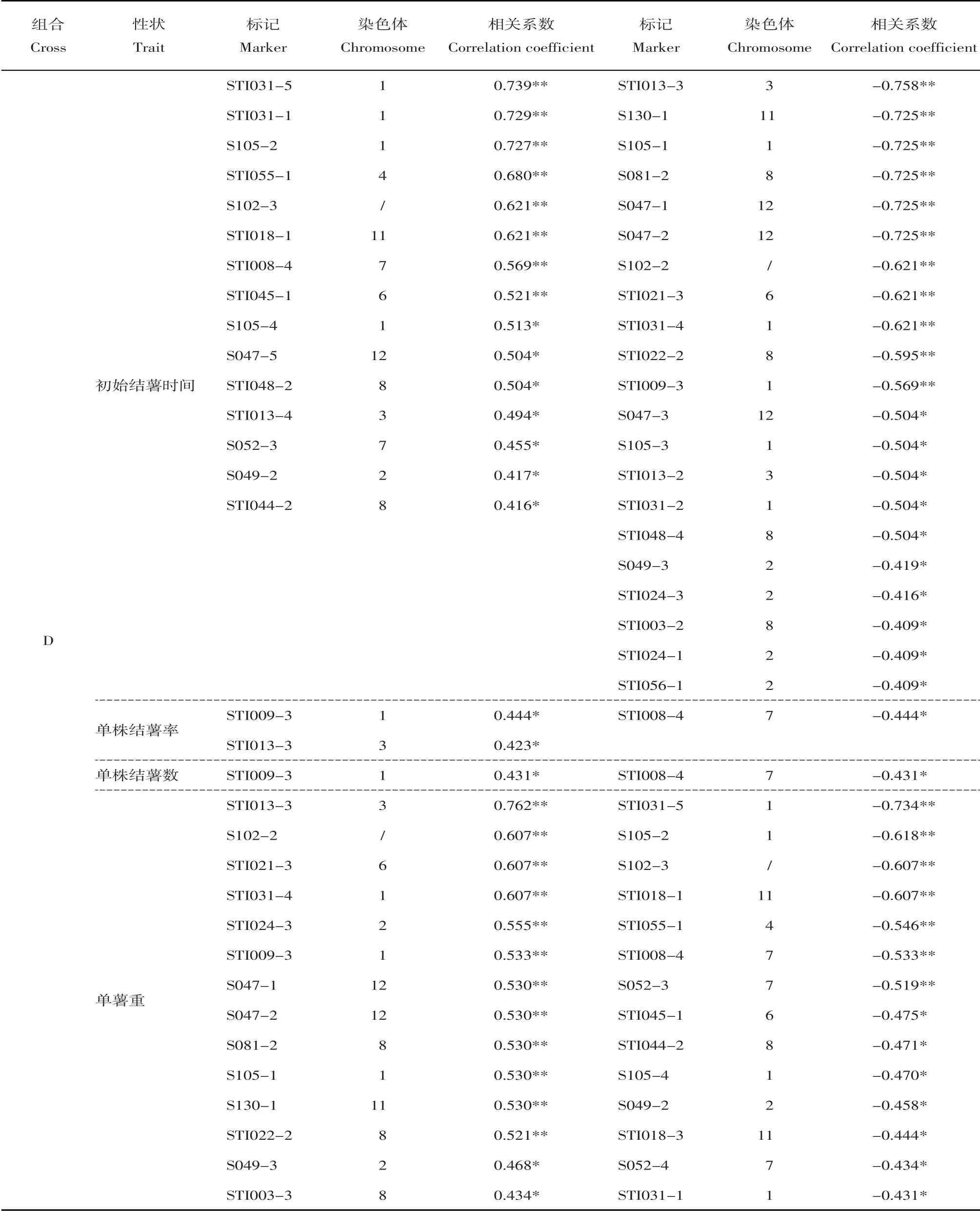
表4 与结薯性状显著相关(P<0.05)的SSR标记Table 4 Significant markers (P<0.05) associated with in vitro tuberization traits

表4 与结薯性状显著相关(P<0.05)的SSR标记Table 4 Significant markers (P<0.05) associated with in vitro tuberization traits
3 讨 论
3.1 遗传基础是影响试管薯形成相关性状的主要因素
试验比较了4个杂交组合后代的试管薯形成相关性状,结果表明不同组合的试管薯形成受亲本遗传基础影响十分明显。4个组合的初始匍匐茎形成时间差异不大;组合F 和D 的初始结薯时间最早,K次之,E最晚;组合D与F、F与E之间的单株结薯率和结薯数无明显差异,但D显著高于E且D、F、E均显著高于组合K;组合D和E的单薯重显著高于F 和K。结合4 个组合的遗传背景(表1),即D、E 和F 具有相同的父本,F 和K 具有相同的母本,推测组合E 结薯较晚可能是受到其母本的遗传,F、D 和E 3 个组合结薯能力较强(单株结薯率和结薯数均较高)可能是受到其共有的父本的遗传,而F和K的试管薯膨大能力较弱,可能是受到其共有的母本的影响。试验结果表明,尽管块茎形成易受环境条件的影响,但从根本上来讲,主要决定因素是其遗传基础[25]。此外,组合内不同基因型之间试管薯形成相关性状的比较结果显示,同一组合的不同基因型间的试管薯形成能力差异极大。组合F 的最早和最晚结薯时间相差达50 d;组合E 中单株结薯率最低为0,而最高达到100%;组合E 的最大单薯重(199.5 mg)是最小单薯重(19.6 mg)的10.2倍。组合内不同基因型之间的差异甚至大大超过了组合间的差异,但是其差异程度还是受其遗传基础影响。
3.2 结薯时间和单薯重的关系受到其遗传背景的影响
试验结果显示,组合D 中检测到25 个标记同时与初始结薯时间及单薯重显著相关,其中13 个标记同时与早结薯以及单薯重更大相关、12 个标记同时与晚结薯以及单薯重更小相关,从遗传学上证明这两个表型在该群体中具有高度相关性。这一结果与前人的研究结果一致,即相较于结薯晚的晚熟品种,结薯更早的早熟品种形成的试管薯更大[15,16],也有研究利用QTL 定位方法证明了平均单薯重与植株熟性之间确实存在相同的遗传调控位点[26]。然而,在研究其他3 个组合中并没有出现同样的结果,组合E、F 和K 均没有检测到同时与结薯时间及单薯重相关的标记。组合F的结薯时间是4个组合中最早的,而其单薯重却显著低于组合D、E;组合E的结薯时间是最晚的,而其单薯重却显著高于结薯比他早的组合F、K,从而表明结薯时间与单薯重也可能分别受到完全不同的遗传位点的调控。这一结果也在近期的报道中得到印证,即不管从表型的相关性(皮尔森相关系数r = 0.1~0.3),还是QTL 定位结果(分别位于不同的染色体上)来看,平均单薯重和植株熟性这两个性状都是相互独立的[27]。基于此不难发现结薯时间与单薯重是否相关很大程度上取决于其遗传基础,这一结论解释了“结薯早不一定产量高,而结薯晚也不一定产量低”的现象,为培育马铃薯新品种奠定了理论基础。
