不同激素及添加物对马铃薯组培苗生长的影响
2019-07-22王艳平吴娥娇林紫薇
王艳平 吴娥娇 林紫薇

摘要:以马铃薯宾杰(Bintje)品种为试验材料,研究在马铃薯基础培养基中添加不同外源激素及添加物对马铃薯组培苗生长的影响。结果表明,最适于组培苗增殖的激素配比为2.00 mg/L 6-BA+0.01 mg/L NAA,最适于其结薯和生根的激素配比为2.00 mg/L 6-BA+1.00 mg/L NAA。在培养基中添加马铃薯比添加香蕉更有利于马铃薯组培苗叶片的生长,最适添加浓度为100 g/L;在培养基中添加香蕉比添加马铃薯更可以促进马铃薯组培苗植株的横向生长,最适添加浓度为50 g/L。
关键词:马铃薯;组织培养;添加物;增殖;结薯;生根
中图分类号:S532.043 文獻标志码: A 文章编号:1002-1302(2019)11-0124-04
马铃薯(Solanum tuberosum L.)是一年生茄科茄属草本植物,起源于南美洲和玻利维亚,明朝万历年间(公元1573—1619年)传入我国[1]。马铃薯作为我国重要的粮、菜、饲兼用作物,营养十分全面,富含蛋白质、维生素及各种微量元素,研究表明,每100 g鲜马铃薯中含有1.5~2.3 g蛋白质、17.5~28.0 g 碳水化合物、0.40~0.94 g脂肪、15~68 mg磷、17.4 mg 锌、11~60 mg钙、0.4~4.8 mg铁、0.03~0.17 mg硫胺素、0.10 mg维生素B1、0.03 mg维生素B2、20~40 mg维生素C,有“地下苹果”之称[2-3]。同时,马铃薯具有耐寒、耐旱、耐贫瘠的种植特点,适应范围广,种植面积和增产空间大,且和小麦、水稻等大宗粮食作物相比水肥等资源利用率更高[4];在我国粮食体系中一直占据着重要位置,是继水稻、小麦、玉米之后的第四大粮食作物[5];对保证我国粮食安全、贫困地区脱贫增收和地区经济振兴崛起有重大意义[6]。同时,马铃薯生长季节短,茬口安排丰富,经济效益高,已成为我国种植业结构调整、农业增效及农民增收的主要经济作物之一[7]。自20世纪90年代中期以来,我国马铃薯种植面积和总产量均位于世界前列。2016年2月,农业部出台《关于推进马铃薯产业开发的指导意见》,把马铃薯作为主粮产品进行产业化开发。同时提出,到2020年,将马铃薯种植面积扩大到1亿亩(1亩=667 m2)以上。
马铃薯生产中多采用块茎进行无性繁殖,由于连年种植导致体内病毒积累、品种种性退化、品质及产量降低[8-9]。马铃薯组织培养技术是运用植物体内病毒分布的不均匀性原理,以病毒含量较少或者无毒的离体茎尖分生组织为材料,在无菌环境下进行组织培养获取脱毒试管苗的一种技术[10]。该技术相比于传统的块茎繁殖,不仅能够有效地去除病毒,保留品种优势,延缓品种退化,而且在一定程度上节省了马铃薯原种生产成本[11-13],为马铃薯工厂化育苗和良种繁殖提供了技术支持[14]。
外源激素作为植物生长调节的重要物质,已经被广泛应用于马铃薯组织培养研究[15-17]。添加物作为一种天然外源能量和激素,在金线莲[18]、铁皮石斛[19-21]、观赏兰花[22-25]、猴头菇[26]等组织培养中已经得到了广泛的研究,并且成功应用于生产中,带来了很大的经济收入,但在马铃薯组织培养研究中的相关报道甚少。本研究通过试验,探讨在培养基中添加生长激素及添加物对马铃薯组培苗增殖、试管薯诱导及壮苗生根的影响,筛选适合其植株生长、生根及结薯的培养基配方组成,为马铃薯规模化生产组培苗和试管薯提供技术支持。
1 材料与方法
1.1 试验材料
马铃薯品种:宾杰(Bintje)。
1.1.1 外植体的获取 将解除休眠后的马铃薯块茎播种于经过干热灭菌的泥炭土中,深度为3 cm左右,浇透水后置于20 ℃左右的温室中生长,定期浇水保湿,待植株长至10 cm左右高度时剪取顶芽,包于纱布内流水冲洗2 h,使用经过消毒的剪刀剪去伤口,在超净工作台中用75%乙醇溶液浸泡 10 s,20%过氧化氢中浸泡15 min(其间振荡3~5次),无菌水冲洗5次,放在无菌滤纸上吸干表面水分,切取约0.50 cm长茎尖接种。
1.2 试验方法
1.2.1 不同激素配比对马铃薯组培苗生长的影响 以MS培养基+30 g/L蔗糖+8 g/L琼脂为基础培养基,分别加入不同浓度的6-BA和NAA共9个处理,编号为L1~L9;以基本培养基为对照,编号为L10(表1)。培养基分装后置于 121 ℃ 高压锅中灭菌20 min备用。每个处理接15瓶,每瓶接种2个茎段,培养室温度为22 ℃,光照时间为12 h/d,光照强度为2 000 lx,30 d后对马铃薯的生长情况进行调查和统计,60 d后统计马铃薯的结薯率。
1.2.2 不同添加物及其含量对马铃薯组培苗生长的影响 以MS培养基+30 g蔗糖+8 g琼脂为基础培养基,添加不同浓度马铃薯,编号分别为W1、W2、W3。添加不同浓度香蕉,编号分别为X1、X2、X3。以基础培养基为对照组,编号为L10(表2)。培养基分装后置于121 ℃高压锅中灭菌20 min备用。每个处理接10瓶,每瓶接种3个茎段,培养室温度为 21 ℃,光照时间为12 h/d,光照度为2 000 lx,30 d后对马铃薯的生长情况进行调查和统计,60 d后统计马铃薯结薯率。
1.2.3 数据分析 试验统计数据使用Excel 2016及SPSS 17.0软件进行分析,用Student-Newman-Keuls(S-N-K)法分析显著性差异。生根率=(生根的苗数/接种的总苗 数)×100%,结薯率=(结薯苗数/接种的总苗数)×100%。
2 结果与分析
2.1 不同激素配比对马铃薯组培苗生长的影响
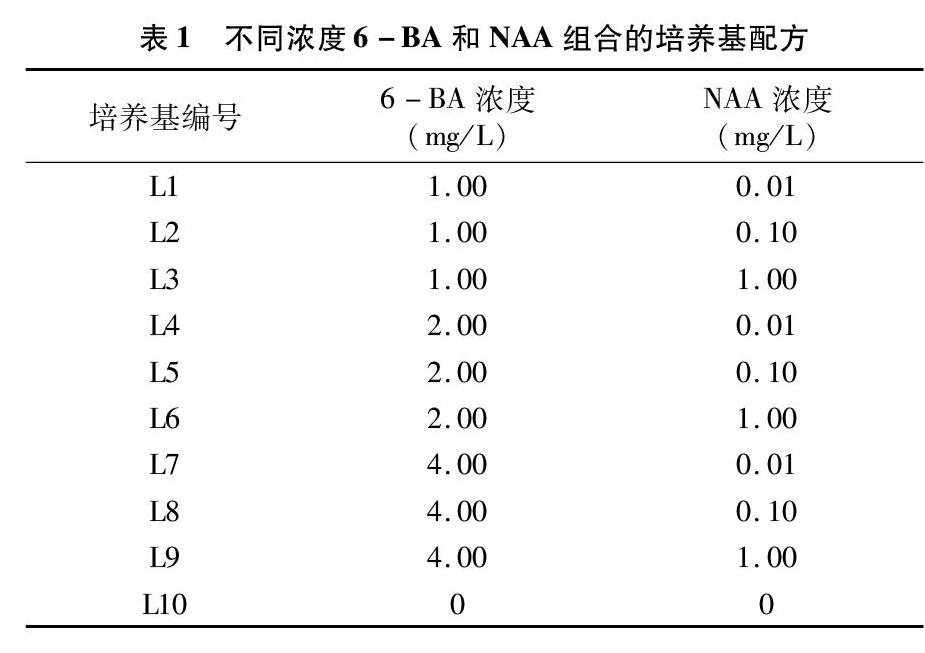
将马铃薯重生芽接种到添加不同浓度6-BA和NAA的培养基中生长30 d后,对马铃薯组培苗的平均株高进行方差分析。由表3可以看出,添加不同浓度6-BA和NAA对马铃薯组培苗株高的影响均达到了极显著水平(P<0.01,下同),且两者的交互作用影响也达极显著水平。由图1可知,随着 6-BA 浓度的增加,马铃薯组培苗的平均株高出现了先升高后下降的趋势,最适添加浓度为2.00 mg/L,平均株高达 6.60 cm,与添加1.00、4.00 mg/L 6-BA之间差异显著(P<0.05)。随着NAA浓度的增加,马铃薯组培苗的平均株高呈逐渐下降趋势,各处理之间差异均达到显著水平,最适添加浓度为0.01 mg/L,平均株高达7.83 cm。
由表4可以看出,培养基中添加6-BA和NAA对马铃薯组培苗叶片与株高的影响一致,添加不同浓度6-BA和NAA对马铃薯组培苗平均叶片数的影响均达到了极显著水平(P<0.01),且两者的交互作用对马铃薯组培苗平均叶片数的影响也极显著。由图1可知,随着6-BA浓度的升高,平均叶片数呈逐渐升高趋势,最适叶片生长浓度为添加 4.00 mg/L 6-BA,平均叶片数达5.94张,是最低6-BA添加浓度平均叶片数的近3倍(添加6-BA 1.00 mg/L 的平均叶片数为2.09张)。此外,在培养基中添加不同浓度的NAA对马铃薯组培苗株高和葉片数的影响一致,均随着NAA浓度的升高呈降低趋势,NAA添加浓度为0.01 mg/L时,平均叶片数最多,达6.90张。
2.2 不同添加物及其含量对马铃薯组培苗株高和叶片的影响
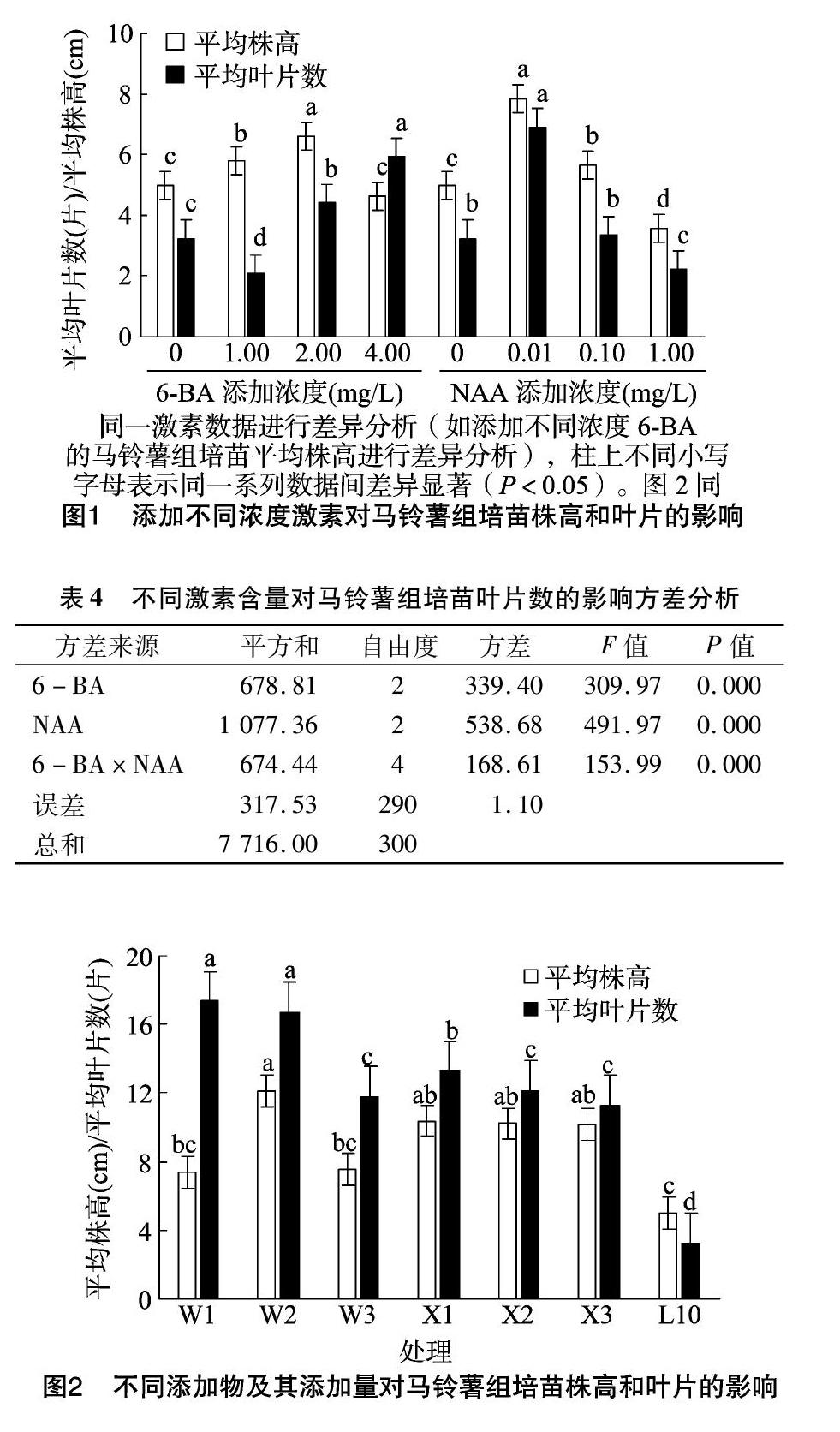
将马铃薯重生芽接种到添加不同浓度6-BA和NAA的培养基中生长30 d后,对马铃薯组培苗的平均株高和平均叶片数进行方差分析。由图2、表5、表6可以看出,在培养基中添加马铃薯和香蕉均有利于马铃薯组培苗的生长,添加马铃薯更有利于叶片的生长,添加香蕉更有利于植株长高。在培养基中添加100 g/L的马铃薯时,马铃薯组培苗的平均株高最高,达12.14 cm,平均叶片数为16.73张,仅次于添加 50 g/L 马铃薯(17.33张),但两者间差异不显著,表明在培养基中添加100 g/L马铃薯时对马铃薯组培苗的增殖最有利。随着培养基中香蕉浓度的升高,马铃薯的平均株高和叶片数均呈下降趋势。培养基中添加不同浓度的香蕉对马铃薯组培苗平均株高的影响差异不显著,而培养基中香蕉添加量为最低浓度(50 g/L)时,平均叶片数与添加浓度为100、150 g/L之间差异均显著;香蕉添加量为100、150 g/L时,平均叶片数差异不显著。
2.3 不同激素含量及添加物含量对马铃薯组培苗结薯和生根的影响
将马铃薯重生芽接种到添加不同浓度6-BA和NAA的培养基中生长60 d后,对马铃薯组培苗的结薯率和生根率进行方差分析。由图3可以看出,与对照组相比,培养基中添加不同浓度的6-BA和NAA均有助于马铃薯组培苗结薯和生根。最适于马铃薯组培苗结薯的6-BA浓度为2.00 mg/L,与最适于马铃薯组培苗长高的浓度一致(图1)。当培养基中添加2.00 mg/L 6-BA时,随着NAA浓度的升高,马铃薯组培苗的结薯率和生根率均逐渐升高。但当提高6-BA浓度,添加量为4.00 mg/L时,随着NAA浓度的升高,马铃薯组培苗的结薯率和生根率均呈下降趋势,这说明两者对马铃薯组培苗的结薯和生根存在一定的交互作用。可以看出,当培养基中添加 2.00 mg/L 6-BA和0.10 mg/L NAA时马铃薯的结薯率和生根率最高,均为96.67%。
将马铃薯重生芽接种到含有不同添加物的培养基中生长60 d后,对马铃薯组培苗的平均株高进行方差分析。由图4可以看出,在培养基中添加不同浓度的马铃薯和香蕉时,马铃薯的生根率均达到了100%,但结薯率水平不一致。在培养基中添加100 g/L的马铃薯时,马铃薯组培苗的结薯率最高,达100%。随着香蕉浓度逐渐升高,马铃薯组培苗的结薯率呈逐渐下降趋势,当添加量达150 g/L时,结薯率为20.00%低于对照组(46.67%),表明高浓度的香蕉添加量对马铃薯的结薯存在抑制作用。
3 结论与讨论
在马铃薯植物组织培养过程中,培养基中添加不同的外
源激素对其生长有着不同程度的影响[27-28],适量的外源激素有利于组培苗的增殖,但浓度过高、过低或使用时间不当会对组培苗产生不利影响[29]。本试验结果表明,最适于马铃薯组培苗长高的6-BA和NAA浓度分别为2.00、0.01 mg/L;最适于马铃薯组培苗叶片生长的6-BA和NAA浓度分别为4.00、0.01 mg/L;最适于结薯和生根的6-BA浓度为 2.00 mg/L,NAA浓度为1.00 mg/L。综合本试验研究发现,最适于宾杰(Bintje)组培苗增殖的激素配比为2.00 mg/L 6-BA+0.01 mg/L NAA,最适于其结薯和生根的激素配比为2.00 mg/L 6-BA+1.00 mg/L NAA。
本试验研究发现,马铃薯组织培养过程中不添加任何外源激素时,植株也能正常生长,这与冉毅东等报道的结果[30]相似。但不添加任何激素的培养基中马铃薯组培苗的生长周期短,与培养基中添加激素的马铃薯组培苗相比,其更早出现叶片黄化和植株衰老现象;此外,培养基中不添加任何激素的马铃薯组培苗所结种薯与在培养基中添加外源激素的组培苗相比所结种薯要小一些,因此,在培养基中添加一定浓度的激素对马铃薯组培苗的生长是有益的,这与任凝辉等在马铃薯茎尖培养及快速繁殖技术的研究中所得结论[31]相似。在基础培养基中添加2.00 mg/L的6-BA时,马铃薯的生根率随着所添加NAA浓度的升高而升高,这说明NAA对马铃薯根的分化有促进作用,这与张玲在马铃薯组织培养技术研究中所得结果[8]一致。
添加物作为一种天然激素和能量供应体,对组培苗的生长起到了很好的促进作用,如在马铃薯试管苗继代增殖培养基中添加25 ml/L的椰子汁,平均增值倍数高达3.07倍[1]。本研究通过在马铃薯基础培养基中添加一定浓度的香蕉和马铃薯试验发现,添加一定浓度的马铃薯有利于马铃薯组培苗叶片的生长,添加一定浓度的香蕉有助于马铃薯组培苗长高。
参考文献:
[1]韦 莹. 马铃薯组织培养及试管薯形成的研究[D]. 南宁:广西大学,2007.
[2]谭兴和,熊兴耀. 我国马铃薯休闲食品的发展现状及前景分析[J]. 现代食品科技,2005,21(3):169-171.
[3]邱敦莲. 国内外马铃薯生产、加工及市场需求现状[J]. 四川农业科技,2004(3):6-7.
[4]陈华宁. 中国马铃薯产业发展现状及对策[J]. 世界农业,2008(8):13-15.
[5]郭燕枝. 我国马铃薯产业发展现状及未来展望[J]. 中国农业科技导报,2017,19(1):29-36.
[6]萌,罗其友,高明杰,等. 马铃薯市场研究进展及展望[J]. 中国马铃薯,2017,31(2):113-118.
[7]谢从华. 马铃薯产业的现状与发展[J]. 华中农业大学学报(社会科学版),2012(1):1-4.
[8]张 玲. 马铃薯组织培养技术研究[J]. 西南科技大学学报,2004,19(1):88-90.
[9]初 麒,辜 松,杨 意,等. 马铃薯组培苗气力引导式移植手设计与试验[J]. 农业工程学报,2017,33(12):40-47.
[10]刘小凤. 马铃薯组织培养脱毒和病毒检测研究[D]. 杨凌:西北农林科技大学,2005.
[11]Espinoza N,Estrada R,Tovar P,et al.马铃薯种质的组织培养、快速繁殖、保存和出口[J]. 中国马铃薯,1988(2):113-116.
[12]萨如拉. 马铃薯品种退化与防治方法[J]. 西藏农业科技,2008,30(3):32-33.
[13]王 勇,胡钧铭. 马铃薯茎尖脱毒与快繁技术应用研究进展[J]. 广东农业科学,2008(8):12-15.
[14]李清萍. 马铃薯组织培养苗的标准化培育[J]. 中国马铃薯,2003,17(4):240-241.
[15]柴 岩. KT与NAA对马铃薯组培苗生长的影响[J]. 河北农业科学,2000,4(2):7-9.
[16]张晓翔. 马铃薯组培脱毒技术[J]. 吉林蔬菜,2006(6):14.
[17]田成津. 马铃薯茎尖脱毒及组培快繁技術研究[J]. 农业科技与信息,2012(16):21-23.
[18]金德博. 不同培养基组分对金线莲组培苗生长及生根的影响[J]. 现代农业科技,2015(24):89-90.
[19]刘 清,包英华,毛怡霏,等. 细叶石斛离体快速繁殖研究[J]. 韶关学院学报,2017(3):77-81.
[20]陈东波,贾 黄. 铁皮石斛组培苗复壮培养基的研究[J]. 内江师范学院学报,2014,29(6):52-54.
[21]孙同高,林晓萍. 铁皮石斛种子组织培养研究[J]. 林业与环境科学,2016,32(6):40-43.
[22]陈林丛. 一种蝴蝶兰培养基:CN101857496B[P]. 2014-04-16.
[23]陈 尔,杨舒婷. 不同培养基组分对带叶兜兰离体培养效果的影响[J]. 南方农业学报,2016,47(10):1730-1736.
[24]汪 旭. 碧玉兰无菌播种快繁技术研究[J]. 文山学院学报,2017,30(3):12-14.
[25]王 飞. 不同日本春石斛兰品种组培繁殖系数的差异[J]. 西北农林科技大学学报(自然科学版),2008,36(9):118-122.
[26]李荣轩. 一种猴头菇培养基及其制备方法:CN106278485A[P]. 2017-01-04.
[27]王 芳,黄 坚,严成其,等. 花旗马铃薯品种茎尖脱毒与快繁技术[J]. 浙江农业科学,2017,58(9):1577-1578.
[28]凌永胜. 马铃薯脱毒试管苗组织培养技术概述[J]. 农业科技通讯,2017(8):238-241.
[29]鄢 铮,郭德章. 马铃薯试管苗组织培养及微型薯诱导技术的研究[J]. 中国马铃薯,2004,18(5):270-271.
[30]王 蒂. 用组培法诱导试管微型薯的研究[J]. 中国马铃薯,1991(4):193-198.
[31]王美平,史宣杰. 马铃薯茎尖组织培养及快速繁殖技术研究[J]. 河南农业大学学报,2002,36(3):280-283.
