热加工条件对牛血清白蛋白-葡萄糖糖基化体系抗氧化活性的影响
2020-07-13涂宗财
李 军,涂宗财,2,*,张 露,罗 娟
(1.江西师范大学 国家淡水鱼加工技术研发专业中心,江西省淡水鱼高值化利用工程技术研究中心,江西 南昌 330022;2. 南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
糖基化反应又称为美拉德反应,主要是指氨基化合物(蛋白质、氨基酸)与羰基化合物(还原糖、醛)之间发生的非酶褐变反应[1-2]。在食品加工过程中,糖基化反应会产生还原酮、杂环化合物和类黑精等一系列具有一定抗氧化活性的糖基化产物[3-5],从而提高食品的抗氧化能力。Chen Kun等[6]以木糖和牛酪蛋白水解产物为原料制备美拉德反应产物,在一定的反应时间内,其抗氧化活性随着反应时间的延长而增大;Yan Fang等[7]优化制备壳寡糖-甘氨酸体系的美拉德反应产物,经研究发现其处理的果汁比壳寡糖和甘氨酸混合处理的果汁具有更高的抗氧化能力;Chen Kangni等[8]利用鱼鳞明胶水解物和3 种糖类进行反应,发现核糖-鱼鳞明胶水解物复合物体系具有最高的抗氧化能力,可用作功能性食品配料中的抗氧化剂;Yilmaz等[9]通过测定组氨酸和葡萄糖体系中抗氧化性的研究发现,美拉德反应产物的抗氧化性随着时间的延长呈先增加后降低的趋势。目前的研究大多是评价蛋白质糖基化产物的抗氧化活性,对于通过控制反应条件来调控其抗氧化活性的研究较少。
在高蛋白、高糖类食品的加工过程中,一般使用的原料都含有丰富的蛋白质(如面包、肉质食品等),为了提高产品的品质或延长商品的货架期,通常会加入一定量的合成抗氧化剂(如丁基羟基茴香醚、二丁基羟基甲苯[10]),虽然它们能有效地清除自由基、减缓氧化反应,防止食品酸败,但其安全系数较低,对人体可能存在致癌的风险[11-12]。糖基化产物是食品热加工自身产生的一类物质,可被视为天然物质,研究也证实某些糖基化产物具有较强的抗氧化活性,其活性甚至可以和合成抗氧化剂相媲美[13-15]。所以,越来越多的学者认为通过控制热处理工艺使食品产生具有抗氧化性的产物,可作为提高食品安全性的一种潜在方法。本课题组前期研究发现牛血清白蛋白(bovine serum albumin,BSA)-葡萄糖体系在不同温度、时间热处理下可发生糖基化反应,产生果糖胺、羰基化合物、5-羟甲基糠醛和丙烯酰胺等糖基化产物[16],但是不同热处理条件对体系糖基化产物抗氧化活性尚不清晰。因此,本实验以BSA-葡萄糖体系为糖基化反应模型,通过1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力、2,2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2’-azinobis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基清除能力和还原能力实验评价反应时间和温度的变化对糖基化产物抗氧化能力的影响,从而为制备高抗氧化性蛋白质糖基化产物提供理论依据。
1 材料与方法
1.1 材料与试剂
BSA、葡萄糖、DPPH(均为分析纯) 美国Sigma公司;ABTS(分析纯) 北京索莱宝科技有限公司;考马斯亮蓝G-250、邻苯二甲醛(o-phthalaldehyde,OPA)、铁氰化钾(均为分析纯) 上海阿拉丁生化科技股份有限公司;其他所需试剂均为国产分析纯。
1.2 仪器与设备
FA1104N型电子分析天平 上海丙林电子科技有限公司;DHG-9023A型电热恒温鼓风干燥箱 上海精宏实验设备有限公司;LGJ-1D-80型冷冻干燥机 北京亚泰科隆仪器技术有限公司;Synergy H1型酶标仪 美国Bio Tek公司。
1.3 方法
1.3.1 样品的制备
参照Liu Yan等[17]的干热法制备BSA-葡萄糖体系糖基化样品。将BSA溶于20 mmol/L、pH 7.4的磷酸盐缓冲液(phosphate buffered saline,PBS)配成25 mg/mL的溶液,按照葡萄糖与蛋白质量比为1∶1的比例向BSA溶液中加入葡萄糖,混匀,冷冻干燥。将冻干的粉末置于恒温烘箱中进行糖基化反应,反应条件为55 ℃分别反应6、12、24、36、48、72 h,或分别于50、60、70、80、90、100 ℃下反应12 h。烘箱内放置饱和KI溶液以维持相对湿度为65%。待糖基化反应结束后,将样品置于冰水浴中终止反应,并置于4 ℃冰箱中保存待测。
1.3.2 可溶性蛋白质量浓度的测定
采用考马斯亮蓝法测定样品中的可溶性蛋白质量浓度[18]。取50 μL稀释到适宜质量浓度的样品溶液与200 μL 0.1 mg/mL考马斯亮蓝G-250溶液于96 孔酶标板中混匀,50 μL的蒸馏水代替样品溶液作为空白对照,室温混合静置1 min后于595 nm波长处测定OD值。以不同质量浓度(20~200 μg/mL)的BSA标准溶液作标准曲线,根据标准曲线计算样品溶液中的可溶性蛋白质量浓度。实验重复3 次。
1.3.3 自由氨基质量浓度的测定
采用OPA法测定样品中的自由氨基质量浓度[19]。称取80 mg OPA溶解于2 mL甲醇中,分别加入5 mL 20 g/100 mL的十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液、50 mL 0.1 mol/L硼砂溶液和200 μL β-巯基乙醇,蒸馏水定容至100 mL配成OPA溶液。取200 μL稀释到适宜质量浓度的样品溶液加入到4 mL OPA溶液中混匀,以200 μL蒸馏水代替样品作为空白对照,避光反应2 min后于340 nm波长处测定吸光度。以不同质量浓度(0.05~1.00 mg/mL)的赖氨酸标准溶液作标准曲线,利用标准曲线计算样品中自由氨基的质量浓度。实验重复3 次。
1.3.4 DPPH自由基清除能力的测定
采用DPPH自由基清除能力实验比较样品之间的自由基清除能力[7]。分别取100 μL 10 mg/mL样品溶液与100 μL 0.15 mmol/L DPPH自由基溶液(甲醇配制)于96 孔酶标板上混匀,室温下避光反应30 min后于517 nm波长处测定吸光度(Ai)。以100 μL甲醇代替样品的反应体系为控制组(Ac),以100 μL PBS(0.2 mol/L、pH 7.4)代替DPPH自由基溶液的反应体系为样品空白组(Aj),分别以100 μL甲醇和PBS代替样品和DPPH自由基溶液的反应体系为空白组(Ab)。采用两倍稀释法进行实验,以槲皮素为阳性对照,结果用抑制率表示。实验重复3 次,采用Origin 8.6软件中的多项拟合计算样品清除自由基的半抑制浓度(half maximal inhibitory concentration,IC50)/(mg/mL)。DPPH自由基清除能力按下式计算。
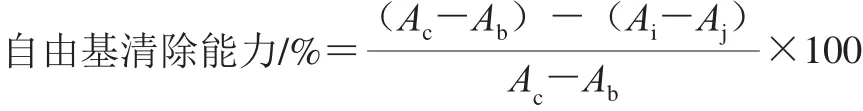
1.3.5 ABTS阳离子自由基清除能力的测定
采用ABTS阳离子自由基清除能力实验来评价样品中的总抗氧化能力[20]。称取38.4 mg ABTS和6.623 mg过硫酸钾混合,蒸馏水溶解后并定容至10 mL配成ABTS母液。室温避光反应12~16 h后用PBS稀释ABTS母液至734 nm波长处吸光度为0.70±0.02左右。分别移取50 μL 5 mg/mL样品溶液与150 μL ABTS溶液于96 孔酶标板上混匀,室温下避光反应6 min后于734 nm波长处测定吸光度(Ai)。以50 μL甲醇代替样品的反应体系为控制组(Ac),以150 μL PBS代替ABTS溶液的反应体系为样品空白组(Aj),以50 μL甲醇和150 μL PBS分别代替样品和ABTS溶液的反应体系为空白组(Ab)。采用两倍稀释法进行实验,以槲皮素为阳性对照,结果用抑制率表示。实验重复3 次,采用Origin 8.6软件中的多项拟合计算样品的IC50/(mg/mL)。ABTS阳离子自由基清除能力按1.3.4节公式计算。
1.3.6 还原能力的测定
参照Khadidja等[21]的方法评价样品的还原能力。分别移取0.2 mL不同质量浓度的样品溶液(1、2、4、6、8、10 mg/mL)与0.3 mL质量分数1%铁氰化钾混合,50 ℃水浴20 min后,加入0.3 mL质量分数10%三氯乙酸终止反应。分别加入0.6 mL的蒸馏水和0.15 mL质量分数0.1%三氯化铁,摇匀后取200 μL溶液于700 nm波长处测定吸光度。0.15 mL的蒸馏水代替三氯化铁作为空白对照。以槲皮素为阳性对照,ρ(OD0.5)表示使反应体系的光密度值为0.5时所需要的样品质量浓度。实验重复3 次。
1.4 数据处理与分析
2 结果与分析
2.1 可溶性蛋白质量浓度分析结果
BSA-葡萄糖糖基化体系中的可溶性蛋白质量浓度变化如表1所示,在不同反应条件下,样品之间的可溶性蛋白质量浓度具有相似的变化趋势,均随着反应时间延长和温度递增而降低,这说明BSA和葡萄糖之间发生了共价结合而消耗了BSA,从而促进糖基化反应进程。固定反应温度为55 ℃,在反应时间超过36 h时,其可溶性蛋白质量浓度从1.025 mg/mL降低到72 h的0.894 mg/mL;固定反应时间为12 h,在反应温度高于80 ℃时,其可溶性蛋白质量浓度从1.156 mg/mL显著降低到90 ℃的0.177 mg/mL,且在100 ℃没有检测出。与反应时间相比,反应温度的升高使可溶性蛋白质量浓度降低得更加明显,这可能是因为高温处理促进糖基化反应进程,BSA结构被破坏,更容易和葡萄糖发生共价结合,使得样品中可溶性蛋白质量浓度显著降低[22]。Guan Yongguang等[23]研究甘氨酸-葡萄糖体系时发现,随着反应程度的加深,其甘氨酸含量下降得越快。
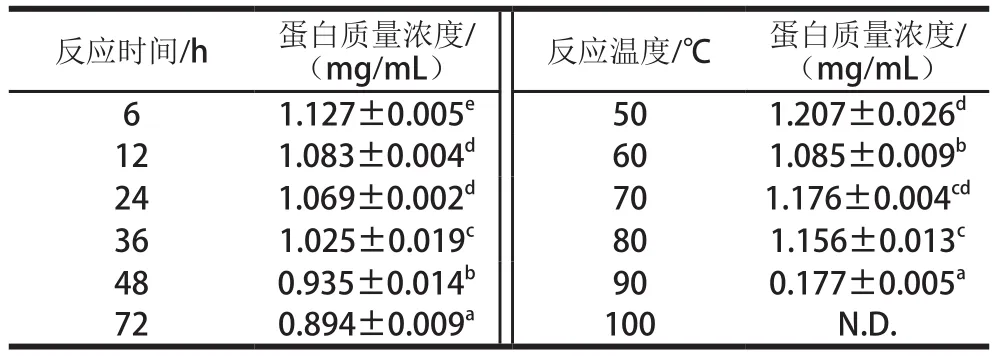
表1 反应时间和反应温度对BSA-葡萄糖糖基化体系中可溶性蛋白质量浓度的影响Table 1 Effect of reaction time and temperature on soluble protein content in BSA-glucose glycosylation system
2.2 自由氨基质量浓度分析结果
糖基化反应是指还原糖的羰基与蛋白质的氨基之间发生共价结合的化学反应,可以通过测定反应体系中的自由氨基质量浓度来反映糖基化反应进程[24]。从图1可以看出,样品经糖基化反应后其自由氨基质量浓度显著低于对照组BSA(P<0.05),且其自由氨基质量浓度约比对照组BSA低0.11~0.21 mg/mL,说明BSA和葡萄糖之间发生反应消耗了BSA上的自由氨基。可能的原因是BSA上的氨基酸残基易发生氧化,其氨基基团的丢失导致自由氨基质量浓度下降,这和Meltretter等[25]报道基本一致。但当反应时间超过6 h时,样品的自由氨基质量浓度变化较小,而当反应温度高于60 ℃时,样品的自由氨基质量浓度几乎不再发生改变,这可能是因为当糖基化反应达到一定程度时,BSA-葡萄糖反应体系中的葡萄糖已被消耗,继续延长反应时间或者升高反应温度无法再提高反应程度,已经不能明显改变自由氨基质量浓度[19]。
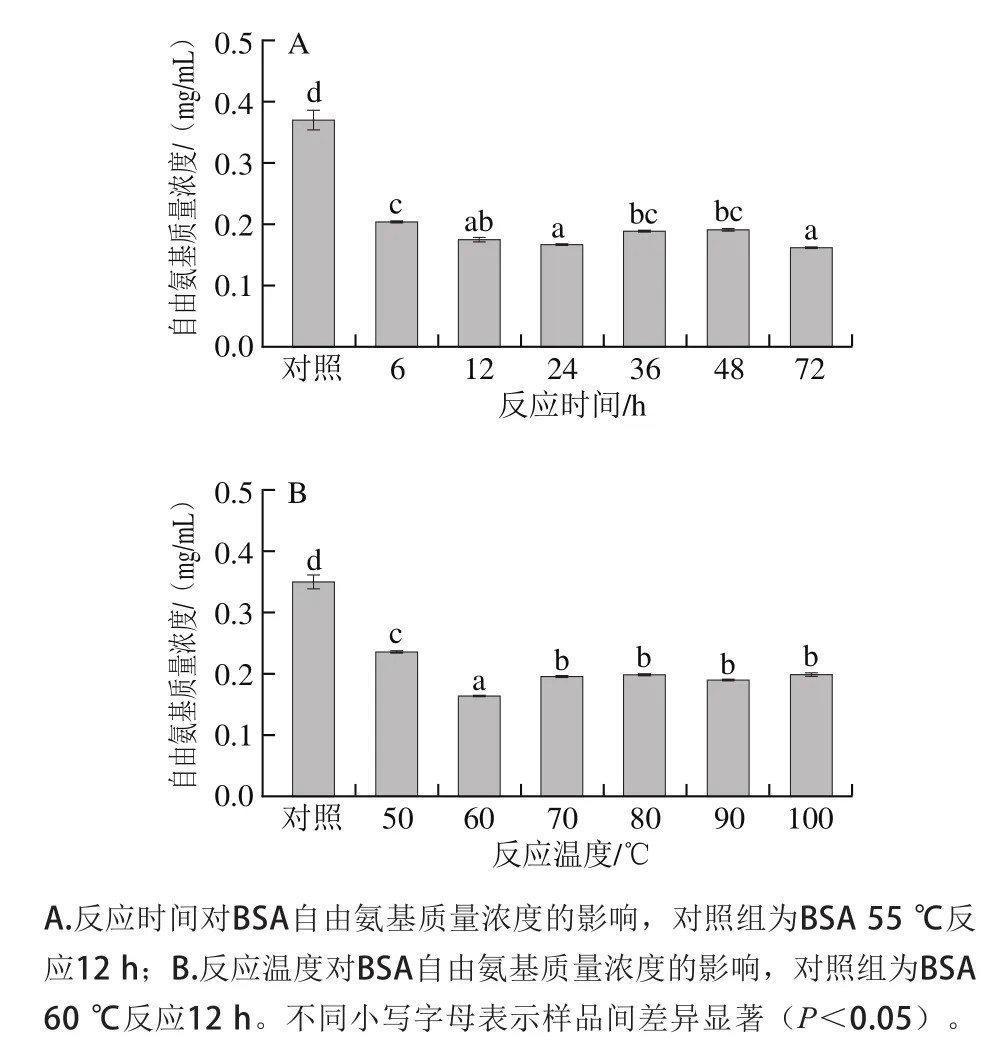
图1 反应时间和反应温度对BSA自由氨基质量浓度的影响Fig. 1 Effect of reaction time and temperature on the content of free amino groups in BSA
2.3 DPPH自由基清除能力分析结果
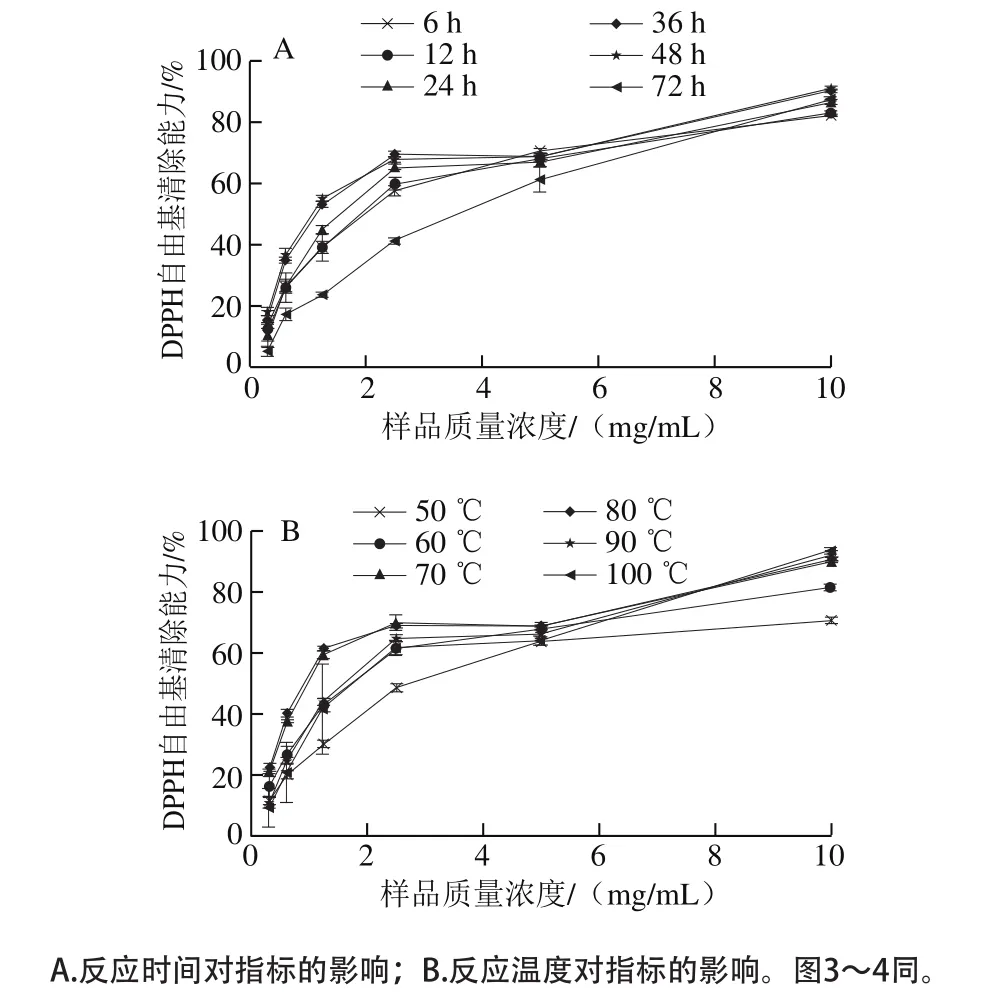
图2 BSA-葡萄糖糖基化体系的DPPH自由基清除能力Fig. 2 DPPH radical scavenging capacity of BSA-glucose glycosylation system
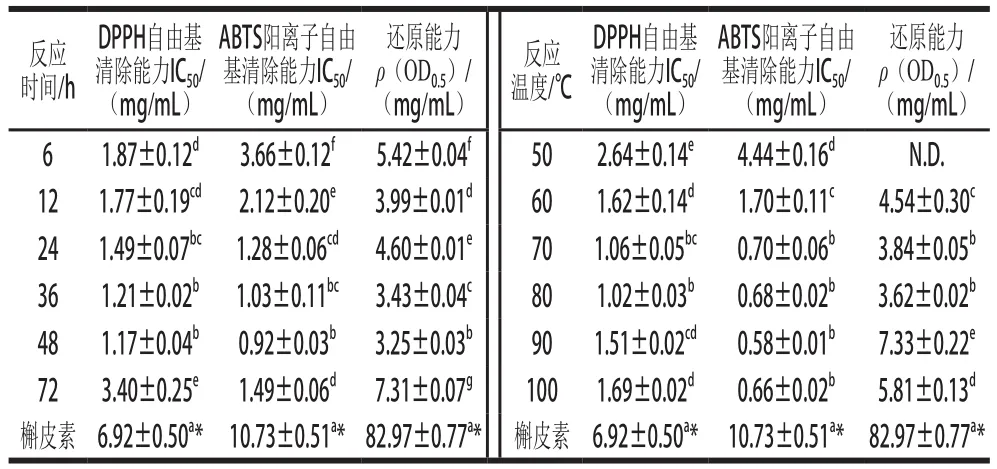
表2 BSA-葡萄糖糖基化体系中DPPH自由基清除能力、ABTS阳离子自由基清除能力的IC50和还原能力的ρ(OD0.5)Table 2 IC50value for DPPH and ABTS cation radical scavenging capacity and ρ(OD0.5) for reduction power of BSA-glucose glycosylation system
本实验采用DPPH自由基清除能力实验比较不同反应条件下BSA-葡萄糖糖基化体系的抗氧化能力。样品的DPPH自由基清除能力如图2所示,其IC50如表2所示。在样品的测试质量浓度范围内(0.31~10.00 mg/mL),所有样品的DPPH自由基清除能力均低于阳性对照槲皮素,但具有一定的DPPH自由基清除能力,且DPPH自由基清除能力随着样品质量浓度的递增而增加。固定温度为55 ℃,在反应48 h时制备的样品具有最强的DPPH自由基清除能力,其IC50仅为1.17 mg/mL,其次为36 h时制备的样品,反应72 h样品的DPPH自由基清除能力最低,其IC50约为48 h时的2.9 倍;固定时间为12 h,在80 ℃条件下制备的样品具有最强的DPPH自由基清除能力,其IC50仅为1.02 mg/mL,其次为70 ℃条件下制备的样品,反应温度为50 ℃时制备的样品DPPH自由基清除能力最低,其IC50约为80 ℃时的2.6 倍。BSA-葡萄糖糖基化体系的抗氧化能力增加的原因是样品经糖基化处理后,产生的糖基化产物(如类黑精[26])具有供氢能力,与DPPH自由基结合形成DPPH-H分子,使得DPPH自由基清除能力提高[27],同时Dong Shiyuan等[28]证实了葡萄糖的焦糖化作用会使DPPH自由基清除能力增加。持续延长反应时间或升高反应温度,其DPPH自由基清除能力反而下降,这可能是因为随着糖基化反应程度的加剧,糖基化产物的结构变得紧密,使一些与DPPH自由基反应的基团被包埋,导致其DPPH自由基清除能力降低[29]。因此,在固定温度为55 ℃,反应48 h,或者固定反应时间为12 h,80 ℃条件下制备的糖基化产物具有最强的DPPH自由基清除能力。
2.4 ABTS阳离子自由基清除能力分析结果

图3 BSA-葡萄糖糖基化体系的ABTS阳离子自由基清除能力Fig. 3 Effect of reaction time and temperature on ABTS cation radical scavenging capacity of BSA-glucose glycosylation system
BSA-葡萄糖糖基化体系中的ABTS阳离子自由基清除能力如图3所示,其IC50如表2所示。样品清除ABTS阳离子自由基能力的变化趋势与DPPH自由基的变化趋势相似,这可能是因为ABTS阳离子自由基清除能力和DPPH自由基清除能力都反映了样品供氢的能力[30]。固定温度为55 ℃,在反应48 h时制备的样品具有最强的ABTS阳离子自由基清除能力,其IC50仅为0.92 mg/mL,其次为36 h时制备的样品,而样品在6 h时的ABTS阳离子自由基清除能力最低,其IC50约为48 h时的4.0 倍;固定时间为12 h,在90 ℃条件下制备的样品具有最强的ABTS阳离子自由基清除能力,其IC50为0.58 mg/mL,但与80 ℃样品的ABTS阳离子自由基清除能力无显著性差异(P>0.05),样品在50 ℃时的ABTS阳离子自由基清除能力最低。在反应过程中,BSA-葡萄糖糖基化体系中的ABTS阳离子自由基清除能力先随着反应程度的增加而增大,这是因为生成的部分中间产物和类黑精具有一定的抗氧化活性[31-32],作为供氢体,使得糖基化改性后BSA的自由基清除能力提高;但在固定温度为55 ℃、反应72 h,或者固定时间为12 h,100 ℃条件下制备样品的ABTS阳离子自由基清除能力有所降低,这可能是因为随着糖基化反应程度的持续增加,一些具有供氢能力的中间产物逐渐转化形成结构复杂、聚合度不等的类黑精[31],类黑精积累形成大量的黑色物质并难以溶解,使糖基化产物中主要的抗氧化活性成分含量降低,导致其ABTS阳离子自由基清除能力降低。综合前期实验[16]考虑,为了降低糖基化后期有害产物的积累,故选择在固定温度为55 ℃、反应48 h或者固定反应时间为12 h、80 ℃条件下制备糖基化产物,该条件下制得的糖基化产物具有较高的ABTS阳离子自由基清除能力。
2.5 还原能力分析结果
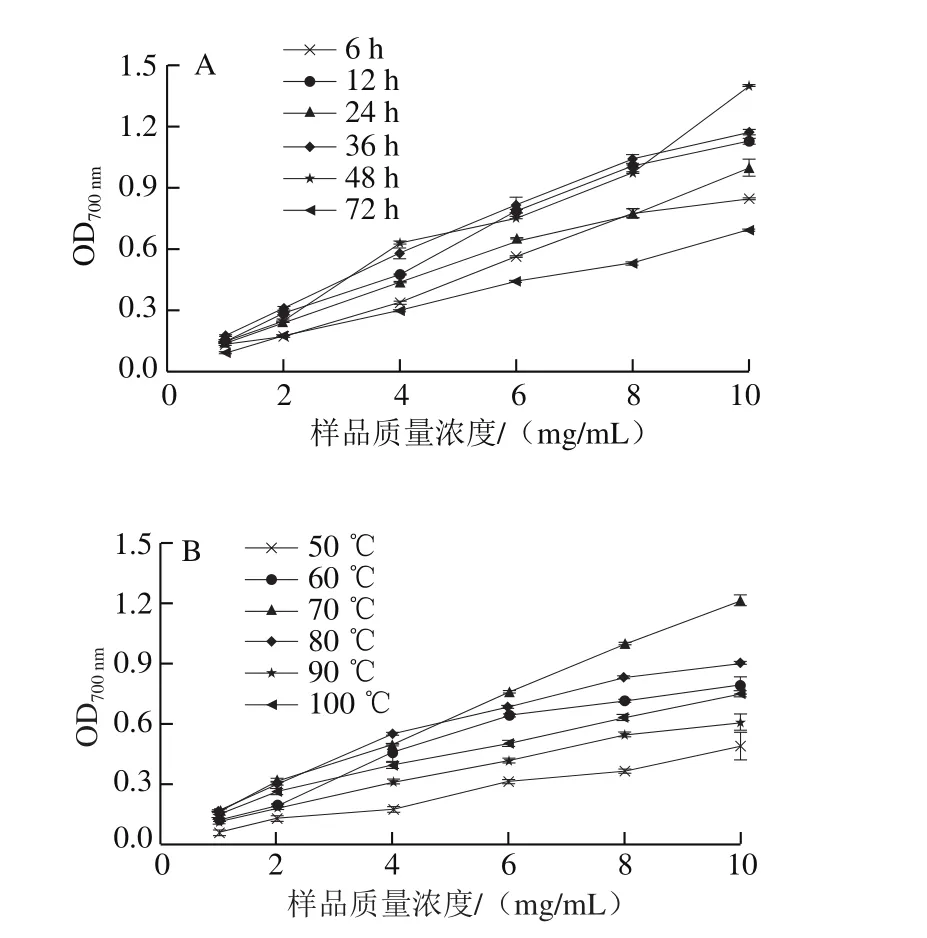
图4 BSA-葡萄糖糖基化体系的还原能力Fig. 4 Effect of reaction time and temperature on reducing power of BSA-glucose glycosylation system
还原能力测定是指样品溶液中的还原剂将铁氰化钾(三价铁)还原成亚铁氰化钾(二价铁),进一步与三氯化铁反应生成普鲁士蓝,此时的样品溶液在700 nm波长处具有最大光密度值,光密度值越大则代表样品的还原能力越强[33]。BSA-葡萄糖体系中糖基化产物的还原能力结果如图4所示,其ρ(OD0.5)如表2所示。随着糖基化反应程度的增加,样品的还原能力呈现出先增大后下降的趋势(P<0.05)。在固定温度55 ℃,反应时间为48 h时制备的样品具有最高的还原能力,其ρ(OD0.5)为3.25 mg/mL,其次是反应36 h制备的样品,而样品在72 h的还原能力最弱;在固定反应时间为12 h时,糖基化温度为80 ℃时制备的样品具有最高的还原能力,其ρ(OD0.5)仅为3.62 mg/mL,其次是70 ℃制备的样品,而糖基化温度为50 ℃时制备样品的还原能力最弱。这是因为美拉德反应中间产物的酮基、高级产物的吡咯和羟基基团都具有一定的还原能力,所以样品的还原能力与美拉德反应程度相关[28,34-35]。在糖基化反应过程中,其中间产物是发挥还原能力的主要活性物质,是良好的电子供体[36],其供应的电子使Fe3+还原成Fe2+,导致样品的还原能力增加。Yoshimura等[37]曾报道,随着葡萄糖-甘氨酸混合物反应时间的延长,葡萄糖和甘氨酸提供了强还原材料,还原能力呈线性增加。而样品还原能力下降的原因可能是随着糖基化反应程度的增加,过度的热处理或者高温条件下使得部分具有还原能力的中间产物被分解所致。
3 结 论
本实验以BSA-葡萄糖体系为糖基化反应模型,通过测定糖基化体系中的可溶性蛋白质量浓度、自由氨基质量浓度以及糖基化产物的DPPH自由基清除能力、ABTS阳离子自由基清除能力和还原能力,研究糖基化条件变化对糖基化反应程度以及糖基化产物的抗氧化能力的影响。结果表明,延长反应时间和升高反应温度可促进糖基化反应的进程,使得BSA-葡萄糖体系中的可溶性蛋白和自由氨基质量浓度显著下降。体外抗氧化实验结果表明,样品的DPPH自由基清除能力、ABTS阳离子自由基清除能力和还原能力随着糖基化反应程度的增加呈现出先增大后降低的趋势。结合前期不同反应条件对糖基化产物影响的研究,发现在55 ℃反应48 h或者80 ℃条件下反应12 h时制备的样品具有较强的抗氧化能力。综上,本研究为定向调控生产具备抗氧化能力的蛋白类食品,提高其品质、安全性,扩展食物资源提供了理论指导。
