罗格列酮减轻细菌脂多糖诱发急性肝损伤及其机制研究
2020-07-13黄家惠王俊先徐德祥
黄家惠,王俊先,何 薇,徐德祥
外源化合物的暴露常会导致肝细胞死亡和肝脏功能障碍[1]。细菌脂多糖(lipopolysaccharide, LPS)急性暴露诱导的炎症性肝损伤(acute liver injury,ALI)小鼠模型,能够很好地模拟人类肝炎病毒入侵的病理生理过程[2]。ALI的发病机制非常复杂,目前并未完全阐明,大量研究[3]表明炎症和氧化应激参与了肝脏的病理性损伤过程。
过氧化物酶体增殖物激活受体γ (peroxisome proliferator-activated receptor gamma, PPARγ)是一类核受体,是配体依赖性的核转录因子[4]。罗格列酮(rosiglitazone, RSG)是噻唑烷二酮类胰岛素增敏剂,是临床常用的2型糖尿病患者降糖药物。研究[5]发现,补充RSG可以激活小鼠肝脏PPARγ核受体,通过抗感染和抗氧化作用拮抗对乙酰氨基酚(acetaminophen, APAP)引起的药物性肝损伤,然而补充RSG是否可以减轻LPS暴露引起的ALI目前还不清楚。因此该研究旨在探讨补充RSG对LPS暴露诱发小鼠ALI的保护作用,并从抗感染和抗氧化作用部分探讨其机制。
1 材料与方法
1.1 材料
1.1.1实验动物 42只SPF级CD-1系成年雄鼠,购于北京维通利华实验动物技术有限公司,8周龄,体质量28~30 g,实验动物许可证号:SCXK(京)2016-0006。实验前适应性喂养1周,自由饮食饮水,昼夜均衡。
1.1.2药物与试剂 RSG购于成都恒瑞制药有限公司(国药准字H20030569);LPS购于美国Sigma公司(货号067M4035V);谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)试剂盒购于南京建成生物工程研究所;肿瘤坏死因子-α(tumor necrosis factor alaph, TNF-α) (货号:CSB-E04741m)、巨噬细胞炎性蛋白-2 (macrophage inflammatory protein-2,MIP2) ELISA试剂盒(货号:CSB-E04666m)购于武汉华美生物有限公司;p-c-fos (货号:D82C12)、p-c-jun(货号:D47G9)、NADPH氧化酶(NADPH-oxidase, NOX)-4(货号:D21F6)、血红素加氧酶 (haem oxygenase,HO) -1(货号:E9H3A)和HO-2(货号:D9J9U)一抗均购于美国Cell Signaling Technology公司;NOX-2(货号:ab80508)和β-actin(货号:ab179467)一抗购于美国Abcam公司。
1.1.3仪器 Senergy2多功能酶标仪(美国BioTek公司);Fine Do X6全自动化学发光分析系统(上海天能科技有限公司),Universal32R低温高速离心机(德国Hettich科学仪器公司);UV-1200型紫外可见分光光度计(上海翱艺有限公司);CM1950组织冰冻切片机(德国莱卡公司);XMTD-8222恒温水浴锅(上海精宏实验设备有限公司);光学显微镜和DP71成像系统(日本Olympus公司)。
1.2 动物模型的制备实验动物随机均分为6组:对照组(Control组)、保护剂组(RSG组)、LPS暴露6 h组(LPS 6 h组)、LPS暴露12 h组(LPS 12 h组)、RSG加LPS暴露6 h组(RSG+LPS 6 h组)和RSG加LPS暴露12 h组(RSG+LPS 12 h组)。除Control组和LPS组外,所有小鼠在LPS暴露前连续5 d给予RSG (10 mg/kg)灌胃处理,LPS组和RSG+LPS组小鼠给予LPS(2 mg/kg)单次腹腔注射构建ALI小鼠模型,其余组给予等体积的生理盐水,分别在LPS注射后6、12 h剖杀小鼠,留取小鼠血清和肝脏组织。
1.3 ALT、AST水平测定通过赖氏比色法测定小鼠血清ALT、AST水平,具体操作步骤严格按照试剂盒说明书进行。
1.4 HE染色观察肝脏组织病理学改变取实验动物部分肝脏组织,置于4%多聚甲醛溶液中,固定24 h后经梯度乙醇脱水、二甲苯透明、石蜡包埋、切片、HE染色、中性树胶封片,置于光学显微镜下观察小鼠肝脏病理学改变并摄片,统计小鼠肝脏炎性细胞的数量。
1.5 ELISA检测室温平衡试剂盒,根据标准品浓度建立标准曲线。用样品稀释液稀释待测样品,在酶标板中加入标准品和待测样品,并留取空白孔,加入一抗工作液50 μl,封口膜盖住,37 ℃水浴锅中孵育3.5 h,加入300 μl洗涤液,重复洗板5次。加入酶标抗体工作液,继续37 ℃水浴锅孵育2 h。重复洗板5次,加入底物工作液100 μl反应30 min。然后加入反应终止液,振荡混匀,在450 nm波长处用酶标仪检测吸光度值,5 min内完成检测,并根据标准曲线计算TNF-α和MIP-2的浓度。
1.6 肝脏总蛋白的提取与Western blot称取40 mg肝脏组织到洁净玻璃匀浆器中,加入0.5 ml含1% PMSF的RIPA裂解液,冰上匀浆45次,匀浆完成后倒入1.5 ml EP管中,冰上静置10 min,4 ℃离心机中9 160 r/min 离心15 min,吸取250 μl上清液,用BCA法检测肝脏蛋白浓度,加入上样缓冲液将所有样品蛋白定至同一浓度,煮沸变性,分装保存。固定玻璃卡槽,灌入所需浓度分离胶和浓缩胶,加入相同体积的蛋白样品,开始电泳,然后转膜,转膜结束,按照所需蛋白分子量大小剪去多余的膜,牛奶封闭,加入β-actin (1 ∶10 000)、p-c-fos (1 ∶2 000)、p-c-jun (1 ∶2 000)、NOX-4 (1 ∶2 000)、NOX-2 (1 ∶2 000)、HO-1 (1 ∶2 000)和HO-2 (1 ∶2 000)一抗,孵育结束继续孵育不同二抗 (1 ∶80 000,羊抗兔和羊抗鼠),加入ECL发光液分别检测上述蛋白水平。
1.7 统计学处理实验数据使用SPSS 17.0统计软件分析,所有定量数据符合正太分布的都以表示,每组实验的样本量都标注在图注中,两组数据之间的差异性用t检验分析。P<0.05为差异有统计学意义。
2 结果
2.1 RSG减轻LPS诱发小鼠ALILPS暴露6 h和12 h后,小鼠肝脏重量无明显变化,小鼠肝脏出现炎性细胞浸润,肝脏炎性细胞渗出增多(图1);LPS注射后12 h,小鼠血清ALT和AST水平升高(P<0.01,t=3.819;P<0.01,t=5.474)(图2)。而RSG预处理可减轻LPS暴露诱发的小鼠ALI,RSG+LPS组小鼠肝脏炎性细胞渗出数量减少(图1);此外,RSG+LPS组小鼠血清中ALT和AST水平降低(P<0.01,t=2.770;P<0.01,t=4.046)(图2)。
2.2 RSG降低LPS暴露诱发小鼠血清炎症因子的升高LPS注射后6 h上调小鼠血清中促炎细胞因子TNF-α和趋化因子MIP-2的水平(P<0.01,t=-102.087;P<0.01,t=-31.593)(图3);而RSG预处理可降低LPS暴露诱发小鼠血清中TNF-α和MIP-2的升高(P<0.01,t=-6.818;P<0.01,t=-30.345)(图3)。
2.3 RSG抑制LPS暴露激活小鼠肝脏AP-1信号LPS注射后6 h和12 h增加了小鼠肝脏c-fos蛋白磷酸化水平(P<0.01,t=-19.878;P<0.01,t=-4.872)(图4A、B),RSG预处理抑制了LPS所致的c-fos蛋白磷酸化水平 (P<0.01,t=-15.456;P<0.05,t=2.387)(图4A、B)。同时也检测了小鼠肝脏c-jun的蛋白磷酸化水平,显示LPS暴露后6 h和12 h,C-Jun的蛋白磷酸化水平增强(P<0.01,t=-14.972;P<0.01,t=-18.687)(图4A、C),RSG预处理对LPS注射6 h后诱导的c-jun的蛋白磷酸化水平无明显影响,但在12 h后c-jun的蛋白磷酸化水平被抑制(P>0.05,t=0.516;P<0.05,t=2.565)(图4A、C)。
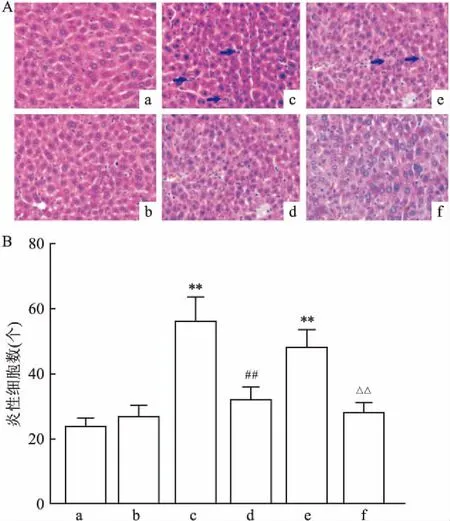
图1 小鼠肝脏组织病理变化和炎性细胞数 HE×400
A:小鼠肝脏HE染色;B:小鼠肝脏炎性细胞数;a:Control组;b:RSG组;c:LPS 6 h组;d:RSG+LPS 6 h组;e:LPS 12 h组;f:RSG+LPS 12 h组;与Control组比较:**P<0.01;与LPS 6 h组比较:##P<0.01;与LPS 12 h组比较:△△P<0.01

图2 小鼠血清ALT和AST的水平
A:小鼠血清ALT水平;B:小鼠血清AST水平;a:Control组;b:RSG组;c:LPS 6 h组;d:RSG+LPS 6 h组;与Control组比较:**P<0.01;与LPS 6 h组比较:##P<0.01

图3 小鼠血清TNF-α和MIP-2的水平
A:小鼠血清TNF-α水平;B:小鼠血清MIP-2水平;a:Control组;b:RSG组;c:LPS 6 h组;d:RSG+LPS 6 h组;与Control组比较:**P<0.01;与LPS 6 h组比较:##P<0.01
2.4 RSG抑制LPS暴露上调小鼠肝脏NOXNOX的2个亚型,NOX-4和NOX-2蛋白表达在LPS注射后6 h无明显改变,在12 h后分别升高了4.52倍(P<0.01,t=-29.299)(图5A、B)和2.04倍(P<0.01,t=-12.26)(图5A、C);RSG预处理降低了LPS所致小鼠肝脏NOX-4蛋白表达升高(P<0.01,t=-12.046)(图5A、B),然而RSG预处理对LPS诱导的肝脏NOX-2蛋白表达升高无明显影响(P>0.05,t=-0.128)(图5A、C)。
2.5 RSG抑制LPS暴露上调小鼠肝脏抗氧化酶HO-1小鼠腹腔注射LPS 6 h和12 h后,小鼠肝脏抗氧化酶HO-1蛋白表达升高(P<0.01,t=-6.563;P<0.01,t=-7.985)(图6A、B),RSG预处理可以减轻LPS暴露引起的HO-1蛋白表达的升高(P<0.01,t=-14.972;P<0.05,t=3.143)(图6A、B)。此外,检测小鼠肝脏HO-2蛋白表达显示,LPS暴露对小鼠肝脏HO-2蛋白表达无影响(图6A、C)。

图4 小鼠肝脏中c-fos和c-jun蛋白磷酸化水平
A:小鼠肝脏p-c-fos和p-c-jun;B:小鼠肝脏p-c-fos灰度分析;C:小鼠肝脏p-c-jun灰度分析;a:Control组;b:RSG组;c:LPS 6 h组;d:RSG+LPS 6 h组;e:LPS 12 h组;f:RSG+LPS 12 h组;与Control组比较:**P<0.01;与LPS 6 h组比较:##P<0.01;与LPS 12 h组比较:△P<0.05
3 讨论
LPS暴露诱导的小鼠炎症性肝损伤模型旨在复制病毒性肝炎诱导的人类暴发性肝衰竭[6]。课题组采用腹腔注射LPS模拟ALI的病理过程,观察了灌胃补充RSG对LPS诱发ALI的干预作用。显示RSG预处理可减轻LPS暴露诱发小鼠肝脏炎性细胞渗出,降低LPS暴露引起的小鼠血清ALT和AST水平的升高。以上实验结果表明RSG预处理可以减轻LPS暴露引起的小鼠ALI,然而具体的保护机制仍未清楚。
一项早期的研究[7]表明,炎症信号参与了四氯化碳诱发的ALI,肝脏炎症因子和趋化因子在ALI组中分泌明显增加,炎性因子的释放损伤了肝细胞膜和线粒体细胞膜,致使细胞通透型增加,导致了小鼠血液中ALT和AST的升高。AP-1信号通路是一种重要的转录因子,调节一系列的细胞进程,包括细胞增殖、存活和分化。AP-1是由Jun、Fos、Maf和ATF二聚体蛋白组成,c-jun和c-fos是2种最重要的AP-1转录因子组成原件。在炎症情况下,AP-1信号被激活并发生核转位以后,可以启动下游的促炎细胞介质和细胞因子[8],AP-1信号的激活参与了ALI的炎症性病理进程[9]。本研究表明RSG预处理可以抑制LPS所致小鼠血清炎性因子和趋化因子的分泌以及小鼠肝脏c-jun和c-fos的磷酸化。以上实验结果提示RSG预处理可能部分通过抑制AP-1信号降低炎症水平,减轻LPS暴露引起的小鼠ALI。

图5 小鼠肝脏中NOX-4和NOX-2蛋白表达水平
A:小鼠肝脏NOX-4和NOX-2蛋白表达;B:小鼠肝脏NOX-4灰度分析;C:小鼠肝脏NOX-2灰度分析;a:Control组;b:RSG组;c:LPS 6 h组;d:RSG+LPS 6 h组;e:LPS 12 h组;f:RSG+LPS 12 h组;与Control组比较:**P<0.01;与LPS 12 h组比较:△△P<0.01

图6 小鼠肝脏中HO-1和HO-2蛋白表达水平
A:肝脏HO-1和HO-2蛋白表达;B:肝脏HO-1蛋白表达灰度分析;C:肝脏HO-2蛋白表达灰度分析;a:Control组;b:RSG组;c:LPS 6 h组;d:RSG+LPS 6 h组;e:LPS 12 h组;f:RSG+LPS 12 h组;与Control组比较:**P<0.01;与LPS 6 h组比较:##P<0.01;与LPS 12 h组比较:△P<0.05
大量的研究[10]表明氧化应激在LPS所致的小鼠ALI中发挥着重要的作用,LPS暴露以后产生的过量活性氧(reactive oxygen species, ROS)会损伤肝细胞,导致ALT和AST的升高。而越来越多的证据[11]表明,NOXs是促进产生超氧化物的呼吸链酶,NOXs可以促进ROS的产生。本课题组前期研究[5]已发现,RSG具有抗氧化作用,可以拮抗APAP暴露引起的药物性肝损伤并抑制NOXs表达的上调。而本研究也显示,LPS暴露以后,肝脏中NADPH氧化酶的2个主要亚型,NOX-2和NOX-4蛋白表达在LPS注射后12 h明显增强。然而,RSG预处理可抑制LPS所致肝脏NOX-4表达的上调。以上研究结果提示,RSG预处理可能是通过抑制肝脏NOX-4的表达减轻LPS所致的ALI。
HO是催化血红素生成CO、亚铁离子和胆红素的一种限速酶, 主要包括HO-1、HO-2和 HO-3。HO-1信号通路的激活通过加速分解代谢促氧化剂血红素和氧自由基的分解代谢,保护机体免受氧化应激损伤,是体内最易被诱导产生的抗氧化酶。HO-1正常生理情况下表达较低,但是受到损伤或刺激时,如缺氧应激、氧化应激、炎症反应、内毒素和重金属等,HO-1的表达会升高[12]。有研究[13-14]支持HO-1可以抑制肝脏组织丙二醛的形成,降低脂质过氧化,增加肝脏超氧化物歧化酶的生成,减轻氧化应激损伤。有研究[5]表明,肝脏HO-1在APAP诱导的药物性肝损伤中被诱导并高表达。同时本课题也显示LPS暴露以后,小鼠肝脏中HO-1蛋白表达明显升高,RSG预处理可抑制LPS暴露引起的小鼠肝脏HO-1表达的升高。以上结果提示,RSG预处理可能是通过调节肝脏抗氧化酶HO-1减轻LPS所致小鼠ALI。
综上所述,本课题研究了RSG预处理对LPS所致ALI过程中炎症反应和氧化应激的影响。研究结果显示,RSG预处理可能部分通过抑制AP-1信号降低LPS所致促炎因子和趋化因子的分泌;RSG预处理可能部分通过调节NOX-4和抗氧化酶HO-1减轻LPS所致ALI。因此,RSG有可能被用于预防和治疗LPS所致ALI。
