基于硫化铋低温碱性熔炼的熔体物化性质分析
2020-07-10牟文宁辛海霞雷雪飞翟玉春
牟文宁,辛海霞,雷雪飞,翟玉春
(1. 东北大学秦皇岛分校资源与材料学院,秦皇岛市资源清洁转化与高效利用重点实验室,河北 秦皇岛 066004;2. 东北大学冶金学院,辽宁 沈阳 110819)
铋是重要的稀有重金属,具有熔点低、冷胀热缩、比重大、无毒性等特性,成为医药、冶金、化工、电子等领域[1-4]不可或缺的原料。全球铋金属储量约为37万t[5],主要以辉铋矿(Bi2S3)、泡铋矿(Bi2O3)、菱铋矿(nBi2O3·mCO2·H2O)、铜铋矿(3Cu2S·4Bi2S3)、方铅铋矿(2PbS·Bi2S)的矿物形式存在。中国铋储量居世界第一,约为24万t,占世界总储量的75%,铋产量占全球的89%。随着资源的多年开采和铋需求的不断增加,铋矿严重短缺,矿石品位急剧下降。传统的火法冶炼存在能耗大、生产成本高、环境污染严重的缺点[6-7],湿法工艺存在流程冗长、工序繁杂、废水排放量大等问题[8-9]。低温、清洁、高效的处理方法——低温碱性熔炼崭露头角,备受冶金行业的关注。
低温碱性熔炼是以碱性熔体为介质,在低于传统火法冶炼温度(不超过900℃)下熔炼金属资源,得到金属单质或可溶性碱式金属盐的过程[10]。低温碱性熔炼为复杂多相反应过程,熔炼温度较低,不产生熔融渣,熔炼过程形成的液态相包括熔盐与液态金属两相,既具有湿法冶金的特性,又具有火法冶金特点。该方法最早由前苏联学者谢里科会姆(З.А.Сериковым)于1948年提出,而后由斯米尔洛夫(СмиpHов M.∏.)完成研究[11]。我国冶金学者对该技术进行了推广,用于从复杂资源中提取SiO2[12-16],铝灰、废弃电路板等含金属氧化物或单质的二次资源的回收利用[17-19],及处理铋精矿、锑精矿、铅精矿等原生硫化矿或多金属复杂矿物[20-22]。
低温碱性熔炼技术虽在有色金属复杂资源处理方面取得了良好的效果,但作为一个全新的领域,其基础理论研究仍是空白。整个提炼过程中存在大量的液-固、液-液分离,有效分离是整个过程顺利进行的保证,而熔体的物性(熔融温度、高温密度、粘度、表面张力等)是决定各相分离的关键因素。
本研究基于重金属硫化物的低温碱性还原熔炼技术的原理,开展以NaOH为熔炼介质的硫化铋碱性熔体的物化性质研究,测定不同碱性成分下体系的熔化温度、粘度、表面张力、密度,以期为重金属矿的低温碱性熔炼新方法的建立提供基础数据参考。
1 试 验
1.1 试验原料及仪器
试验所需原料为氢氧化钠和硫化铋,均为化学纯。试验所用仪器为RDS-05型全自动炉渣熔点熔速测定仪和ND-II型炉渣粘度测试仪。
1.2 试验方法
1.2.1 完全熔化温度的测定
采用半球点法测定样品的熔化温度,所用仪器为全自动炉渣熔点熔速测定仪[23]。将样品压制成高约3 mm、直径约2 mm的圆柱体,放入加热炉内加热。随着炉膛温度的升高,样品高度降低。样品高度下降至原高度1/5时的温度记录为完全熔化温度。
1.2.2 高温密度的测定
采用阿基米德法测定样品的高温密度[24],所用仪器为ND-II型炉渣粘度测试仪。在一定的炉温下,将特定形状的钼锤通过钼丝悬挂浸入被测熔体,记录浸入前后的质量m1和m2,通过式(1)计算熔体的高温密度。

其中,V锤采用纯水标定,根据钼锤浸入水前后的质量m1和m锤,利用式(2)计算。

1.2.3 表面张力的测定
采取拉筒法[25]测量样品的表面张力,所用设备为ND-II型炉渣粘度测试仪。在一定炉温下,将钼丝悬挂的钼制圆筒垂直浸入被测熔体中,向上提拉圆筒,当筒下表面与液面恰好接触时,在液体表面张力的作用下圆筒受到向下的拉力达最大,得到钼筒拉起液体的最大质量mmax,再根据液体质量与表面张力的关系式(5)即可获得被测熔体的表面张力。

式中g-重力加速度;r-钼筒的半径;C-设备矫正系数。
采用已知表面张力的液体(纯水)作为标准物质,通过测试处于水表面上的钼筒被拉离水表面时的最大拉力m水,根据式(4)即可得出校正系数C。
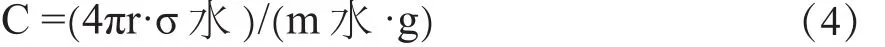
1.2.4 粘度的测定
采用旋转柱体法(吊丝法)测定样品的粘度,所用仪器为ND-II型炉渣粘度测试仪。原理是浸在流体中的刚性物体旋转时,会受到流体的粘性力矩的作用,粘性力矩的大小与流体的粘度成正比:

式中:η为粘度,Pa·S;Δθ为扭角变化量;k为仪器常数,采用蓖麻油为标准液进行标定。蓖麻油粘度与温度的关系式为:

根据式(6)计算某一温度T下蓖麻油的粘度,再利用式(5),通过测量某一深度下蓖麻油的Δθ标定出仪器常数k。根据测量的高温熔体扭角变化量即可求得该高温熔体的粘度。
2 结果与讨论
2.1 低温碱性还原熔炼原理
低温碱性还原熔炼是在较低的温度下,采用氢氧化钠或碳酸钠为熔炼介质,金属元素被S2-还原成液态纯金属或合金,同时捕集贵金属,硫以Na2S、Na2SO4形态得以固定,消除低浓度SO2排放的过程。本研究采用氢氧化钠为熔炼介质,硫化铋的低温碱性熔炼物料的XRD分析见图1(a)。
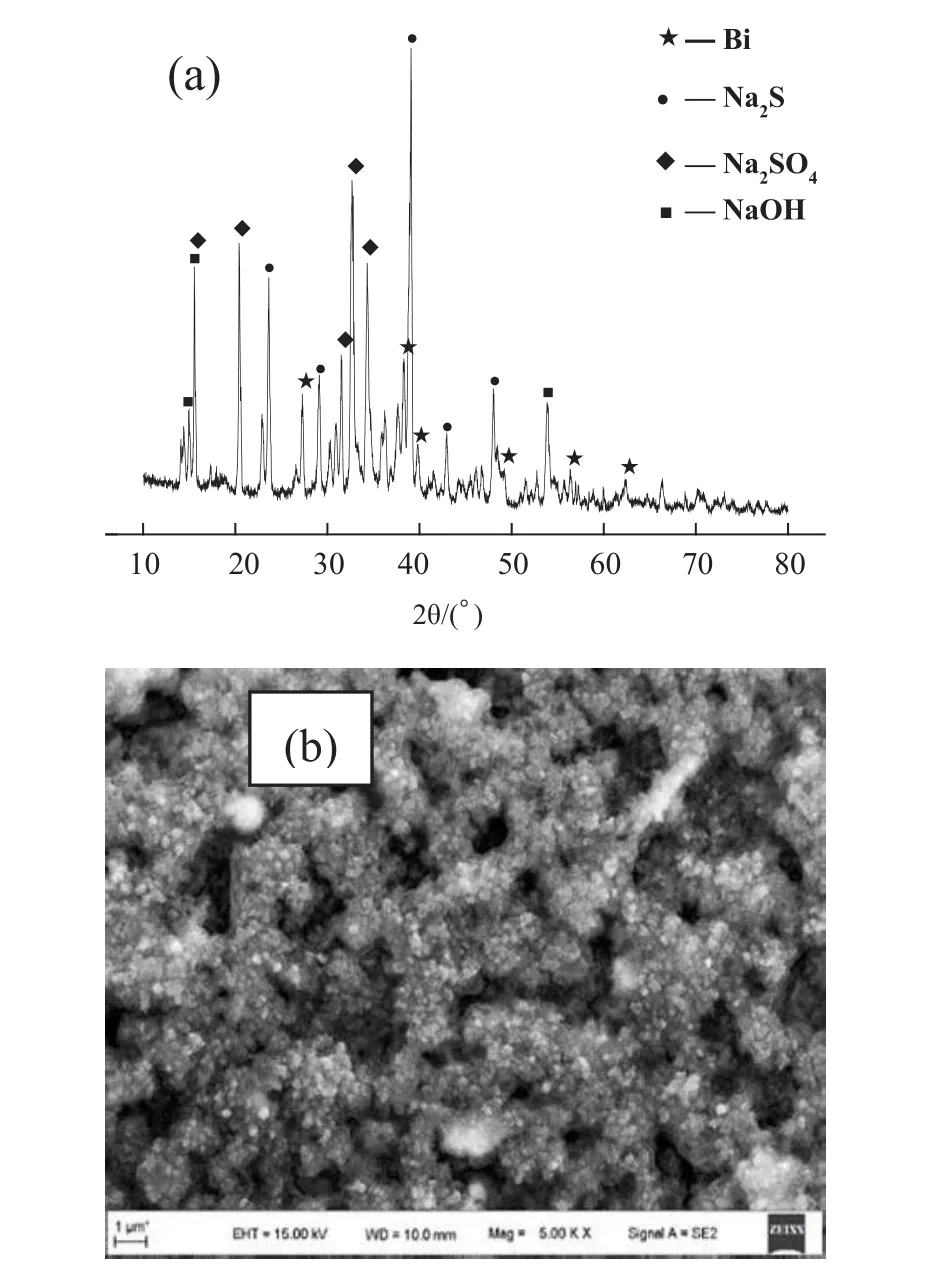
图1 Bi2S3与NaOH熔体的XRD图(a)和SEM图(b)Fig. 1 XRD pattern (a) and SEM image (b) of the reaction melt of Bi2S3 and NaOH
由图1可知,熔炼物料的主要物相为金属Bi、Na2S、Na2SO4以及过量的NaOH,可知硫化铋在熔融氢氧化钠中发生的化学反应为:
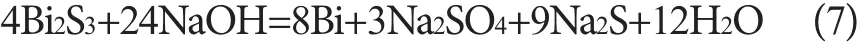
由图1(b)熔炼产物的SEM分析可知样品粒度较细,颗粒粘结在一起,具有一定的金属光泽,表明金属Bi的生成。
2.2 硫化铋和氢氧化钠混合体系熔化温度的测定
将Bi2S3与NaOH按不同比例混合,研究不同组分混合体系熔化温度随氢氧化钠含量变化的规律,样品收缩率与温度的关系见图2。
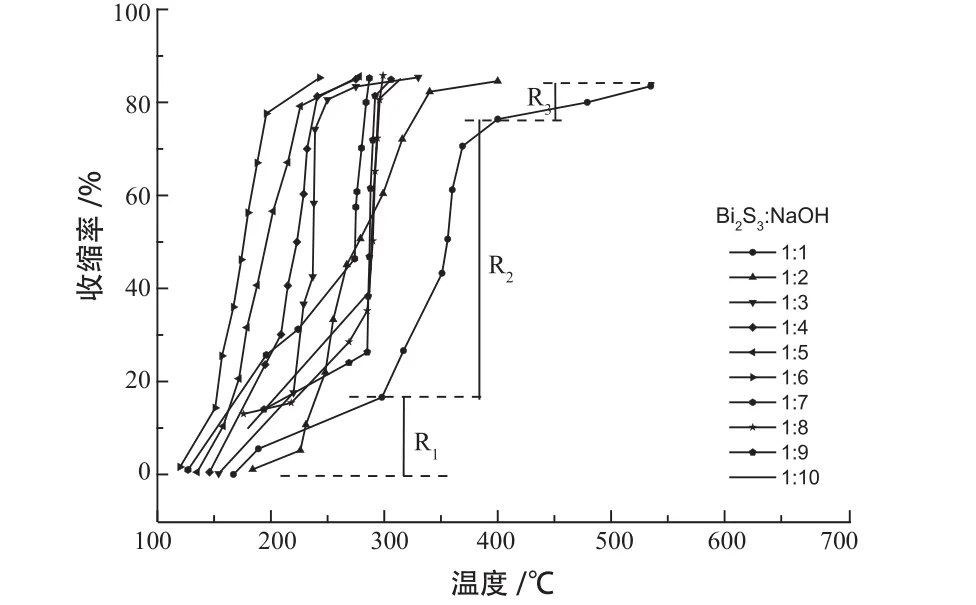
图2 不同组分的Bi2S3-NaOH体系熔化的收缩曲线Fig. 2 Melt shrinkage curves of Bi2S3-NaOH system with different compositions
由图2可知,当Bi2S3与NaOH配比为1:1时,样品温度低于298℃时,样品收缩率较低,小于16.6%,该阶段为缓慢收缩阶段R1。温度继续升高,样品收缩显著加快,369℃时收缩率达70.6%,收缩率增加了54%,此阶段为快速收缩阶段R2。温度再继续升高,样品收缩逐渐减缓,在高于400℃时,几乎无收缩,样品坍塌为流动阶段R3。
一定氢氧化钠含量的范围内,随着氢氧化钠含量的增加,R1阶段的初始温度逐渐降低,由料碱比1:1时的184℃,降低至料碱比1:6时的120℃。R2和R3阶段的起始温度也逐渐降低,分别由料碱比1:1时的298℃和369℃降至1:6时的150℃和243℃。这说明随着氢氧化钠含量的增加,样品开始收缩温度逐渐降低,缓慢收缩阶段逐渐变窄,快速收缩阶段的起始温度逐渐降低,收缩速率增加,样品开始坍塌的温度逐渐降低。
根据不同组分的Bi2S3-NaOH混合体系的熔点数据,绘制样品完全熔化温度随氢氧化钠含量变化的曲线见图3。
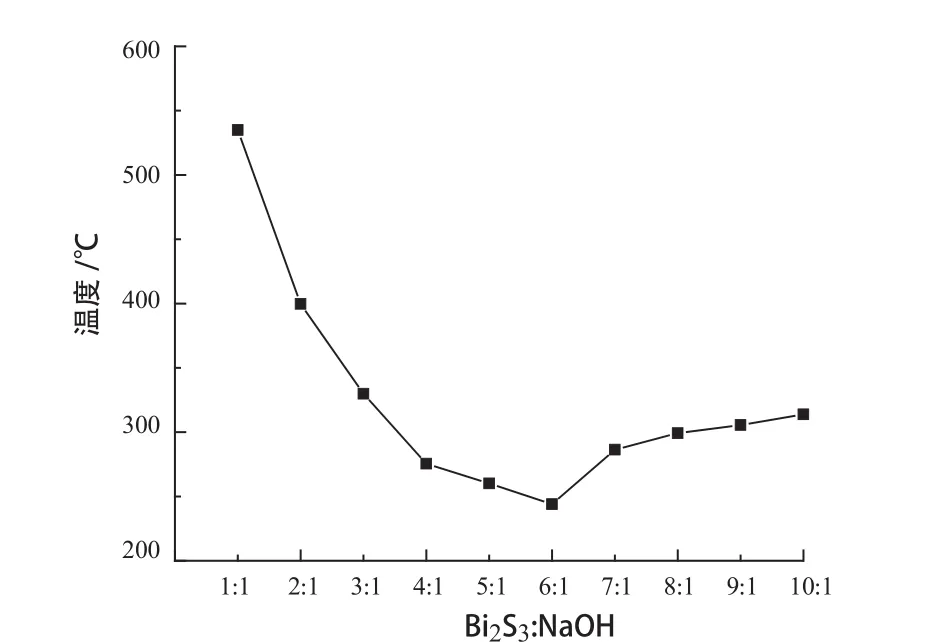
图3 不同组分的Bi2S3-NaOH体系熔点与氢氧化钠含量的关系Fig.3 Relationship between melting point of Bi2S3-NaOH system with different components and NaOH content
由图3可知,Bi2S3-NaOH混合体系的熔化温度随着氢氧化钠含量的增加逐渐降低,这是由氢氧化钠的熔点相对于硫化铋较低所致;当Bi2S3与NaOH比例为1:6(氢氧化钠含量为85.71%)时,体系组分同时熔化,混合物熔点达到最低为243℃,此时的温度称之为最低共融温度或最低共熔点;之后随着氢氧化钠含量的增加,混合物体系的熔点均逐渐增高至氢氧化钠熔点321℃。
2.3 硫化铋和氢氧化钠混合熔体的高温密度的测定
不同组分混合体系高温密度随温度变化的规律见图4。
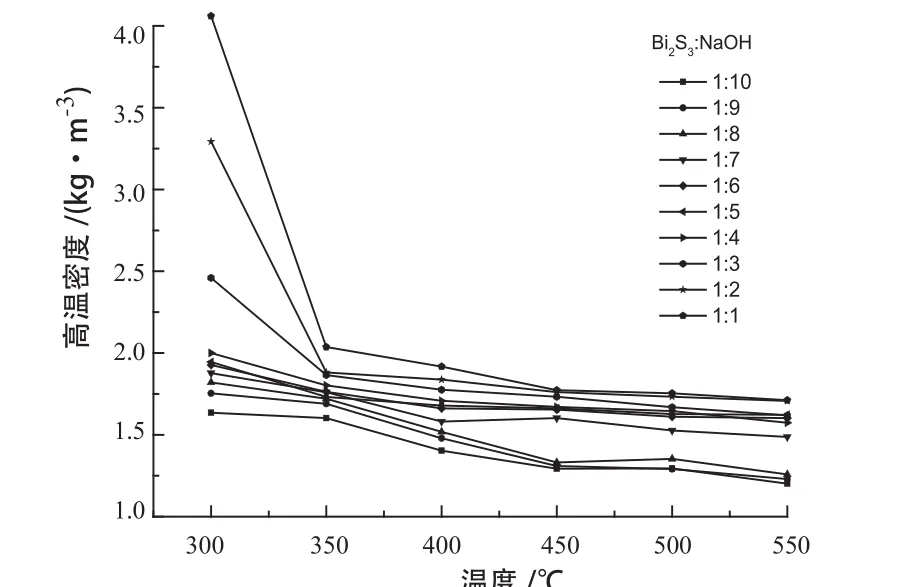
图4 不同组分的Bi2S3-NaOH体系高温密度与温度的关系Fig .4 Relationship between high temperature density of Bi2S3-NaOH system with different components and temperature
为避免误差,每个温度点测量6次取平均密度值。由图4可知,Bi2S3与NaOH配比一定的条件下,混合熔体的密度随着温度的升高而减小。这是因为温度升高,体系熔化的质点越多,质点的热运动加强,质点间距离加大,熔融体系体积膨胀,密度降低。当NaOH与Bi2S3的配比小于4:1时,混合熔体的密度在温度低于450℃时,随着温度的升高降低幅度较大,在温度高于450℃时,随着温度的升高降低幅度较小。同一温度条件下,Bi2S3-NaOH混合体系的密度随着氢氧化钠含量的增加而降低,这是由于氢氧化钠含量较少时,体系中的Bi2S3没有完全熔化,随着温度的升高,体系快速熔化碱熔反应加速,导致密度迅速降低;在高温下混合熔体已完全融化,体系趋于稳定,温度的升高对熔体密度的影响较小。在氢氧化钠含量较高时,体系熔融温度较低,已完全熔化,体系稳定,温度升高对密度的影响较小。
2.4 硫化铋和氢氧化钠混合熔体的表面张力的测定
不同组分Bi2S3-NaOH混合熔体的表面张力随温度的变化规律,结果见图5。
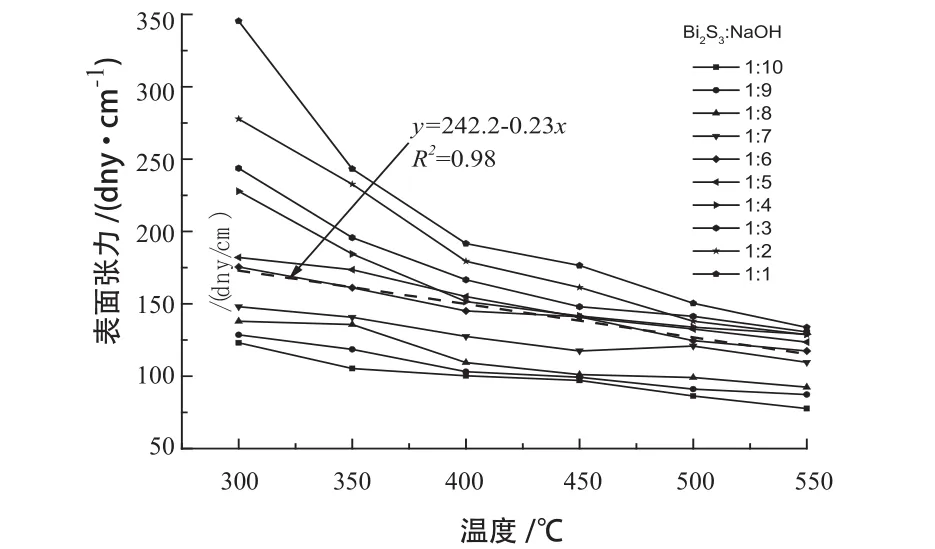
图5 不同组分的Bi2S3-NaOH体系表面张力与温度的关系Fig .5 Relationship between surface tension of Bi2S3-NaOH system with different components and temperature
为避免误差,每个温度点测量6次取平均表面张力值。由图5可知, Bi2S3与NaOH配比一定的条件下,混合熔体的表面张力随着温度的升高而逐渐减小;因为温度升高,质点的热运动增加,体积膨胀,位于液体内部的质点与液体表面上质点间的相互作用力减弱,表面张力降低。同一温度条件下,Bi2S3-NaOH混合熔体的表面张力随着氢氧化钠的含量增加而减小,这是因为氢氧化钠的含量越高,体系中阴阳离子间的作用力越弱,表面张力也降低。氢氧化钠含量大时温度对体系的表面张力影响较小,相反氢氧化钠量少体系表面张力受温度的影响较大。当Bi2S3与NaOH比例为6:1时,表面张力与温度为较好的线性关系,方程为:
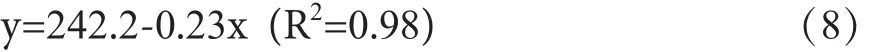
2.5 硫化铋和氢氧化钠混合熔体粘度的测定
研究温度和氢氧化钠含量对不组分Bi2S3-NaOH混合体系粘度的影响,得到的体系粘度随温度变化的曲线见图6。
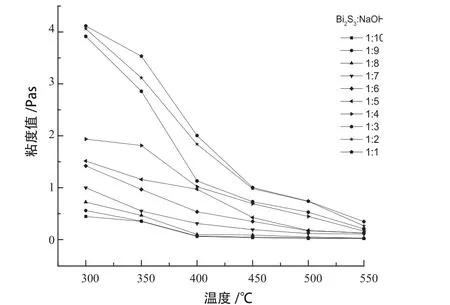
图6 不同组分的Bi2S3-NaOH体系粘度与温度的关系Fig .6 Relationship between viscosity of Bi2S3-NaOH system with different components and temperature
为减少误差,每个温度点测量20次取粘度平均值。
由图6可知,随着温度的升高Bi2S3-NaOH混合体系的粘度显著降低。粘度是流体粘滞性的一种量度,是流体流动力对其内部摩擦现象的一种体现,决定了熔体的流动性,并影响反应速率。粘度与温度间存在指数函数关系:
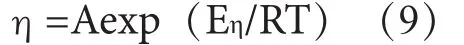
其中:A为常数;Eη为粘流活化能。
当温度升高时,有利于克服熔体中质点流动的能碍——粘流活化能,熔体中原子或原子团相互间摩擦力的减小,体系的粘度降低;温度降低时,熔体中质点活动能力逐渐变差,粘度平缓上升。同一温度下Bi2S3-NaOH混合熔体的粘度随着氢氧化钠含量的增加而减小,这是因为氢氧化钠含量的增加,体系的熔点降低,随着温度的升高,体系中熔化的硫化铋的不断增加,流动性增加,流体的流动力减小,粘度减小。
3 结 论
(1) Bi2S3-NaOH体系的熔化过程可分为缓慢收缩段,快速收缩段和流动阶段;Bi2S3-NaOH体系的熔化温度随着NaOH含量的增加逐渐降低,当Bi2S3:NaOH为1:6时达到最低共熔温度,而后随着NaOH含量的增加逐渐增大。
(2) 一定组分的Bi2S3-NaOH熔体,其高温密度、表面张力和粘度都随着温度的升高而减小;温度一定的条件下,Bi2S3-NaOH熔体的高温密度、表面张力和粘度都随着NaOH含量的增加而减小,且在NaOH含量低时减小幅度大,NaOH含量高时缓慢降低。
(3) 当 Bi2S3与 NaOH 比 例 为 6:1时,Bi2S3-NaOH熔体的表面张力与温度呈现较好的线性关系为:y=242.2-0.23x (R2=0.98)。
