脓毒症患儿外周血miR-146a、miR-223的水平变化及意义
2020-07-09杨家伟胥亚福谢新
杨家伟,胥亚福,谢新
阿坝藏族羌族自治州人民医院,四川阿坝州 624000
脓毒症是临床常见的全身性炎症反应综合征,主要由感染等因素造成宿主免疫反应失调而导致的致命性器官功能障碍,本质为机体过度免疫反应造成的炎症反应损伤自身[1,2]。脓毒症的发病率和致死率均较高,每年有将近1 800万新发脓毒症患者,脓毒症能诱发脓毒症休克、多器官功能衰竭综合征,甚至导致患者死亡,其发病机制尚未明确[3,4]。尽管医学诊疗技术不断发展,但仍未有效降低脓毒症的发病率和病死率,反而以每年8.7%的发病率递增,给患者家庭及社会造成沉重的经济负担[5]。微生物培养曾被认为是诊断脓毒症的“金标准”,但耗时长,准确率仅50%左右,并不利于脓毒症早期诊疗[6]。近年研究发现,生物标志物可用于诊断和治疗脓毒症,微小RNA(miRNA)广泛存在于真核细胞,具有高度保守的特点,能够微调机体免疫功能,其中miR-146a是第一个被发现影响机体免疫炎症反应的miRNA[7],同时发现miR-223能影响脓毒症患者的免疫炎症反应[1],但两者对脓毒症患儿的临床意义并未做全面研究。本研究通过探讨脓毒症患儿外周血miR-146a、miR-223水平变化及临床意义,旨在为脓毒症诊疗提供理论依据。
1 资料与方法
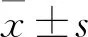
1.1 临床资料 选择2017年3月~2019年7月收治的脓毒症患儿77例作为研究组,患儿诊断均参考2012版脓毒症国际指南诊断标准[8],存在高度可疑的感染灶,同时符合SIRS的诊断标准。纳入标准:①临床资料完整,且依从性高;②经患儿家属同意,并签署知情同意书。排除标准:①入院24 h内即出院的患儿;②发病时间超过72 h;③合并患有先天性畸形、结缔组织病等;④合并心、肝、肾等重大脏器病变;⑤中途退出研究。入组患儿中男42例、女35例,年龄6~15(10.63±2.52)岁。治疗后转归情况:生存期≥28 d者50例(生存组),生存期<28 d者27例(死亡组)。同时选择全身性炎症反应综合征(SIRS)患儿65例(SIRS组),其中男37例、女28例,年龄6~14(10.51±2.39)岁。SIRS诊断参考文献[8]标准:①体温超过38 ℃或低于36 ℃;②心率超过90次/min;③呼吸频率超过20次/min或二氧化碳分压低于32 mmHg;④外周血白细胞计数超过12.0×109/L或低于4.0×109/L。符合以上至少两项临床诊断标准即被诊断为SIRS。另选择同期于我院体检健康的儿童68例作为对照组,其中男37例、女31例,年龄7~14(10.36±2.41)岁。三组受试者的平均年龄及性别比较差异无统计学意义(P均>0.05)。本研究通过我院医学伦理委员会批准。
1.2 样本采集 脓毒症患儿于入住重症监护室后,采集外周静脉血5 mL,SIRS患儿于术后24 h内采集外周静脉血5 mL,对照组于体检日采集外周静脉血5 mL,置于涂有乙二胺四乙酸二钠盐抗凝的采血管中,3 500 r/min离心10 min,离心半径为13 cm,分离上清液,即得血浆,置于-80 ℃冰箱中备用待测。
1.3 外周血miR-146a和miR-223表达测定 采用qRT-PCR法。取出血浆解冻,采用TRIzol总RNA提取试剂(购自美国Invitrogen公司)提取血浆中总RNA,严格按照说明书进行操作,使用紫外分光光度计测定总RNA的吸光度(A260和A280),并计算A260/A280,若值在1.8~2.0,表示提取的总RNA纯度高,反之,纯度不高,需要重新提取。提取总RNA后,使用逆转录试剂盒进行逆转录,产生cDNA,扩增过程在聚合酶的作用下进行,扩增条件:95 ℃维持5 min,95 ℃变性 15 s;60 ℃退火60 s;72 ℃延伸30 s。共计进行40个循环,最后使用StepOne Plus荧光定量PCR仪(美国ABI公司提供)进行检测,对照设置为U6RNA,每个反应包括3个复孔,计算平均值。
1.4 血浆中炎性因子检测 采用酶联免疫吸附法检测血浆中肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-6、IL-10及C-反应蛋白(CRP)水平,试剂盒购自美国R&D公司,严格按照试剂盒说明书进行操作。
1.5 急性生理学与慢性健康状况评分系统Ⅱ评分[9]评价 APACHEⅡ评分包括三部分,即急性生理评分、年龄评分及慢性健康评分。急性生理评分包括12项生理指标,每项分值为0~4分,选择入住重症监护室最初24 h内的最差值。年龄分值为0~6分,慢性健康评分为2~5分。最终得分为三项总分,理论最高得分71分。分数越高,预后效果越差。
2 结果
2.1 三组外周血miR-146a、miR-223表达及炎性因子水平比较 三组外周血miR-146a、miR-223表达及炎性因子水平间差异有统计学意义(P均<0.05)。研究组和SIRS组外周血miR-146a、miR-223表达及血浆TNF-α、IL-6、IL-10及CRP水平均高于对照组,同时研究组外周血miR-146a、miR-223表达及炎性因子水平高于SIRS组(P均<0.05),见表1。

表1 三组外周血miR-146a、miR-223表达及炎性因子水平比较
注:与对照组相比,*P<0.05;与SIRS组相比,#P<0.05。
2.2 不同转归患儿外周血miR-146a、miR-223表达和APACHEⅡ评分、炎性因子水平比较 死亡组外周血miR-146a、miR-223表达及血浆TNF-α、IL-6、IL-10、CRP水平和APACHEⅡ评分均高于生存组(P均<0.05),见表2。
2.3 外周血miR-146a和miR-223表达与炎性因子

表2 不同转归患儿外周血miR-146a、miR-223表达、APACHEⅡ评分及炎性因子水平比较
水平和APACHEⅡ评分的相关性 外周血miR-146a与TNF-α、IL-6、IL-10、APACHE Ⅱ评分呈正比(r分别为0.693、0.522、0.403、0.507,P均<0.05),而与CRP无相关性(r=0.132,P>0.05);外周血miR-223与TNF-α、IL-10、CRP和APACHE Ⅱ评分呈正比(r分别为0.516、0.432、0.501、0.531,P均<0.05),而与IL-6无相关性(r=0.178,P>0.05)。
2.4 外周血miR-146a、miR-223表达对患者预后的预测价值 外周血miR-146a、miR-223表达预测患者预后的ROC曲线下面积分别为0.761、0.748,理论阈值分别为5.8、13.0,约登指数分别为0.504、0.467,灵敏度分别为0.776、0.715,特异度分别为0.728、0.752;miR-146a、miR-223联用对患者预后预测的灵敏度和特异度分别为0.852(23/27)、0.880(44/50),约登指数为0.732。
3 讨论
我国脓毒症发病率每年仍以8%的速度增长,早期诊断和治疗对降低脓毒症的病死率有重要意义[6]。如果早期未给予脓毒症患儿及时治疗,可能进一步发展为脓毒性休克及器官功能障碍综合征,成为儿科重症监护室危重症患儿死亡的重要原因之一[10]。目前认为脓毒症的发病机制主要包括:全身炎症反应、免疫功能障碍、组织损伤、凝血功能异常及宿主对外源微生物的异常反应等[11]。机体在脓毒症早期为了抵御外界感染及组织损伤等,巨噬细胞、内皮细胞、中性粒细胞及淋巴细胞产生大量的炎性因子,包括TNF-α、IL-6、IL-10等[12]。miRNA是机体内源性单链非编码小RNA分子,参与细胞的发育、分化、增殖、代谢、凋亡及应激等,同时调节炎性因子的表达[10,13]。脓毒症发展过程中,机体的免疫功能紊乱,越来越多的研究发现,miRNA影响脓毒症的发生发展,其中miR-146a和miR-223通过调控炎症和免疫反应而发挥作用[14]。早期研究发现,脓毒症患者血浆中miR-146a和miR-223表达异常,且有高度的灵敏度和特异性,推测两者可能是诊疗脓毒症的生物标志物[13,15]。
本研究结果发现,脓毒症患儿、SIRS患儿及健康儿童外周血miR-146a、miR-223表达及炎性因子水平逐渐降低,说明外周血miR-146a、miR-223和炎性因子参与脓毒症的发生发展,同时组间差异有统计学意义,进一步说明外周血miR-146a、miR-223表达及炎性因子水平可能对于区分脓毒症和SIRS具有指导意义。另外,生存组外周血miR-146a、miR-223、炎性因子及APACHEⅡ评分均低于死亡组,差异有统计学意义,与侯果等[16]研究结论相符。相关性研究结果显示,外周血miR-146a、miR-223与炎性因子和APACHEⅡ评分密切相关,提示外周血miR-146a和miR-223可能通过影响炎性因子水平而参与脓毒症的发生发展。推测其中的原因与miR-146自身性质有紧密联系。miR-146包括miR-146a和miR-146b,不同来源miR-146a和miR-146b的基因定位不同,两者的5′端关键序列相同,而3′端的2个碱基有差异,从而使其发挥的作用不同[6]。抗炎和促炎反应失衡是诱发脓毒症的重要发病机制,miR-146a作用于TLR-NF-κB信号通路上的多个靶点,如IL-8、TRAF6、FADD、CCL5、IRAK1、IRAK2等,影响免疫细胞的分化及凋亡过程,从而负反馈调节免疫炎症反应[6,17],同时miR-146a通过调节内毒素耐受程度从而控制炎症反应,减少对机体的损伤[6]。另外,miR-146a能加速转录抑制因子Rel B与TNF-α启动子结合进程,形成异染色质,进而直接抑制炎性因子的转录过程,同时抑制Ago2和RBM4的相互作用,从而形成mi RISC复合体,阻断TNF-α蛋白的翻译[18]。miR-223是最近被鉴定的小干扰RNA,且脓毒症患者血浆中miR-223水平异于常人,缺失miR-223则加重脓毒症诱发的炎症反应和心功能障碍,推测血浆miR-223可能是脓毒症的生物标志物[19,20]。miR-223和IKK-α基因的3′UTR互补,巨噬细胞集落刺激因子刺激人单核细胞发生分化时,miR-223水平下降,同时IKK-α水平升高,加重机体的炎症反应,调节免疫机制[21]。miR-146a和miR-223通过不同的作用机制影响脓毒症患儿的炎症反应,从而在不同转归结果的患儿得到体现,进一步证明,miR-146a和miR-223可作为反映脓毒症患儿病情发展的生物学指标之一。进一步ROC曲线结果显示,miR-146a和miR-223对脓毒症患儿近期预后的灵敏度和特异度均高于0.7,而联合预测的灵敏度和特异度分别为0.852、0.880,早期检测外周血miR-146a和miR-223水平可预测患儿的近期预后,以指导临床对应诊治,提高患儿预后。
综上所述,脓毒症患儿外周血miR-146a、miR-223表达异常升高,与患儿炎性因子状态、病情发展及转归密切相关,检测外周血二者水平有助于预测患儿近期预后。
