脯氨酸类N-酰胺衍生物的核磁共振研究
2020-07-09刘季红
刘季红,靳 焜,刘 涛
(1.大连理工大学 分析测试中心,辽宁 大连 116024; 2.大连理工大学 精细化工国家重点实验室,辽宁 大连 116024)
脯氨酸(proline,Pro)作为一种天然氨基酸,广泛存在于动、植物中.它不仅可以参与蛋白质的合成,还可以作为细胞内的渗透调节物质.例如,植物在抗盐胁迫(干旱、盐渍等)条件下,体内会大量累计脯氨酸[1].而在动物体内,脯氨酸对牙釉质的修复具有很重要的作用[2].脯氨酸不同于一般的α-氨基酸,结构非常独特,其侧链氨基与原子骨架形成了吡咯烷环.基于脯氨酸的重要作用,开展了许多针对其构象的研究,但这些成果主要集中采用红外和拉曼光谱的表征[3],而如何利用核磁共振技术对氨基酸的手性进行鉴别却鲜有报道.
核磁共振(nuclear magnetic resonance, NMR)可以在近似生理环境下对样品进行无损检测,检测方法具有多样性,提供丰富的实验参数,反映出大量的结构信息,在分子结构解析的研究方面具有很多优点.对于解析结构复杂的化合物,2D NMR 技术具有简单、高效和可靠的特点[4-5],在确定构象异构中也具有十分重要的作用.
根据文献[6-9]报道,N-酰腙类化合物存在关于-CONH-基团的R/S构象异构体,并在极性较大的溶剂,如二甲基亚砜-d6(DMSO-d6)中旋转相互转化,存在着两种形式的构象异构体.本文分别对L-Fmoc-脯氨酸和D-Fmoc-脯氨酸的仲胺引入酰腙骨架,发现均可生成D型和L型脯氨酸类化合物.已有文献[10]报道,此类化合物在2-(7-氮杂苯并三氮唑)-N,N,N',N'-四甲基脲六氟磷酸盐(HATU)作为偶联剂的条件下,手性100%保持,通过质谱和高效液相色谱法来确定产物结构和纯度,但未见其结构的解析.
我们利用质谱和多种核磁共振技术[包括1H NMR、13C NMR、、1H-1H同核位移相关谱(1H-1H COSY)、1H-1H质子全相关谱(1H-1H TOCSY)、1H-1H核Overhauser效应谱(1H-1H NOESY)、无畸变的极化转移增强法(DEPT135°)、1H-13C检出1H的异核单量子相干(1H-13C HSQC)、1H-13C检出1H的异核多键相关(1H-13C HMBC)及变温1H NMR技术] 确定其结构,对两种同分异构体的波谱学数据进行了全面详细的解析,并将所有的1H和13C NMR信号进行了归属,分析了异构体所占的比例.本文的研究结果对此类脯氨酸类的化合物构象异构体提供比较全面的参考依据,也为各种波谱学方法在结构鉴定中提供应用实例.
1 试验部分
1.1 仪器与试剂
LTQOrbitrap XL型质谱仪(美国Thermo Scientific公司);Bruker AVANCE Ⅲ 500 MHz型NMR超导谱仪(瑞士Bruker公司);Bruker NEO 400 MHz型NMR超导谱仪(瑞士Bruker公司).
DMSO-d6(氘代率为99.8%,美国CIL公司),含0.03%(v/v) 用于化学位移定标的四甲基硅烷(TMS,δH0.00,δC0.0).其余试剂为分析纯,均购自科密欧.所有试剂均未经进一步提纯,直接使用.
1.2 采样参数
MS谱采集采用LTQ Orbitrap XL型质谱仪, 配备ThermoXcalibur 2.1数据处理系统,ESI离子源,采用正模式进行检测,源喷射电压为3.5 kV,鞘气和辅助气均为氮气,流速分别为15、5 L/min,加热毛细管温度350 ℃.1H NMR、1H-1H COSY、1H-1H TOCSY、1H-1H NOESY、13C NMR、DEPT135、1H-13C HSQC和1H-13C HMBC谱均使用配备了5 mm PABBO BB探头的Bruker AVANCE Ⅲ 500 MHz型NMR超导谱仪, 变温1H NMR谱试验均使用Bruker NEO 400 MHz型NMR超导谱仪.
1.3 化合物合成路线
化合物合成路线如图1所示.冰浴条件下,先将Fmoc-脯氨酸(500 mg,1.5 mmol)溶于10 mL二氯甲烷(DCM)中,然后加入O-(7-氮杂苯并三唑-1-基)-N,N,N',N'-四甲基脲六氟磷酸盐(HATU,1.14 g,3 mmol)和N,N-二异丙基乙胺(DIPEA,0.5 mL,3 mmol),保持0 ℃ 反应1 h.接下来,再加入对氨基苯甲醇(185 mg,1.5 mmol),继续反应6 h.最后,将反应液减压蒸馏,残留物经柱层析分离纯化(石油醚:乙酸乙酯的体积比为4∶1),得到白色固体576 mg,收率87%.
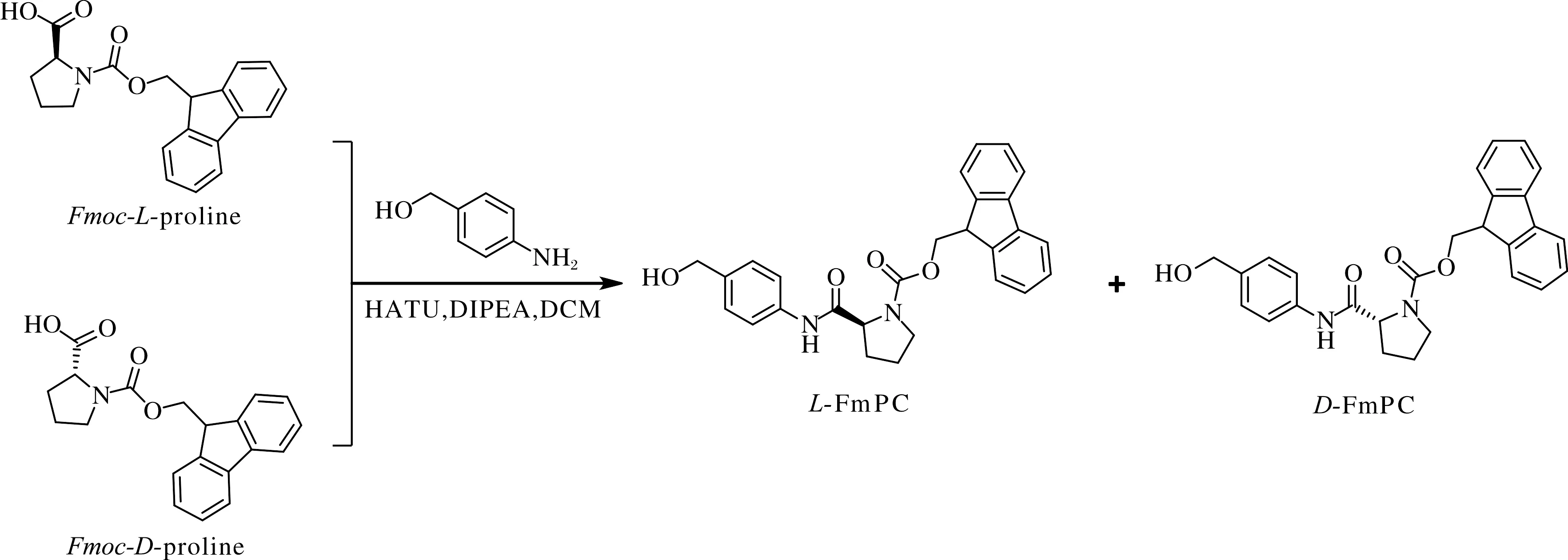
图1 化合物的合成路线Fig.1 Synthetic route of compound
1.4 NMR试验方法
1H NMR和13C NMR的工作频率分别为500.13、125.73 MHz,试验温度25 ℃,谱宽分别为10 330.58、29 761.9 Hz.1H 90°脉冲宽度为11.90 μs,13C 90°脉冲宽度为9.80 μs.二维谱包括2D梯度场COSY、HMBC、HSQC、TOCSY、NOESY谱,均采用标准脉冲程序.COSY的F2(1H) 和F1(1H) 维的谱宽为5 813.95 Hz,采样数据点阵t2×t1=2 048×256,累积次数为4.TOCSY的F2(1H) 和F1(1H) 维的谱宽为5 411.26 Hz,采样数据点阵t2×t1=2 048×256,累积次数为16.NOESY的F2(1H) 和F1(1H) 维的谱宽为5 411.26 Hz,混合时间为0.8 s, 采样数据点阵t2×t1=2 048×256,累积次数为16.HMBC的F2(1H) 和F1(13C) 维的谱宽分别为5 813.95、27 927.39 Hz,采样数据点阵t2×t1=2 048×256,累积次数为32.HSQC的的F2(1H) 和F1(13C) 维谱宽分别为5 813.95、20 827.81 Hz,采样数据点阵t2×t1=2 048×256,累积次数为32.
2 结果与讨论
2.1 化合物的质谱分析
正离子检测模式检测到质荷比(m/z)为443.196 7[M+H]+准分子离子峰,化合物的分子式为C27H26N2O4,精确分子量为442.196 2,和化合物的分子量一致.
2.2 化合物的NMR数据分析
以DMSO-d6作为溶剂测得化合物的1H和13C-NMR (如图2所示),观察它的谱图发现有明显增多的现象,无论是在高场区还是低场区,质子的信号数目均大于理论值,并且成对出现,推断其化合物可能存在两种立体构象异构体L型与D型.为了便于化合物的归属,将两种异构体的原子编号,如图3所示.
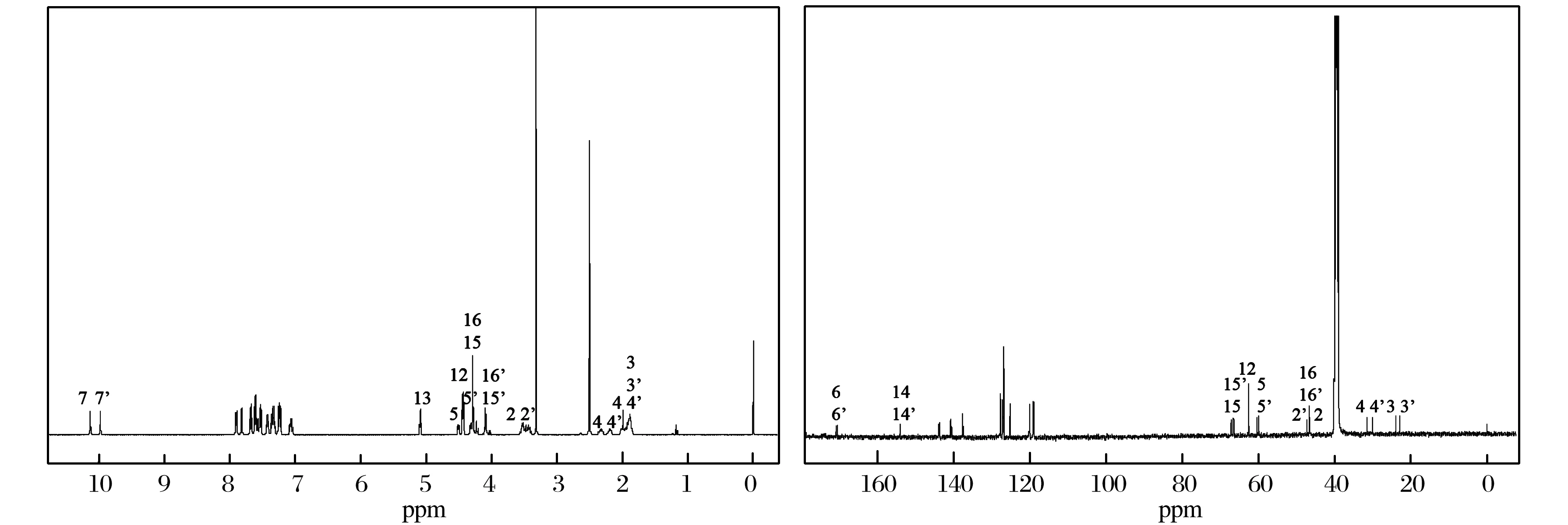
图2 化合物的1H和13C-NMRFig.2 1H NMR and 13C NMR spectra of compound

图3 化合物的结构式Fig.3 Chemical structure of compound
根据文献[6-7],当结构中C=O的氧原子与N-H中的氢原子在同侧时为顺式构象,绝对构型为R,即为图3结构中的D型化合物.当结构中C=O的氧原子与N-H中的氢原子在异侧时为反式构象,绝对构型为S,即为图3结构中的L型化合物.因而低场区δH10.13 (1H, s) 与δH9.98 (1H, s) 分别归属L型中的H-7和D型中的H-7’.
A环的归属:由HMBC (图4)谱可知,H-7 (δH10.13) 和H-7’ (δH9.98) 分别与羰基C=O (δC170.8和δC170.5) 存在交叉峰,那么δC170.8与δC170.5可归属为C-6和C-6’.C-6 (δC170.8)又分别和δH2.32(1H, m) 与δH2.00 (1H, m) 存在着远程耦合,C-6’ (δC170.5) 也分别和δH2.19 (1H, m) 与δH1.95 (1H, m) 存在着远程耦合,可判断出δH2.32 (1H, m) 与δH2.00 (1H, m) 归属于H-4,δH2.19 (1H, m) 与δH1.95 (1H, m) 归属于H-4’,质子H-4和H-4’在CH2中的两个原子由于构型的原因,造成化学环境的不等价,分别呈现不同的化学位移值.再根据COSY谱(图5)可知,H-4 (δH2.32) 与δH1.96 (1H, m) 存在交叉峰,因此δH1.96 (1H, m) 归属为H-3.H-4’ (δH2.19) 与δH1.89 (1H, m) 存在交叉峰,δH1.89 (1H, m) 归属为H-3’.同时H-4 (δH2.32) 与δH4.51 (1H, m) 存在交叉峰,故δH4.51 (1H, m) 归属为H-5.H-4’ (δH2.19) 与δH4.32 (1H, m) 存在交叉峰,δH4.32 (1H, m)归属为H-5’.H-3 (δH1.96) 与δH3.53 (1H, m)、δH3.45 (1H, m) 存在交叉峰,归属为H-2.H-3’ (δH1.89) 与δH3.47 (1H, m)、δH3.41 (1H, m)存在交叉峰,归属为H-2’.然后根据HSQC (图6) 谱,可以继续推断出C-2 (δC47.3)、 C-2’ (δC46.5)、C-3 (δC24.0)、C-3’ (δC23.9)、C-4 (δC31.5)、C-4’ (δC30.2)、C-5 (δC59.9)、C-5’ (δC60.3).

图4 化合物的1H-13C HMBC 全图及部分放大图Fig.4 Complete and partial expanded 1H-13C HMBC spectra of compound

图5 化合物的1H-1H COSY 全图及部分放大图Fig.5 Complete and partial expanded 1H-1H COSY spectra of compound
B环的归属:δC46.7为C-16,H-7 (δH10.13) 和H-7’ (δH9.98) 还分别与δC119.0、δC118.9存在交叉峰,那么δC119.0与δC118.9可归属为C-9和C-9’,然后根据HSQC (图6) 谱,得知C-9 (δC119.0)和δH7.62 (2H,d)有相关点,确定δH7.62为H-9.C-9’(δC118.9)和δH7.54 (2H,d)有相关点,确定δH7.54为H-9’.由COSY谱(图5)可知,H-9 (δH7.62)和δH7.25存在着远程耦合,H-9’ (δH7.54) 和δH7.23存在着远程耦合,分别归属为H-10和H-10’.由HSQC (图6) 谱,可以归属δC126.8为C-10和C-10’,两者化学位移值相同.由HMBC(图4)谱看出,H-10 (δH7.25)与H-10’ (δH7.23)和δC137.6存在着远程耦合,将其归属成C-8.H-9 (δH7.62)和δC137.5存在着远程耦合,将其归属成C-11, H-9’ (δH7.54)和δC137.3存在着远程耦合,将其归属成C-11’.

图6 化合物的1H-13C HSQC全图及部分放大图Fig.6 Complete and partial expanded 1H-13C HSQC spectra of compound
C环的归属:根据13C NMR谱(图2)可知,δC153.9可以直接归属为C-14.由HMBC(图4)谱看出,C-14 (δC153.9) 与δH4.29 (2H, m)、δH4.23 (1H, m)、δH4.09 (1H, m)存在着远程耦合相关峰,将δH4.29 (2H, m)归属为H-15,δH4.23和δH4.09归属为H-15’.由HSQC谱(图6)可知, H-15 (δH4.29)和δC66.5有交叉峰,可将其归属是C-15,H-15’ (δH4.23和δH4.09) 和δC67.1有交叉峰,可将其归属是C-15’.由TOCSY谱(图7)可知,δH7.35 (1H, t)、δH7.43 (1H, t) 、

图7 化合物的1H-1H NOESY全图及1H-1H TOCSY部分放大图Fig.7 Complete 1H-1H NOESY and partial expanded1H-1H TOCSY spectra of compound
δH7.68 (1H, t)与δH7.91 (1H, d)相互之间存在交叉峰,可以判断出这4个原子处于同一个自旋系统内.而δH7.07 (1H, m)、δH7.33 (1H, t)、δH7.58(1H, m)与δH7.82 (1H, d) 相互之间存在交叉峰,可以判断出这4个原子处于同一个自旋系统内.由NOESY谱(图7)可知,H-15 (δH4.29)与δH7.68 (1H, t)存在交叉峰,证明H-15与其有空间的耦合,确定δH7.68归属为H-18.由COSY谱(图5)可知,H-18 (δH7.68)与δH7.35 (1H, t)存在远程耦合,确定δH7.35为H-19.同理可得,H-19 (δH7.35)与δH7.43 (1H, t)存在远程耦合,确定δH7.43为H-20.H-20 (δH7.43)与δH7.91 (1H, d)存在远程耦合,确定δH7.91为H-21.
对于另一个构型中C环的归属,由于没有直接的相关点可以依据,我们从两种构型相似原子的化学位移值相近的经验出发,确定δH7.82 (1H, d)归属是D型中的H-21’.再根据COSY谱(图5)可知,依次推断出δH7.33 (1H, t) 归属是D型中的H-20’,δH7.07 (1H, m) 归属是D型中的H-19’,δH7.58 (1H, m) 归属是D型中的H-18’.然后根据HSQC (图6) 谱中各原子对应的相关点,找出碳原子的归属,即δC46.7为C-16、δC46.6为C-16’、δC125.1为C-18、δC125.2为C-18’、δC127.1为C-19、δC127.0为C-19’、δC127.6为C-20、δC127.5为C-20’、δC120.1为C-21、δC120.0为C-21’.
由HMBC(图4)谱可知,H-21 (δH7.91)与δC143.9存在着远程耦合,H-21’ (δH7.82) 与δC143.6存在着远程耦合,因此将δC143.9归属于C-17,δC143.6归属于C-17’.H-18 (δH7.68) 与δC140.7存在着远程耦合,H-18’ (δH7.58) 与δC140.5存在着远程耦合,因此将δC140.7归属于C-22,δC140.5归属于C-22’.H-18 (δH7.68) 与δC46.7存在远程耦合,确定δC46.7为C-7,H-18’ (δH7.58) 与δC46.6存在远程耦合,确定δC46.6为C-7’.再根据HSQC (图6) 谱,可以确定δH4.29 (1H, m)是H-16,δH4.09(1H, m)是H-16’.
在HSQC (图6) 谱中,δH5.09 (1H, m) 无对应13C的相关峰,且在变温试验 (图8) 中随温度变化化学位移值变化明显,说明此质子是活泼氢-OH,归属为H-13.根据COSY谱 (图5), H-13与δH4.43 (2H, m) 存在交叉峰,归属为H-12, 再由HSQC谱 (图6) 即可确定相应的C-12 (δC62.5).
化合物脯氨酸类N-酰腙衍生物的两种构象异构体(L型和D型)的1H和13C-NMR 信号归属完成(如表1所列).
在变温1H NMR谱(图8)中,当随着温度的升高(25~80 ℃)时,H-7与H-7’、H-18与H-18’、H-19与H-19’、H-20与H-20’、H-21与H-21’信号峰逐渐合并,说明化合物是以两种构象异构体(L型和D型)混合物形式存在,高温时因为C(O)-N单键的快速旋转使它们的信号峰合并.根据1H NMR谱(图2)中H-7与H-7’积分峰面积的比值,可以算出化合物中L型和D型的含量分别是50%和50%.由上述讨论可以确定化合物的两种构型的结构.
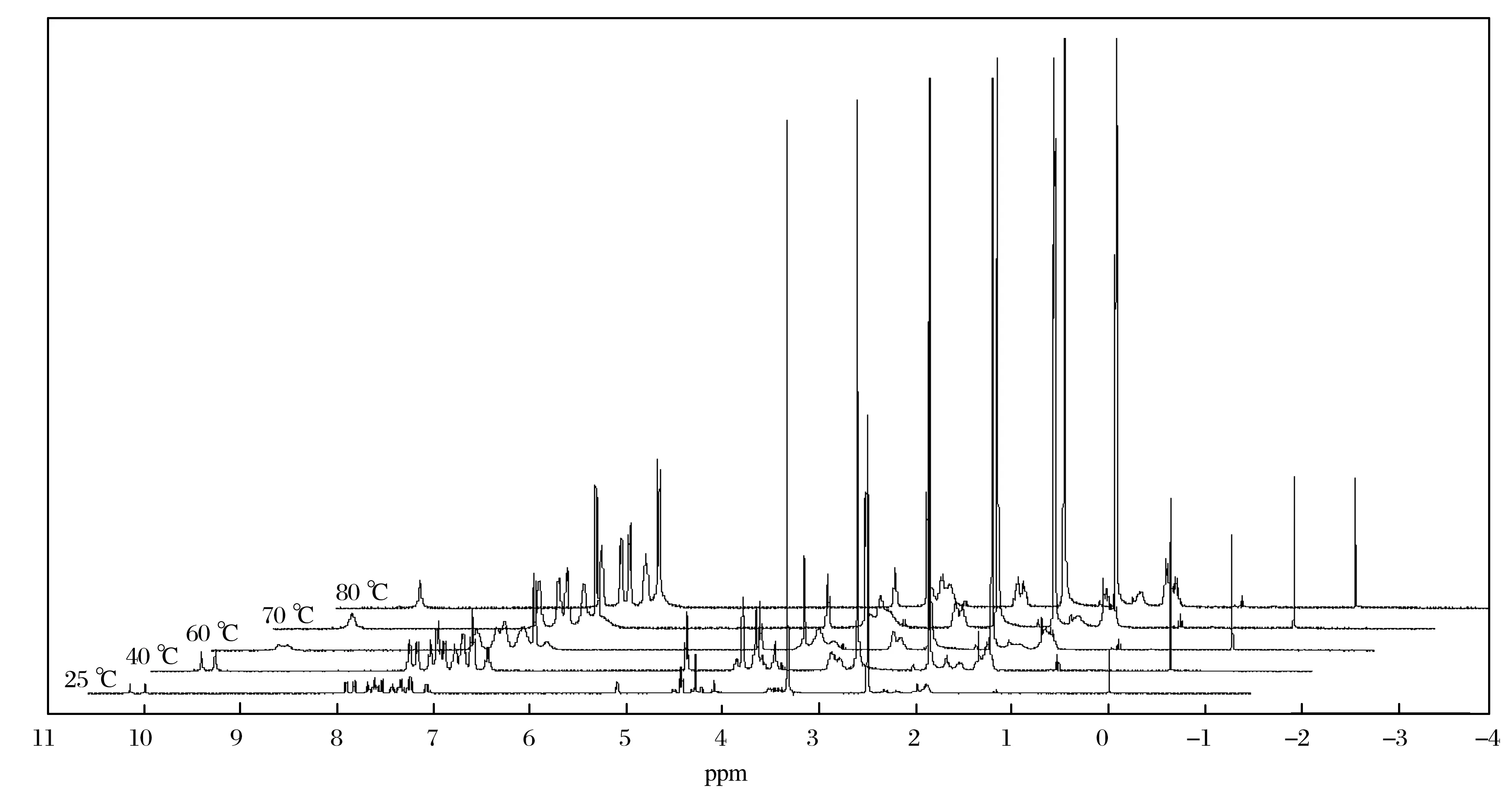
图8 化合物的变温1H NMRFig.8 1H NMR spectra of compound under various temperature
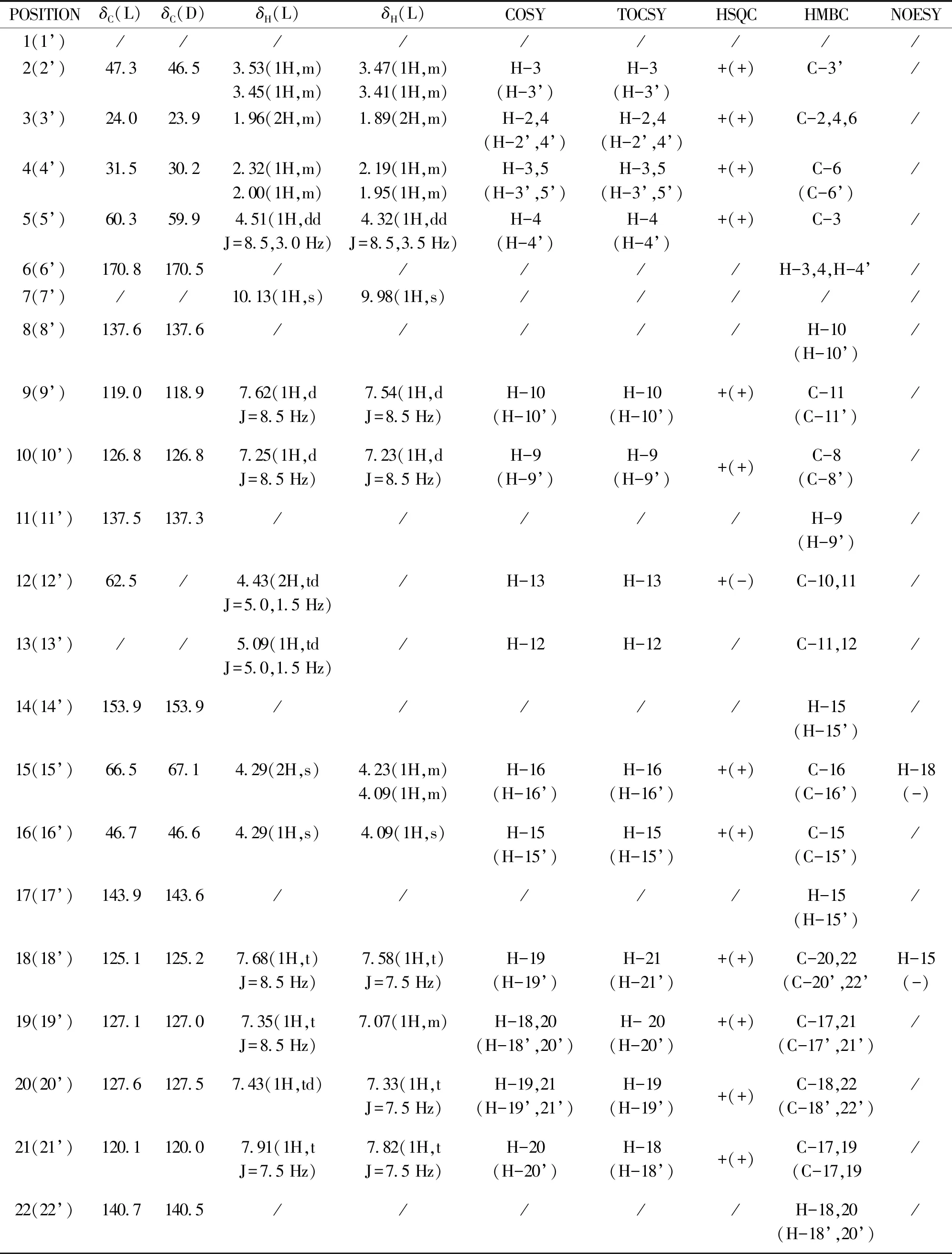
表1 化合物的1H和13C NMR 归属(DMSO-d6, 500 MHz)Table 1 1H and 13C NMR data of compound (DMSO-d6, 500 MHz)
注:括号内表示异构体L的信息,括号外表示异构体D的信息.
3 结论
运用1D和2D NMR技术,对脯氨酸类N-酰腙衍生物的两种构象异构体(L型和D型)的1H NMR和13C NMR信号峰进行了全归属,确证了它们立体化学结构的比例.试验结果表明,室温下在DMSO中L型和D型的顺反异构体以相同的比例同时存在.本文为脯氨酸类N-酰腙衍生物结构鉴定提供了有效补充,具有很好的参考意义.
