魔芋葡甘低聚糖对肥胖大鼠高脂血症及肝损伤的调节作用
2020-07-08李浩霞周中凯商文婷赵亚丽
李浩霞 周中凯 商文婷 庄 敏 赵亚丽
(天津科技大学食品工程与生物技术学院 天津300457)
肥胖是一种慢性代谢疾病,在大多数情况下,是由于长期能量摄入超过能量消耗导致能量失衡,从而使体内多余的脂肪积累[1-2]。据世界卫生组织最新统计数据显示,截止到2016年,全世界约有13%的成年人肥胖(其中男性占11%, 女性占15%),还有超过3.4 亿5~19 岁的儿童和青少年超重或肥胖,1975年至2016年间全球肥胖流行率增长近3 倍[3]。日益严重的肥胖问题还会增加患糖尿病、高血压、心脏病、痛风、关节炎、睡眠呼吸暂停和癌症等疾病的风险[4-6]。 当下人们一直将预防肥胖和减轻体重的重心放在关注饮食和加强体育锻炼上,然而效果并不明显,而且长期的体育锻炼很难坚持。此外,治疗肥胖的药理学方法的发展一直受到不良疗效和严重副作用的困扰[7]。
魔芋(Amurphophallus konjac)在我国已有数千年的种植栽培和食用历史,且资源丰富[8-9]。其主要成分是魔芋葡甘聚糖 (konjac glucomannan,KGM),这是一种可溶性膳食纤维,具有抗肥胖、降血糖、改善高胆固醇血症、润肠通便、抗炎等功能活性[9-11]。KGM 虽然具有良好的生理功能,但是其膨胀系数大,溶于水后黏度较高、流动性不好,使得提取困难,提高了生产成本,因此在食品工业的应用中受到限制[12]。 现在越来越多的研究者发现其降解产物魔芋葡甘低聚糖(KOS)除了具有较好的理化性质和生理功能外, 还具有一些独特的生理功能[13],突出表现在促进双歧杆菌生长、提高机体抗氧化能力、防治高脂血症、降血脂、护肝、排毒与增强免疫功能等[14]。
目前对于KOS 研究较多的是制备条件和理化性质,而关于KOS 对肥胖模型大鼠抗肥胖作用的报道很少。 本研究采用高脂饮食诱导的方法建立营养性肥胖大鼠动物模型,观察KOS 对肥胖大鼠体重、 脂质代谢、 氧化应激及肝功能方面的影响, 探讨其在调节肥胖大鼠高脂血症及肝损伤中可能的机制。
1 材料与方法
1.1 材料与试剂
1.1.1 材料 新鲜的白魔芋,购买于有中国“魔芋之乡” 之称的陕西省安康市岚皋县。 葡甘露聚糖酶, 由实验室分离的解淀粉芽孢杆菌(Bacillus amyloliquefaciens)发酵制得。 魔芋葡甘低聚糖,以新鲜白魔芋为原料,通过酶解法制备,由天津科技大学食品学院粮油科学与工程研究中心提供,纯度在90%以上,含有少量单糖,基本无蛋白质等其它成分检出。
1.1.2 动物和饲料 实验动物:选用体重80~100 g 的4 周龄健康SD 雄性大鼠为受试对象。 由人民解放军军事科学医学院实验动物中心提供。 生产许可证编号:SCXK (军)2012-0004。
基础饲料配方:粗蛋白≥18.0%,粗脂肪≥4.0%,粗纤维≤5.0%,水分≤10.0%,灰分≤8.0%,钙1.0%~1.8%。 高脂饲料配方:63.8%基础饲料,15%猪油,10%蔗糖,1%胆固醇,0.2%胆酸钠,10%蛋黄粉。干预饲料:用5% KOS 替代高脂饲料中的基础饲料,其它相同。
1.1.3 试剂 甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、 丙二醛(MDA)、 超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、谷草转氨酶(AST)、 谷丙转氨酶 (ALT)和碱性磷酸酶(AKP)试剂盒,购于南京建成生物工程研究所。
1.2 主要仪器、设备
YC-015 实验室喷雾干燥机,上海雅程仪器设备有限公司;Sorvall ST 8R 高性能通用台式冷冻离心机, 美 国Ther-mo Fisher 公司;YXQ-LS-75511 立式压力蒸汽灭菌器, 上海博讯实业有限公司医疗设备厂;Epoch2 酶标仪, 美国Bio-Tek公司;Thermo991 超低温冰箱,美国Thermo Fisher公司。
1.3 方法
1.3.1 样品的制备 KOS 的制备流程如图1 所示。
1.3.2 动物实验设计 30 只大鼠适应性喂养1周后,随机分为2 组,基础饲料组10 只,高脂饲料组20 只。喂养8 周后,将肥胖抵抗型大鼠剔除(高脂饲料喂养的大鼠中体重低于正常饲料喂养大鼠平均体重20%),然后随机分为2 组:高脂组(MC)和魔芋葡甘低聚糖干预组(KOS),连续干预6 周。每天记录各组的食物摄入量, 每周固定时间给大鼠称重并记录。试验期间大鼠均自由摄食和饮水,饲养环境清洁,温度22~25 ℃,湿度50%~55%,正常采光。

图1 KOS 制备流程图Fig.1 Flow chart of KOS preparation
1.3.3 指标及检测 干预末禁食不禁水12 h,称大鼠体重并记录。 麻醉后股动脉取血,4 ℃5 000 r/min 离心10 min,取上层血清分装后放于-80 ℃超低温冰箱贮存。 断颈处死后立即解剖取出肝脏称重并计算肝脏指数。
肝脏指数(%)=肝质量(g)/体重(g)×100
血清TG、TC、HDL-C、LDL-C、MDA、SOD、GSH-Px、AST、ALT 及AKP 的测定严格按照测试盒说明书操作,每个样品重复测3 次,结果取平均值。
1.3.4 肝组织病理学观察 大鼠处死后, 速取肝小叶置于福尔马林中, 固定24 h 用水冲洗后,经梯度乙醇脱水、二甲苯作透明剂、常规石蜡包埋处理后切成5 μm 厚薄片,HE 染色, 在显微镜下观察肝切片的形态学变化。
1.4 数据处理
数据采用SPSS 19.0 统计软件进行处理,采用单因素方差分析进行检验,P<0.05 表示具有显著性差异,P<0.01 表示差异极其显著。
2 结果与分析
2.1 KOS 对肥胖大鼠体重的影响
如表1 所示,适应性喂养1 周后,在建模初各组体重无显著性差异, 说明分组是合理的。 建模末,剔除肥胖抵抗大鼠后,高脂饲料喂养的大鼠体重比基础饲料喂养的大鼠高20.67%(P<0.01),表明成功建立了肥胖大鼠动物模型, 与之前的报道一致[15-17]。 如图2a 所示, 从干预的第3 周开始,KOS 组与MC 组相比,体重出现显著性差异(P<0.05)。 连续干预6 周后,KOS 组比MC 组体重降低8.01%(P<0.05)。 如图2b 所示, 经过6 周的干预,KOS 组体重增加量与MC 组存在极显著的差异(P<0.01)。 说明KOS 能有效减缓肥胖大鼠体重的增加。

表1 建模期间大鼠体重Table 1 Body weight of rats during the modeling
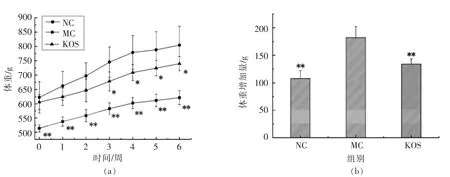
图2 干预期间体重的变化Fig.2 Changes in body weight during administration
2.2 KOS 对肥胖大鼠血清脂质组成的影响
表2 总结了干预结束时大鼠的血脂水平。 结果显示, 与NC 组相比,MC 组大鼠血清中TG、TC和LDL-C 水平显著升高(P<0.01),HDL-C 水平显著降低(P<0.01),表明高脂饮食会导致脂质代谢紊乱。 与MC 组相比,经KOS 干预后,血清中TG、TC 和LDL-C 水平显著降低(P<0.01),而HDL-C水平有升高趋势,表明KOS 能够有效改善肥胖大鼠的血脂水平,调节脂质代谢紊乱。
2.3 KOS 对肥胖大鼠氧化应激的影响
如表3 所示,MDA 水平由低到高分别是KOS组、NC 组和MC 组, 且与MC 组相比,KOS 组和NC 组差异都极其显著(P<0.01),表明高脂饮食会引发脂质过氧化反应,产生较多的脂质过氧化物,而KOS 则可以降低过氧化物的产生量。 SOD 和GSH-PX 水平由高到低分别是KOS 组、NC 组和MC 组,且KOS 组和NC 组水平接近,与MC 组相比,差异极其显著(P<0.01),表明高脂饮食会使体内产生较多的氧自由基,而KOS 则可以提高机体的氧自由基清除能力。
2.4 KOS 对肥胖大鼠肝重和肝脏指数的影响
由图3 可知, 高脂饮食会引起大鼠肝重和肝脏指数的升高(分别见图3a、图3b)。 与NC 组相比,MC 组大鼠肝重和肝脏指数分别增加了1.23倍和63.67%,差异极其显著(P<0.01)。 经KOS 干预后,与MC 组相比,肝重和肝脏指数分别降低了18.85%和8.83%。

表2 KOS 对血清脂质组成的影响Table 2 The effect of KOS on the blood lipids composition
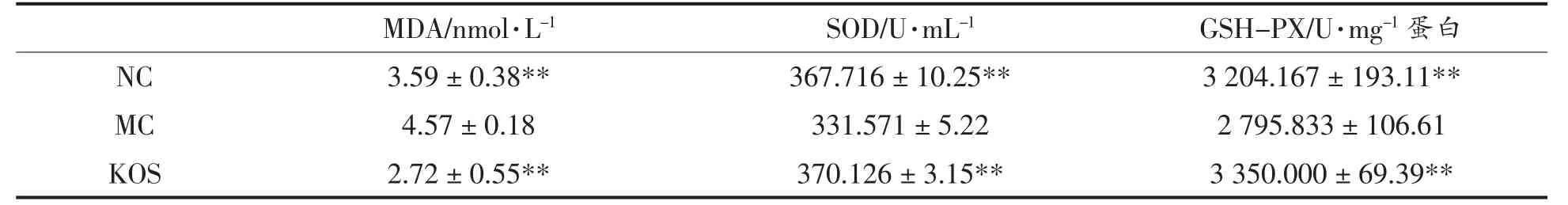
表3 KOS 对氧化应激的影响Table 3 The effect of KOS on the oxidative stress

图3 KOS 对肝重和肝脏指数的影响Fig.3 The effect of KOS on the liver weight and liver index
2.5 KOS 对肥胖大鼠肝脏脂质代谢相关酶活力的影响
如表4所示,MC 组 与NC组相比,AST 和ALT 活力均显著性提高, 分别是27.74%(P<0.05)和51.75%(P<0.01)。 经KOS 干预后,与MC 组相比,AST 和ALT 活力均显著性降低, 分别降低了16.1%(P<0.05)和29.1%(P<0.01)。 此外,MC 组AKP 活力高于NC 组,但差异不显著,而KOS 组AKP 活力与MC 组相近,但有降低趋势。
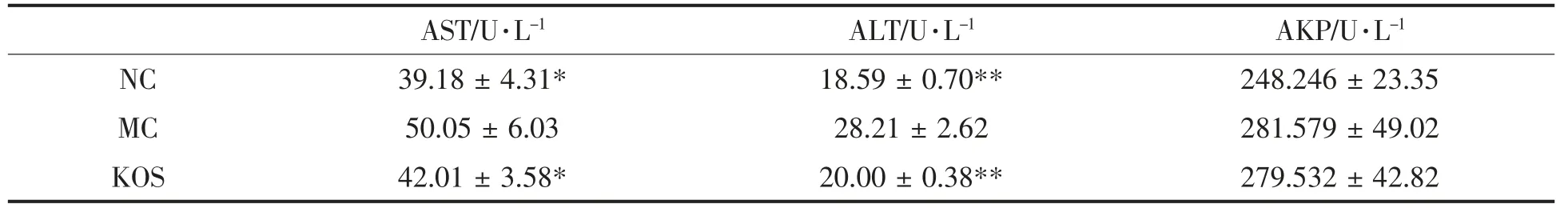
表4 肝脏脂质代谢相关酶活力的变化Table 4 Changes in activity of hepatic lipid metabolism enzymes
2.6 KOS 对肥胖大鼠肝组织的影响
图4 为大鼠肝组织切片HE 染色结果, 可以看出,NC 组(见图4a)大鼠肝组织结构正常,排列整齐,细胞中央有大而圆的细胞核且细胞质均匀;MC 组(见图4c)大鼠肝细胞肿胀,细胞内脂滴增多、体积增大且排列紊乱,胞质疏松,肝细胞内可见严重的脂肪空泡,且细胞核偏位;KOS 组(见图4b)大鼠肝细胞体积较MC 组大鼠减小,细胞内脂滴减少,肝细胞脂肪变性的程度减轻。
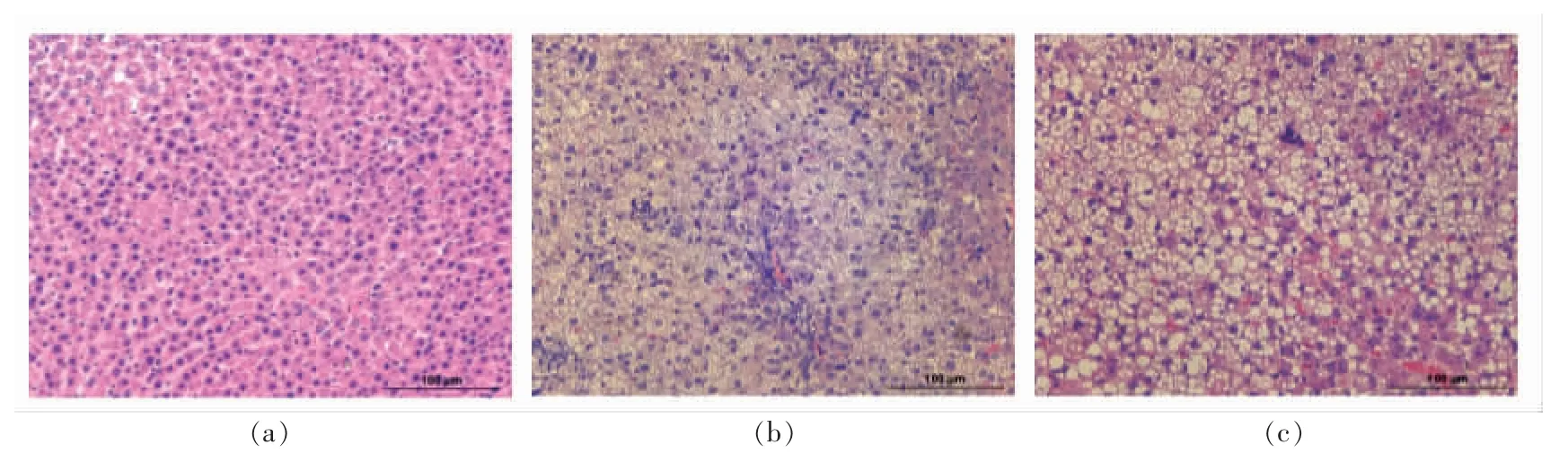
图4 KOS 对肝组织的影响Fig.4 The effect of KOS on the liver
3 结论
久坐的生活方式, 体力劳动的减少以及高能量密度食物的摄入过多等因素, 使得肥胖症成为危害人类健康的主要问题之一[18-19]。 此外,肥胖还会引发一系列的并发症。 作为一个严重的公共健康问题, 肥胖已引起世界范围的关注。 KOS 作为KGM 的降解产物, 除具有KGM 较好的生理功能外,还具有良好的理化特性和独特的功能活性。本研究观察了KOS 对肥胖大鼠体重、 血脂组成、氧化应激、肝重、肝脏指数、肝脏脂质代谢相关酶以及肝组织形态的干预效果, 并探讨了其在调节肥胖大鼠高脂血症及肝损伤中可能的机制。
经KOS 连续6 周的干预,大鼠体重、血脂组成、 氧化应激及肝功能相关指标均发生了一定的变化。与MC 组相比,KOS 干预能够显著减缓高脂饮食诱导的肥胖大鼠体重的增加(P<0.01),说明KOS 对高脂饮食诱导的肥胖有较好的保护作用。与NC 组相比, 高脂饮食引起了更高的血清TG、TC、LDL-C 水平(P<0.01),降低了血清HDL-C 水平,说明肥胖会引起明显的大鼠脂质代谢紊乱。而KOS 可以显著降低血清TG、TC 和LDL-C 水平(P<0.01),同时升高HDL-C 水平,表明KOS 对肥胖大鼠的高脂血症有明显的调控效果。
氧化应激是细胞和组织内氧化与抗氧化系统间失去平衡,表现为氧化的一种状态[20-21]。MDA 的量可反映机体内脂质过氧化的程度, 间接反映出细胞损伤的程度[22]。 而SOD 和GSH-Px 则间接地反映了机体抗氧化与清除自由基的能力[23-24]。结果显示, 与NC 组相比,MC 组MDA 水平显著提高(P<0.01),同时SOD 和GSH-Px 水平显著降低(P<0.01)。 这表明摄入高热量的高脂肪食物能够加速大鼠的能量代谢, 加快葡萄糖氧化使得氧化产物过多生成,而与抗氧化能力相比,这些产物的氧化能力更强,因此会导致机体的氧化应激反应,这与之前的报道一致[25]。而KOS 组MDA 水平比NC 组低24.23%,SOD 和GSH-Px 水平也高于NC 组,表明KOS 可显著提高机体清除氧自由基和脂质过氧化物的能力,降低氧化损伤程度,这与之前报道的KOS 具有较强的抗氧化性一致[22]。
已有许多研究将肝脏指数作为评价肝脏损伤程度的一个指标[26-28]。结果显示,与NC 组相比,MC组肝重和肝脏指数均显著增加(P<0.01),而KOS干预可以降低肝重和肝脏指数,表明KOS 可以降低肥胖引起的肝脏损伤。 此外,血清ALT、AST 水平的高低可以反映肝细胞的损伤程度[29-30]。 与NC组相比,MC 组血清ALT、AST 水平显著升高,说明高脂饮食会破环细胞膜结构, 诱发大鼠肝细胞损伤。与MC 组相比,KOS 干预显著降低了血清ALT(P<0.01)、AST(P<0.05)水平。 与此同时,通过肝组织切片观察可以看到,与MC 组相比,KOS 组肝细胞脂肪变性的程度减轻,说明KOS 可以显著减轻高脂饮食诱发的大鼠肝损伤。
综上所述,高热量、高脂肪食物的长期摄入会诱发肥胖,引起脂质代谢紊乱,降低机体抗氧化能力,对肝脏产生严重的损伤。通过使用酶解鲜魔芋制备KOS,添加5%到高脂饲料中进行干预可控制肥胖大鼠体重,有效改善脂质代谢紊乱,提高氧化应激能力,降低脂质代谢相关酶的活力,减轻高脂血症症状,对抗肥胖引起的肝脏损伤。
