紫苏醇亚微乳剂对人乳腺癌细胞MDA-MB-435s的增殖抑制作用研究
2020-07-07华海婴
刘 琳,华海婴
(1.郑州大学附属郑州中心医院药学部,河南 郑州 450007;2.郑州大学医药科学研究院,河南 郑州 450002)
紫苏醇[(S)-(-)-perillyl alcohol,POH]是一种具有防治肿瘤作用的单萜类物质,同时具有广谱、高效和低毒等优点[1]。国内报道其药理作用主要为解热、抗菌、和血、止痛和定喘等;国外报道其对乳腺癌、直肠癌和皮肤癌都有一定的疗效,并且处于临床研究阶段,但紫苏醇口服胶囊制剂Ⅱ期临床试验结果表明其有较大的胃肠刺激性,已有患者口服后因无法耐受而退出临床研究。本课题前期已完成了静脉注射用紫苏醇亚微乳剂(perillyl alcohol of submicron emulsion,POH-SE)处方和工艺的优化及其含量测定的研究[2];POH-SE相分布和体外释放研究结果表明该亚微乳有缓释作用[3]。目前已有POH-SE在大鼠体内的组织分布研究[4],但尚未见紫苏醇壳聚糖亚微乳剂(perillyl alcohol of chitosan submicron emulsion,POH-CSSE)和POH-SE对人乳腺癌MDA-MB-435s的研究报道。紫苏醇溶液(perillyl alcohol,POH-SOL)是一定浓度的紫苏醇溶解于乙醇溶液制成;POH-SE是紫苏醇制成的乳剂;POH-CSSE在上述基础中加入壳聚糖,以期提高紫苏醇的靶向性。本研究主要探讨POH-CSSE和POH-SE对人乳腺癌MDA-MB-435s细胞株体外抗肿瘤作用、细胞生长抑制作用及其可能机制。
1 材料与方法
1.1 材料
1.1.1 仪器:CO2培养箱(美国Forma公司);倒置生物显微镜(日本Olympus公司);双人单面净化工作台(苏州净化设备有限公司);DG-302型酶标仪(美国BIO RAD 公司);水平振荡器(德国Biometra公司);96孔培养板(美国Corning公司);EPICS XL型流式细胞仪(Becton Dickinson);超低温冰箱(日本Sanyo Medical Freezer)。
1.1.2 药品与试剂:DMEM培养基(海克隆生物化学制品有限公司),小牛血清(杭州四季青生物工程材料有限公司),TUNEL染色试剂盒(武汉博士德公司)二甲基亚砜(DMSO,北京化工厂),四甲基偶氮唑盐(MTT,Amresco公司进口分装),PBS磷酸盐缓冲液(北京中杉金桥生物技术有限公司),POH-SE(自制,批号为20070802,规格为12.5 mg/ml),POH-CSSE(自制,批号为20070803,规格为12.5 mg/ml),POH-SOL(自制,批号为20070822,规格为12.5 mg/ml),其余试剂均为国产分析纯。
1.1.3 瘤株:MDA-MB-435s细胞株(河南省动物实验中心肿瘤室提供)。
1.2 方法
1.2.1 细胞培养:所有实验操作均在无菌环境下进行。MDA-MB-435s细胞株常规培养于37 ℃,5%CO2,饱和湿度环境的恒温孵育箱中,培养期间每2~3 d更换1次培养液,并每日于倒置显微镜下观察细胞形态变化及生长增殖情况,当细胞覆盖率达80%~90%时,以0.25%胰蛋白酶消化后传代。实验所用细胞均处于指数生长期。细胞计数方法为吸取混匀的细胞悬液用PBS稀释10倍后镜下计数,计算出细胞浓度,供实验用。
1.2.2 分组:空白对照组(无紫苏醇);POH-SOL、POH-SE和POH-CSSE组,使其终浓度分别为50、100、200、400、600及800 μmol/L,共18个亚组,每组设4个复孔。
1.3 指标测定
1.3.1 细胞形态观察及鉴定:细胞培养培养72 h后,用倒置显微镜观察细胞形态。
1.3.2 细胞生长曲线及抑制率的测定:根据相关研究方法[5-7]稍作改进,即取对数生长期的乳腺癌细胞株MDA-MB-435s,以0.25%胰蛋自酶消化,用含10%小牛血清的DMEM培养液稀释成1×105/ml浓度的单细胞悬液。将细胞悬液接种于96孔板,每孔100 μl,共6组,每组4个复孔,5%CO2培养箱中,37 ℃培养过夜。24 h后,6个药物处理组为含不同药物浓度的培养液,空白对照组和POH-SOL组加相同容积的培养液,每孔200 μl,分别培养24、36、48、72及96 h后,每孔加MTT溶液(5 g/L)20 μl(空白对照组除外),继续孵育4 h。小心移去培养液,蓝色的甲瓒晶体溶解在100 μl的二甲基亚砜中,摇匀后,在波长570 nm处记录每孔的吸光度,绘制细胞生长抑制曲线,计算药组肿瘤细胞抑制率和半抑制浓度(IC50)。
1.3.3 原位末端标记法(TUNEL):检测细胞凋亡,按照试剂盒操作方法处理细胞,封片后,显微镜下观察,细胞核中有棕黄色颗粒者为阳性细胞,即凋亡的细胞。随机计数200个细胞,计算凋亡率,凋亡率=(阳性细胞数/200)×100%。
1.3.4 流式细胞仪检测细胞周期:POH作用48 h后,收集不同浓度POH-CSSE、POH-SE组的MDA-MB-435s细胞悬液,1 000 r/min离心5 min,弃上清液用PBS洗涤1次,细胞沉淀用预冷的70%乙醇在-20 ℃固定过夜;取固定后的细胞用PBS洗涤2次并悬浮之,加入终浓度为50 mg/L的核糖核酸酶A 36 ℃水浴30 min,再加入碘化丙啶染液800 μl至终浓度为50 mg/L,摇匀后4 ℃避光静置30 min,200目尼龙网过滤。使用EPICS XL型流式细胞仪进行细胞周期分析及凋亡分析,低于G1期DNA含量细胞为凋亡细胞。
1.4 统计学方法
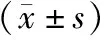
2 结果
2.1 细胞形态观察及鉴定
正常MDA-MB-435s细胞呈梭形及不规则形,见图1(A)。加入POH-SOL、POH-SE和POH-CSSE培养72 h后,细胞为单个散在分布,形态学改变为染色质固缩但境界分明,胞浆浓缩,细胞外形皱折。POH-SE组、POH-CSSE组细胞呈片状或块状形态、细胞肿胀破裂及细胞器结构破坏;表明POH-SOL处理后细胞有较轻微的调亡,POH-SE处理后细胞有明显的调亡,POH-CSSE处理后细胞的调亡最为明显,见图1(B、C、D)。
A.空白对照组;B.POH-SOL组;C.POH-SE组;D.POH-CSSE组
2.2 体外抗肿瘤活性
96 h后,不同浓度的POH-SOL、POH-SE和POH-CSSE对MDA-MB-435s细胞增殖的抑制作用见图2。结果表明,POH-SE和POH-CSSE抑制细胞增殖作用明显高于POH-SOL,差异有统计学意义(P<0.01)。随作用时间延长,相同药物浓度(800 μmol/L)POH-SE和POH-CSSE的细胞增殖抑制作用均明显高于POH-SOL溶液,差异均有统计学意义(P<0.01),见图3;且POH-CSSE比POH-SE有更好的抑制作用。
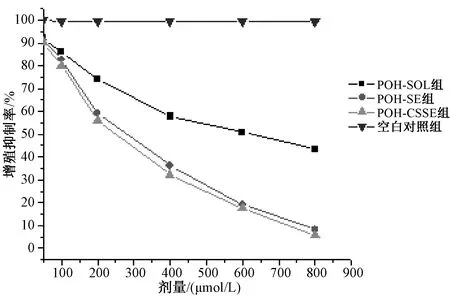
图2 POH-SE和POH-CSSE的剂量抑制曲线图
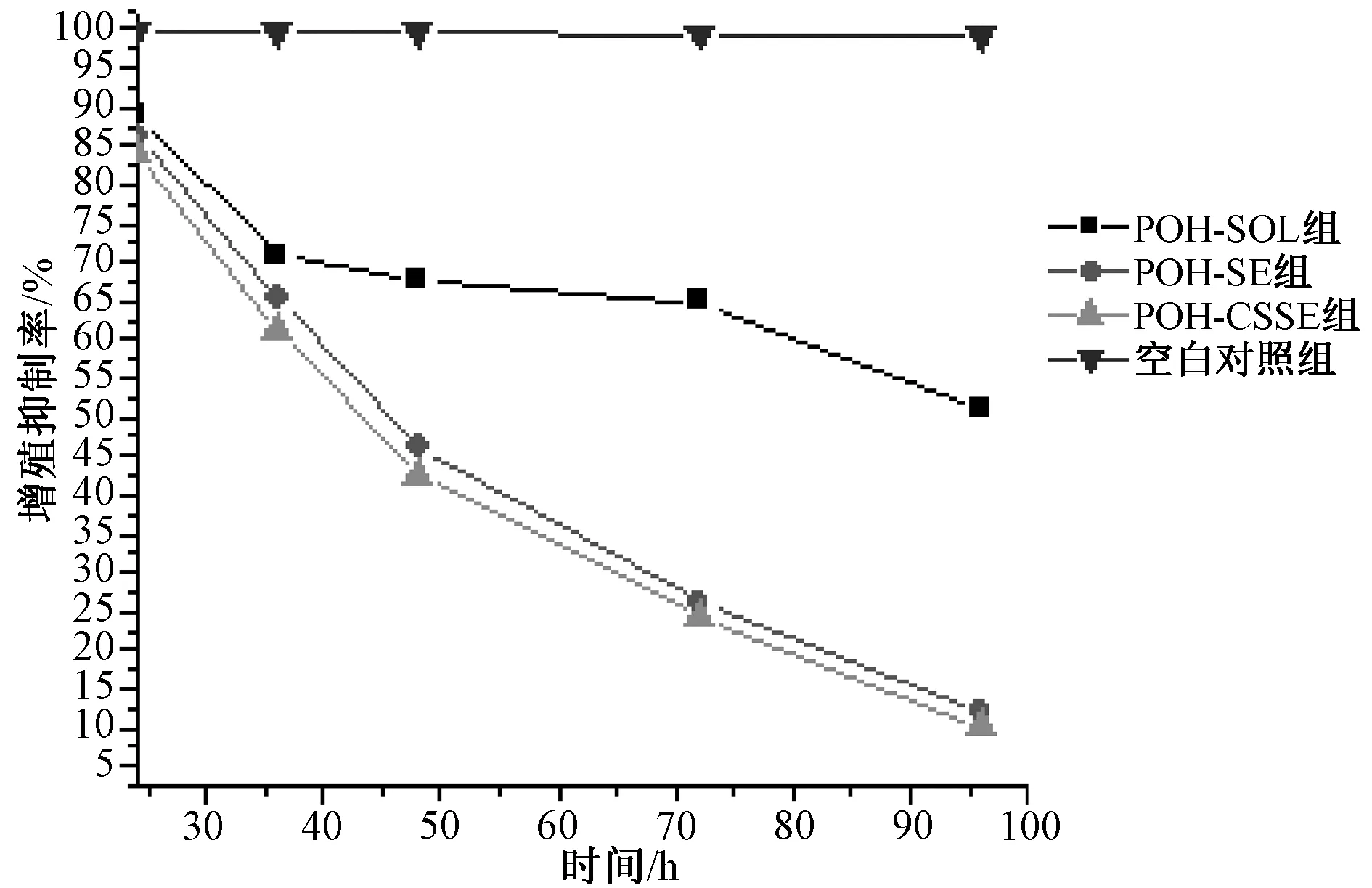
图3 POH-SE和POH-CSSE的时间抑制曲线图
结果表明,药物的增殖抑制作用呈现出剂量和时间相关性,即随着药物作用时间的延长和浓度的提高,细胞毒性增加。相同条件下,POH-SE和POH-CSSE抑制肿瘤细胞增殖作用显著强于POH-SOL。药物浓度为400 μmol/L时,POH-SE和POH-CSSE组肿瘤细胞存活率分别为36.18%、32.06%;而POH-SOL对肿瘤细胞影响较小(肿瘤细胞存活率为57.84%)。药物浓度为800 μmol/L时,POH-SE和POH-CSSE组细胞存活率仅为8.26%、5.62%,POH-SOL组仍有43.57%的细胞存活。相同药物浓度时,24 h内无明显的差别;随着孵育时间延长,抑制率由高至低依次为POH-CSSE>POH-SE>POH-SOL;96 h时,POH-SE和POH-CSSE组仅有少量的细胞存活,而POH-SOL组仍有43.57%的细胞存活。POH-SOL、POH-SE和POH-CSSE的IC50分别为1236.3、528.43和418.83 μmol/L。
2.3 TUNEL法检测MDA-MB-435s细胞凋亡
通过TUNEL法检测不同浓度POH-CSSE和POH-SE诱导人乳腺癌MDA-MB-435s细胞凋亡的情况,计算细胞凋亡率,结果见表1。不同浓度POH-CSSE和POH-SE均能诱导人乳腺癌MDA-MB-435s细胞凋亡,其中POH-CSSE 200、400及800 μmol/L组的凋亡率分别为40.29%、52.24%及70.25%,与POH-SE组相比,差异有统计学意义(P<0.01)。
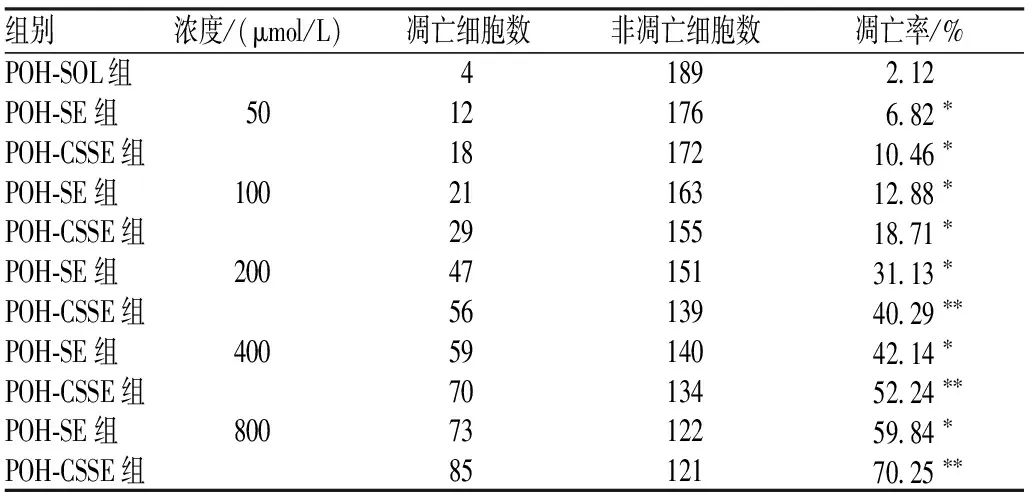
表1 POH-SE和POH-CSSE对人乳腺癌MDA-MB-435s细胞凋亡作用TUNEL检测结果
注:与POH-SOL组比较,*P<0.05;与POH-SE组比较,**P<0.01
Note:vs.POH-SOL group,*P<0.05; vs.POH-SE group,**P<0.01
2.4 流式细胞仪定量分析细胞凋亡与生长周期
人乳腺癌MDA-MB-435s细胞经POH-CSSE和POH-SE不同浓度处理48 h后,流式细胞仪检测结果显示,在G1期峰前出现1个亚二倍体峰,说明不同浓度POH-CSSE和POH-SE能引起MDA-MB-435s细胞的凋亡,其中POH-CSSE和POH-SE 800 μmol/L组的细胞凋亡率为47.62%和58.33%,POH-SOL组相比,差异有统计学意义(P<0.05);同时,POH-CSSE和POH-SE 800 μmol/L有效影响了细胞MDA-MB-435s的生长周期分布,G0/G1期的MDA-MB-435s细胞占比最高达到86.12%和75.16%,与POH-SOL组相比,MDA-MB-435s细胞G0/G1期的细胞明显增多,而S期和G2/M期细胞数目减少,即POH-CSSE和POH-SE使MDA-MB-435s细胞生长阻滞在G0/G1期,从而诱导细胞凋亡发生,见表2。

表2 流式细胞术检测POH-SE和POH-CSSE对MDA-MB-435s细胞周期分布的影响
注:与POH-SOL组比较,*P<0.05;与POH-SE组比较,**P<0.01
Note:vs.POH-SOL group,*P<0.05; vs.POH-SE group,**P<0.01
3 讨论
POH-SE和POH-CSSE对MDA-MB-435s细胞体外的增殖抑制活性有明显的时间和剂量依赖性,且在50~1 000 μmol/L范围内增殖抑制作用有明显的量效关系。POH-CSSE对MDA-MB-435s细胞比POH-SE有更强的抑制作用,是因为经修饰后的壳聚糖阳离子乳剂表面带有更多的正电荷,当与细胞接触后能很快与细胞表面的阴离子电荷吸附,延长了药物的作用时间,抑制率明显升高。
紫苏醇作为抗肿瘤药受到了广泛关注和研究,目前认为其抗肿瘤活性可能来自代谢产物紫苏酸和脱水紫苏酸,其抑制肿瘤的机制也是多样的。本研究结果显示,不同浓度的POH-CSSE和POH-SE对人乳腺癌MDA-MB-435s细胞的增殖有明显的抑制作用,且随剂量的增加其抑制作用增强,最大抑制率可达到75.23%;同时,POH-CSSE和POH-SE能改变MDA-MB-435s细胞的生长周期,POH-CSSE和POH-SE使MDA-MB-435s细胞生长阻滞在G0/G1期。Clark等[8]研究结果发现,POH能选择性地终止Bcr/ab恶性转化的髓系细胞有丝分裂周期,从而达到抑制肿瘤生长和转移的作用,认为这可能是POH抗肿瘤的机制之一。POH-CSSE比POH-SE对人乳腺癌细胞MDA-MB-435s抑制更强的原因如下,壳聚糖可能提高了亚微乳剂的靶向性;同时由于POH-CSSE在处方中加入壳聚糖,可以达到缓释效果;还可以提高肿瘤主动靶向性。而在细胞生长周期的方面,POH-SE对乳腺癌细胞有明显的抑制作用,且随着其浓度的增加,抑制率逐渐升高,呈现明显的剂量和时间依赖性,这可能与亚微乳的缓释作用有关。本研究结果发现,不同浓度POH-CSSE和POH-SE能诱导人乳腺癌MDA-MB-435s细胞凋亡,且呈一定的剂量/效应关系。
综上所述,本研究验证了POH-CSSE和POH-SE对人乳腺癌MDA-MB-435s细胞潜在的治疗价值,有必要进行更深入的体内药效学研究和分子机制探讨。
