奥氮平通过PI3K/Akt通路对精神分裂症模型大鼠发挥神经保护作用的研究Δ
2020-07-07刘传朋邱炳杰丁银霞崔明湖
钟 鸣,刘传朋,邱炳杰,丁银霞,崔明湖
(1.滨州市优抚医院精神科,山东 滨州 256606;2.滨州市人民医院精神卫生中心,山东 滨州 256601;3.滨州医学院临床医学院,山东 滨州 256603)
奥氮平是一种非典型抗精神病药,在临床中用于治疗精神分裂症,可有效改善患者认知功能,提高患者生活质量,对阳性及阴性症状均有较好疗效,但其药理机制目前还不清楚[1-3]。精神分裂症病理机制复杂,小胶质细胞活化,释放炎症因子,引起神经炎症反应,造成神经损伤[4]。磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)通路介导神经炎症反应等多种机体炎症反应,二甲双胍可通过激活PI3K/Akt信号抑制脑部神经炎症,减轻脓毒症引起的脑损伤,发挥神经保护作用[5];另外,精神分裂症患者大脑中Akt磷酸化减弱,提高Akt磷酸化水平可减轻患者的临床症状[6]。表明PI3K/Akt通路在精神分裂症的治疗中具有关键的作用,而奥氮平可激活PI3K/AKT信号,阻止Aβ淀粉样蛋白25-35导致的PC12细胞损伤[7]。因此,推测奥氮平可能通过激活PI3K/Akt通路对精神分裂症模型大鼠发挥神经保护作用。本研究通过建立精神分裂症大鼠模型,对此进行探讨,现报告如下。
1 材料与方法
1.1 实验动物
SD大鼠,SPF清洁级,雄性,体重(220±20)g,购自山东大学实验动物中心,动物生产许可证号为SCXK(粤)2018-0001,动物使用许可证号为SYXK(粤)2018-0011,动物质量合格证号为44007200021086。所有大鼠在滨州医学院实验动物房中饲养,12 h/12 h间断照明,保持温度为(24±1)℃,相对湿度为(55±5)%,饲养环境清洁、安静并通风良好,大鼠自由进食、饮水,定期添加饲料、饮用水且更换垫料。
1.2 仪器
XR-XC105型Morris水迷宫视频分析系统(上海欣软信息科技有限公司);SMZ745型光学显微镜(日本尼康公司);EG1160型包埋机、HI1220型烤片机及CM3050S型切片机(德国Leica公司);Centrifuge 5424R型低温高速离心机(德国Eppendorf股份公司);XElx800型酶标仪(美国Perkin Elmer公司);1659001型蛋白电泳仪、Trans-Blot Turbo型转膜仪(美国Bio-Rad公司);GIS-500型凝胶成像仪(Miulab公司)等。
1.3 药品与试剂
奥氮平(江苏豪森药业股份有限公司,片剂,规格为10 mg,批号为190714);地卓西平马来酸盐(MK-801,美国Sigma公司,批号为022M4616V);LY294002(美国MCE公司,批号为HY-10108);大鼠白细胞介素6(IL-6)和肿瘤坏死因子α(TNF-α)酶联免疫吸附试剂盒、兔源甘油醛-3-磷酸脱氢酶(GAPDH)、PI3K、p-PI3K、AKT、p-AKT一抗及羊抗兔二抗(美国Abcam公司,批号分别为ab100772、ab100785、ab181602、ab151549、ab138364、ab179463、ab38449及ab150077);RIPA裂解液、BCA蛋白浓度测定试剂盒、苏木精-伊红(hematine-eosine,HE)染色试剂盒及PVDF膜(上海碧云天公司,批号分别为P0013K、P0011、C0105及SF1327)等。
1.4 方法
1.4.1 动物模型制备及分组给药:(1)腹腔注射MK-801 0.6 mg/kg诱发大鼠精神分裂症,3 d后观察大鼠,对其刻板行为评分、共济失调进行评分,若评分显著升高,HE染色显示海马组织出现神经元细胞数量减少,排列稀疏,细胞核固缩,胞质、核仁结构不清晰,染色深,细胞出现凋亡、坏死等病理损伤,表示模型建立成功[8]。刻板行为评分、共济失调评分标准[9]如下。①刻板行为评分标准,静止不动,几乎或根本没有活动为0分;正常活动,偶尔有向前的运动为1分;活动伴随反复向前探索为2分;连续向前探索为3分;重复抬头、摇头或旋转为4分;快速摇头、转圈或头的背腹运动为5分。②共济失调评分标准,协调运动为0分;轻度摇晃,摇摆运动,竖立而不倒为1分;中度不协调运动,偶尔会频繁跌倒为2分;无力支撑体重,爬行运动为3分;没有运动,躺向一边或腹侧为4分。(2)55只大鼠参与制备模型,成功48只,随机分为模型组、LY294002组、奥氮平组及奥氮平+LY294002组,每组12只;另取12只大鼠腹腔注射等剂量0.9%氯化钠注射液,设为对照组。奥氮平组大鼠将奥氮平以0.5 mg/kg剂量[10]灌胃;LY294002组大鼠将LY294002以0.3 mg/kg剂量[11]尾静脉注射;奥氮平+LY294002组大鼠将奥氮平以0.5 mg/kg剂量灌胃,LY294002以0.3 mg/kg剂量尾静脉注射;对照组、模型组大鼠以等剂量0.9%氯化钠注射液灌胃并尾静脉注射同剂量0.9%氯化钠注射液;1日1次,持续21 d。
1.4.2 大鼠刻板行为及共济失调检测:给药结束24 h后,参照“1.4.1”中评分标准对各组大鼠刻板行为及共济失调进行评分。
1.4.3 大鼠认知功能检测:刻板行为及共济失调检测结束后,进行Morris水迷宫实验。将直径160 cm、高50 cm的Morris水迷宫水池分为4个象限,分别于每个象限水池壁正中固定4个不同标记作为参照,向水池中注水至水深22 cm,水温保持25 ℃左右,将一个直径12 cm、高20 cm的平台置于第三象限正中。实验开始前对大鼠进行适应训练1 d,前5 d进行定位航行实验,将大鼠面朝池壁分别由第一到第四象限放入水池中,记录大鼠找到平台所用时间,即为平均逃避潜伏期,取5 d的平均值;第6日进行空间探索实验,撤去平台,以同样方法将大鼠放入水池中,检测其在1 min内穿越平台原位置次数,取平均值;以平均逃避潜伏期及穿越原平台位置次数作为评定大鼠认知功能的指标。
1.4.4 大鼠海马组织神经元病理变化检测及标本采集:认知功能检测结束后,于大鼠尾静脉取血2 ml,静置、离心后收集血清储存在-80 ℃冰箱中备用。然后对大鼠进行麻醉、处死,解剖分离大脑,剪取约0.5 g脑组织,加入蛋白裂解液,制备为匀浆液,4 ℃离心,收集上清液储存在-80 ℃冰箱中备用;剩余组织以0.9%氯化钠注射液漂洗干净,经4%多聚甲醛固定、低浓度到高浓度梯度酒精脱水、二甲苯透明和石蜡包埋后,以切片机做病理切片,选取完好切片经脱蜡处理后,采用梯度酒精(由高浓度到低浓度)浸泡,参照试剂盒说明书步骤进行HE染色,然后再次脱水、透明,最后封片,采用光学显微镜观察脑部海马组织神经元病理变化,任选5个视野拍照。
1.4.5 大鼠血清IL-6、TNF-α水平检测:取“1.4.4”中的血清置于4 ℃冰箱中冻融,参照酶联免疫吸附试剂盒说明书的步骤检测其中IL-6、TNF-α水平。
1.4.6 大鼠脑组织PI3K/Akt通路蛋白表达检测:取“1.4.4”中蛋白上清液于4 ℃冰箱中冻融后,参照BCA蛋白浓度测定试剂盒说明书步骤测定其蛋白总浓度,煮沸变性后,各组取相同质量总蛋白的样品液进行电泳,分离蛋白后将其转移至PVDF膜上,置于5%脱脂奶粉中,室温(25 ℃)封闭2 h,然后加入兔源GAPDH、PI3K、p-PI3K、AKT及p-AKT一抗(均为1∶1 000稀释),4 ℃孵育过夜,以TBST溶液漂洗后,加入羊抗兔二抗(1∶2 000稀释),室温孵育2 h,以TBST溶液再次漂洗后,以增强化学发光法显色,将蛋白条带置于凝胶成像仪中拍照,并以软件Quantity One分析各组蛋白相对表达。
1.5 统计学方法
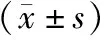
2 结果
2.1 五组大鼠刻板行为评分、共济失调情况比较
与对照组相比,模型组大鼠刻板行为评分、共济失调评分明显升高;与模型组相比,LY294002组大鼠刻板行为评分、共济失调评分明显升高,奥氮平组大鼠刻板行为评分、共济失调评分明显降低;与LY294002组相比,奥氮平+LY294002组大鼠刻板行为评分、共济失调评分明显降低;与奥氮平组相比,奥氮平+LY294002组大鼠刻板行为评分、共济失调评分明显升高,上述差异均有统计学意义(P<0.05),见表1。

表1 五组大鼠刻板行为评分、共济失调评分比较分)
注:与对照组相比,aP<0.05;与模型组相比,bP<0.05;与LY294002组相比,cP<0.05;与奥氮平组相比,dP<0.05
Note: vs.control group,aP<0.05; vs.model group,bP<0.05; vs.LY294002 group,cP<0.05; vs.olanzapine group,dP<0.05
2.2 五组大鼠海马组织病理损伤变化
对照组大鼠海马组织神经元细胞形态完好,排列整齐、有序,细胞核圆而大,胞质、核仁清晰,染色浅,无病理损伤;模型组大鼠海马组织呈现神经元细胞数量减少,排列稀疏,细胞核固缩,胞质、核仁结构不清晰,染色深,细胞出现凋亡、坏死等病理损伤;LY294002组大鼠海马组织神经元病理损伤加重;奥氮平组大鼠海马组织神经元病理损伤减轻;奥氮平+LY294002组大鼠海马组织神经元病理损伤比LY294002组减轻,但比奥氮平组加重,见图1。

A.对照组;B.模型组;C.LY294002组;D.奥氮平组;E.奥氮平+LY294002组
2.3 五组大鼠认知功能比较
与对照组相比,模型组大鼠水迷宫实验平均逃避潜伏期明显延长,穿越原平台位置次数明显减少;与模型组相比,LY294002组大鼠水迷宫实验平均逃避潜伏期明显延长,穿越原平台位置次数明显减少;与模型组相比,奥氮平组大鼠水迷宫实验平均逃避潜伏期明显缩短,穿越原平台位置次数明显增加;与LY294002组相比,奥氮平+LY294002组大鼠水迷宫实验平均逃避潜伏期明显缩短,穿越原平台位置次数明显增加;与奥氮平组相比,奥氮平+LY294002组大鼠水迷宫实验平均逃避潜伏期明显延长,穿越原平台位置次数明显减少,上述差异均有统计学意义(P<0.05),见表2。
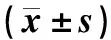
表2 五组大鼠平均逃避潜伏期、穿越原平台位置次数比较
注:与对照组相比,aP<0.05;与模型组相比,bP<0.05;与LY294002组相比,cP<0.05;与奥氮平组相比,dP<0.05
Note: vs.control group,aP<0.05; vs.model group,bP<0.05; vs.LY294002 group,cP<0.05; vs.olanzapine group,dP<0.05
2.4 五组大鼠血清IL-6、TNF-α水平比较
与对照组相比,模型组大鼠血清IL-6、TNF-α水平明显升高;与模型组相比,LY294002组大鼠血清IL-6、TNF-α水平明显升高,奥氮平组大鼠血清IL-6、TNF-α水平明显降低;与LY294002组相比,奥氮平+LY294002组大鼠血清IL-6、TNF-α水平明显降低;与奥氮平组相比,奥氮平+LY294002组大鼠血清IL-6、TNF-α水平明显升高,上述差异均有统计学意义(P<0.05),见表3。

表3 五组大鼠血清IL-6、TNF-α水平
注:与对照组相比,aP<0.05;与模型组相比,bP<0.05;与LY294002组相比,cP<0.05;与奥氮平组相比,dP<0.05
Note: vs.control group,aP<0.05; vs.model group,bP<0.05; vs.LY294002 group,cP<0.05; vs.olanzapine group,dP<0.05
2.5 五组大鼠脑组织PI3K/Akt通路蛋白表达比较
与对照组相比,模型组大鼠脑组织中p-PI3K/PI3K、p-Akt/Akt表达明显降低;与模型组相比,LY294002组大鼠脑组织中p-PI3K/PI3K、p-Akt/Akt表达明显降低,奥氮平组大鼠脑组织中p-PI3K/PI3K、p-Akt/Akt表达明显升高;与LY294002组相比,奥氮平+LY294002组大鼠脑组织中p-PI3K/PI3K、p-Akt/Akt表达明显升高;与奥氮平组相比,奥氮平+LY294002组大鼠脑组织中p-PI3K/PI3K、p-Akt/Akt表达明显降低,上述差异均有统计学意义(P<0.05),见图2、表4。

A.对照组;B.模型组;C.LY294002组;D.奥氮平组;E.奥氮平+LY294002组
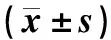
表4 五组大鼠脑组织PI3K/Akt通路蛋白相对表达
注:与对照组相比,aP<0.05;与模型组相比,bP<0.05;与LY294002组相比,cP<0.05;与奥氮平组相比,dP<0.05
Note: vs.control group,aP<0.05; vs.model group,bP<0.05; vs.LY294002 group,cP<0.05; vs.olanzapine group,dP<0.05
3 讨论
近年来,随着社会发展,精神分裂症的发病率逐年升高,其防治已成为临床亟需解决的问题[12]。MK-801作为典型非竞争性N-甲基-D-天冬氨酸受体阻断剂,在临床及基础研究中常用来诱导构建精神分裂症模型[13]。本研究以MK-801处理SD大鼠,结果显示,大鼠海马组织神经元细胞数量减少,排列稀疏,细胞核固缩,胞质、核仁结构不清晰,染色深,细胞出现凋亡、坏死等病理变化,刻板行为及共济失调评分显著升高,表明MK-801导致大鼠海马组织神经损伤,使其出现刻板行为及共济失调。IL-6、TNF-α为促炎因子,可引起神经炎症,在精神分裂症病情发展中起到重要的作用[14]。以MK-801处理大鼠可显著升高其血清IL-6及TNF-α水平,且水迷宫实验结果显示,大鼠平均逃避潜伏期显著延长,穿越原平台位置次数显著减少,表明MK-801可诱导大鼠神经炎症,损伤其认知功能,揭示模型建立成功。
奥氮平是临床常用的抗精神病药,作为一种多巴胺受体拮抗剂,其可与5-羟色胺、多巴胺及胆碱能等多种受体结合产生拮抗作用,阻滞神经冲动的传导,可改善精神分裂症患者认知功能损伤及精神障碍,具有明显的治疗效果[15-16]。但目前其药理机制并未完全阐明。研究结果显示,氧化应激及神经炎症在精神分裂症的发生发展中起关键作用[17]。PI3K/Akt通路可调控多种炎症反应,降低其磷酸化水平可明显诱发机体神经炎症、记忆缺陷及神经退行性病变等神经损伤[18];且PI3K、Akt蛋白因子介导精神分裂症的发病及病情进展,是诊断精神分裂症的可靠生物标记物,并可作为治疗该病的靶点[19]。在对骨髓间充质干细胞成脂分化的研究中,发现奥氮平可抑制PI3K/Akt通路磷酸化激活[20]。因而,推测奥氮平可能通过激活PI3K/Akt通路治疗精神分裂症,发挥神经保护作用。本研究结果显示,奥氮平治疗后,大鼠海马组织神经元病理损伤减轻,刻板行为评分、共济失调评分、血清IL-6和TNF-α水平降低,水迷宫实验平均逃避潜伏期缩短,穿越原平台位置次数增加,脑组织p-PI3K/PI3K及p-Akt/Akt表达升高,表明奥氮平可激活PI3K/Akt通路,修复模型大鼠认知功能,改善其临床症状。以奥氮平和LY294002联合处理模型大鼠,其海马组织神经元病理损伤相比LY294002组减轻,但相比奥氮平组加重;刻板行为评分、共济失调评分、血清IL-6及TNF-α水平相比LY294002组降低,但相比奥氮平组升高;水迷宫实验平均逃避潜伏期相比LY294002组缩短,但相比奥氮平组延长;穿越原平台位置次数相比LY294002组增加,但相比奥氮平组减少;脑组织p-PI3K/PI3K及p-Akt/Akt表达相比LY294002组升高,但相比奥氮平组降低,表明PI3K/Akt通路抑制剂可抑制奥氮平保护模型大鼠神经功能,修复其认知能力的作用,提示奥氮平可通过激活PI3K/Akt通路保护精神分裂症大鼠的神经功能。
综上所述,奥氮平可降低精神分裂症大鼠促炎因子合成分泌,抑制神经炎症反应,阻止海马神经元损伤、凋亡,缓解神经功能受损,修复认知功能,磷酸化激活PI3K/Akt通路是其药理机制之一。但本研究只进行了初步探讨,未对PI3K/Akt通路的下游进行研究,还存在不足,故关于奥氮平保护精神分裂症大鼠神经功能更为确切的分子机制有待后续的深入研究。
