乙酸乙酯的制备在教学实验中的研究进展和展望
2020-07-04王佳人赵放何文英
王佳人 赵放 何文英

摘 要:综述了近年来乙酸乙酯的制备在教学实验中的研究进展和展望。从酸催化酯化反应机理入手,阐释关于同位素示踪法的疑问。通过文献调研,探究不同加热方式、不同制备装置以及不同催化剂对乙酸乙酯制备实验的影响。通过调控催化剂的用量,并反复使用催化剂,观察其使用寿命,从而提高催化剂的经济效益。展望酯化反应催化剂的研究方向,催化剂未来将是酯化反应重点研究的领域。
关键词:乙酸乙酯;化学实验教学;绿色化学;催化剂;水浴加热
酯是有机合成中重要的化合物之一,而乙酸乙酯因其易制备等特点成为中学阶段有机合成课程中重要的酯化反应研究对象。目前,主要有4种方法制备乙酸乙酯,分别是乙酸酯化法、乙酸/乙烯加成法、乙醇脱氢法和乙醛缩合法,而我国进行生产时主要采用乙酸酯化法[1],在教学中也常采用乙酸酯化法。
在酯化反应中,由于腐蚀性酸和高温的存在,反应易产生较多副产物,进而影响课堂教学安全。对反应过程中的加热方式、反应装置和催化剂等条件进行研究将有利于优化乙酸乙酯制备实验的方法和步骤。因此,本研究综述了乙酸乙酯的制备在教学实验中的研究进展,阐述了加热方式、反应装置和催化剂对实验的影响,并展望了研究方向。
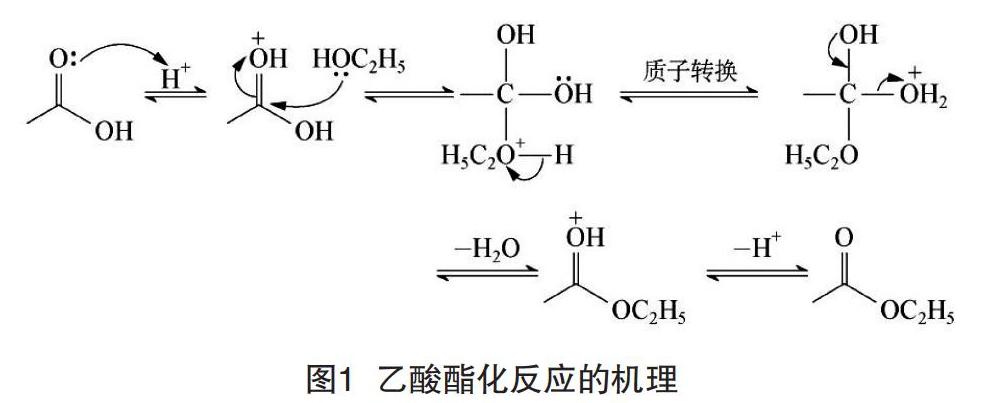
1 酯化反应机理
在反应过程中,质子酸作为催化剂先与羰基上的氧结合,而乙醇作为亲核试剂进攻乙酸的羰基并发生加成,在酸的作用下进一步脱水生成酯,一般认为酯化反应是可逆反应[2],反应机理如图1所示。
高中化学选修5《有机化学基础》[3]中提出,使用同位素示踪法来标记乙醇羟基中的氧原子,可以证实在酯化反应过程中,水是由乙酸分子的羟基与乙醇分子羟基中的氢原子结合而生成的,从理论上可证实上述操作可行。与此同时,还可使用H218O来标记验证[4],酸性水解的反应机理将得到标记物CH3CO18OH和CH3C18OOH,但如按此法来标记乙酸中的氧原子从而推导酯化反应机理是不切实际的。然而,在实际教学过程中,很多中学老师都用一个酯化反应的口诀来总结反应机理,即“酸脱羟基,醇脱氢”,但经过同位素示踪法分析易知,生成的水有两种,第一种可能来自乙酸分子羧基上的羟基,第二种可能来源于乙酸分子羰基通过吸引质子形成的新羟基。综上所述,有学者认为酯化反应的口诀应简记为“酸脱氢氧,醇脱氢”[5]更为合理和科学,但仍应该注意,化学知识相关口诀应在理解原理的基础上加以记忆,否则会影响学生化学思维的形成和辩证思维的发展。
2 实验教学中乙酸乙酯制备的研究现状
2.1 制备乙酸乙酯的加热方式及装置研究
在制备乙酸乙酯的反应过程中,给反应装置加热的用处[6]为:既可以提高反应速率,又可以及时将生成的乙酸乙酯蒸馏出去,提高反应物的转化率。
2.1.1 直接加热制备乙酸乙酯
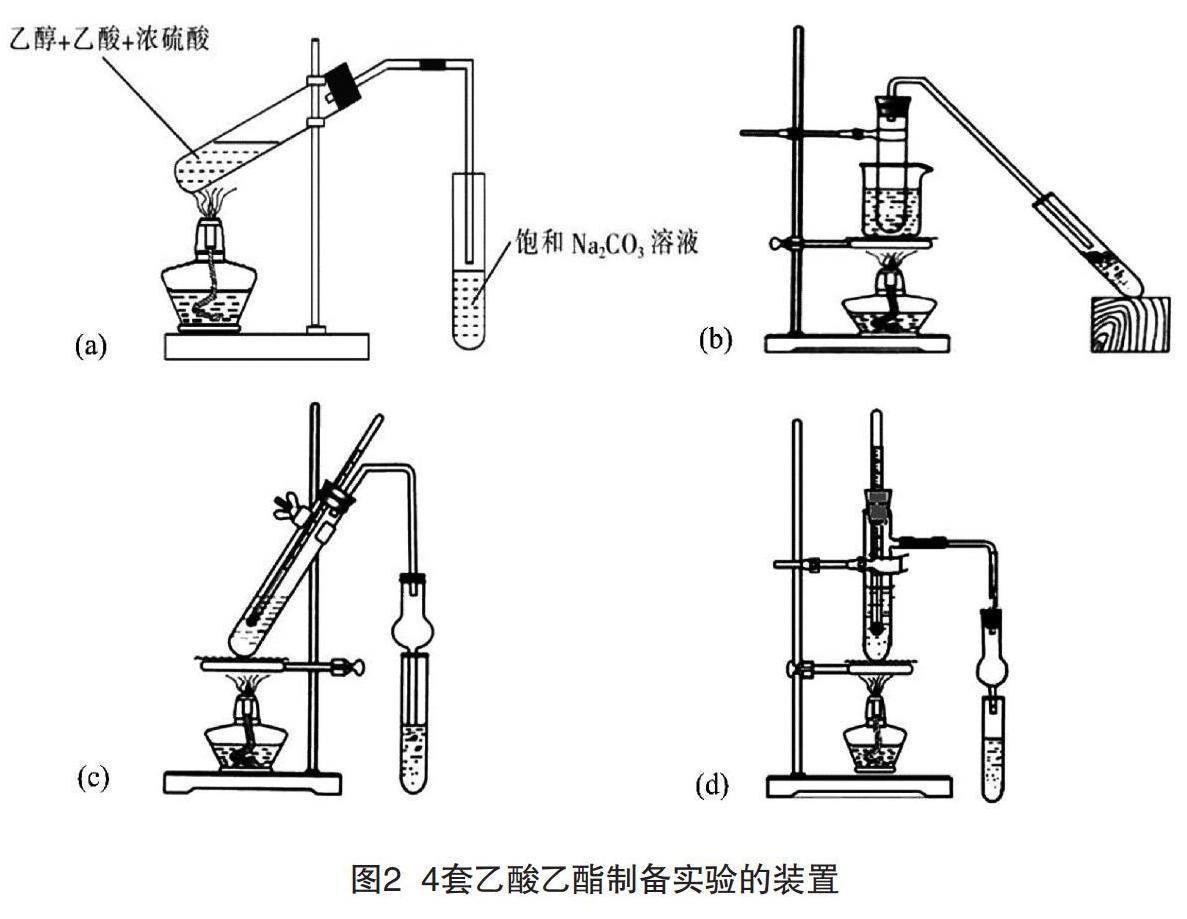
在人教版[7]、苏教版[8]、鲁科版[9]等高中教材中有关乙酸乙酯的制取都采取在试管里加入3 mL乙醇、2 mL浓硫酸和2 mL冰醋酸,并用酒精灯直接加热的方法,装置如图2(a)所示,这种加热方式及装置简单易操作,符合課堂演示“短平快”的特点,但是也存在一定的问题。
酒精灯温度为400~500 ℃,用酒精灯直接加热时,反应混合物的液体温度升温迅速,反应温度较高,还未等酯化反应达到平衡,其体系中的乙醇和乙酸等反应物就已被蒸出;同时,乙醇在140 ℃和170 ℃时,还会与浓硫酸发生副反应生成乙醚、乙烯、碳单质以及二氧化硫等副产物,所以,采用酒精灯直接加热法虽然操作简便,但存在副产物多、产率较低等问题。
2.1.2 水浴加热制备乙酸乙酯
根据乙醇、乙酸、浓硫酸以及乙酸乙酯的熔沸点等相关物理性质,易知反应的最佳温度在70~80 ℃,而沪科版化学教材有关乙酸乙酯制取的实验在药品及用量均不变的情况下,选择了水浴加热的方式,装置如图2(b)所示。水浴加热易于控制温度,不仅使反应物受热均匀且能大大减少其蒸发,但受水浴温度低、给热环境开放、玻璃材质不易导热、蒸出来的气流走的路线过长等限制,制备乙酸乙酯的时间较长,生成产物的实验现象不明显,甚至很有可能出现演示实验失败的情况。对此,刘敏等[10]通过在朱志荣[11]设计的改进装置[见图2(c)]的基础上再进行改进,设计了如图2(d)所示的装置,其使用的具支试管增强了装置的气密性,并控制冷凝管的长度以提高实验效果。
孔令琦等[12]通过正交实验探究得出影响制取乙酸乙酯的因素:浓硫酸的体积>试管上部冷凝导管的长度>乙醇与乙酸的体积比>反应温度。经方差分析得到最佳方法:水浴温度控制在95 ℃,浓硫酸1 mL、试管上部冷凝导管长度为2 cm、乙醇与乙酸的体积比为5∶5(各5 mL),通过实验验证,使用上述方法只要40 s即可产生乙酸乙酯,并可在2 min内制取4.3 mL乙酸乙酯。
除此之外,鲍文亮等[13]通过对水浴条件下酯化反应最佳条件的探究发现,用生活中的保温杯作为“恒温水槽”(里面的水最好是刚烧开的沸水),药品及用量分别为浓硫酸2滴、无水乙醇2 mL、乙酸2 mL,在1 min左右就出现乙酸乙酯,2~3 min酯层高度已达1 cm,现象非常明显,仪器和实验操作也相对简单。此外,还应注意在装置接收管中的玻璃导管应与液面保持3~5 cm的距离,除了常见的防止倒吸的作用,也是为了防止整个体系形成封闭的状态,降低安全风险。
2.1.3 微型装置制备乙酸乙酯
李嘉[14]使用真空采血管设计的微型减压蒸馏系统装置进行反应,如图3所示,不仅降低了反应容器中水与乙醇、乙酸乙酯形成的二元或三元恒沸物的沸点,而且减少了反应物的挥发和副反应的产生,同时,还有效缩短了管内蒸汽走过的路线,大大缩短受热时间,从各个方面提高了酯的产率。简而言之,这套装置具有绿色、安全、高效、简便易携带和成本低的特点,比较适合作为学生了解减压蒸馏的实验装置,但由于微型实验仪器没有统一规格,装置配置较难,对实验操作人员的操作技能和仪器使用规则等要求都较高,增加了教师授课的难度[15]。
2.2 饱和碳酸钠溶液的作用
饱和的碳酸钠溶液有3个作用:(1)吸收随乙酸乙酯一起蒸馏出来的乙酸;(2)吸收随乙酸乙酯一起蒸馏出来的乙醇;(3)可以使有机层和水层形成明显的界面,方便观察生成的酯的量。但实践证明,使用15%的NaOH溶液也可以达到同样的效果[6]。
2.3 新型催化剂对制备乙酸乙酯的影响
2.3.1 硫酸氢钠作为催化剂
硫酸氢钠可使体系呈酸性,在反应体系中,不仅其自身的结晶水能在催化剂表面电离出质子来催化反应,同时,反应生成的水又能够被硫酸氢钠结合形成结晶水,有利于平衡向正向移动。在温度过高时,不会出现乙醇脱水及碳化现象,也不会由于酸的挥发而引起质子浓度下降,及时蒸出乙酸乙酯从而有利于酯化反应的进行,但催化剂用量过多,会导致副反应发生从而影响酯化率。
徐常龙等[16]通过研究催化剂用量、反应物用量以及各种催化剂对乙酸乙酯产量的影响进而得出,用硫酸氢钠催化合成乙酸乙酯的适宜工艺条件:乙醇乙酸物质的量比为1.0∶1.5,催化剂用量为1.2 g/0.2 mol乙醇,酯化率可达到82.4%;此外,使用三氯化铁作催化剂时,催化效果虽然较好,但用量较大,为3.5 g,而当以1.2 g氯化铁进行催化反应时,效果明显下降,所以催化剂用量最少、效果较好的催化剂是硫酸氢钠,然而,因需要经过加热、搅拌、溶解并置于冰水混合液中,使其冷却、静置并且析晶才能制备硫酸氢钠,用其作催化剂会延长实验时间,反应过程更为复杂。
2.3.2 对甲基苯磺酸作为催化剂
对甲基苯磺酸也常被用作酯化的催化剂[17-18],反应过程绿色、环保,反应条件较为温和,且操作方便,但在液相反应中,显然固相催化剂相较于液相催化剂更为方便。
张荣莉等[19]发现,用活性炭负载对甲基苯磺酸作固相催化剂的效果很好,酯化率也较高,可达95%,反应的最佳条件为:冰乙酸用量为0.1 mol,醇酸物质的量比为1∶6,催化剂用量为3.0 g,反应时间为1.5 h,反应后,经简单的相分离及后处理后,该催化剂即可重复使用,且重复使用8次后,酯化率仍高达91%。活性炭负载对甲基苯磺酸作为催化剂具有价格便宜、对环境污染小、反应时间短、酯化率高、后处理简单等优点,然而,在用活性炭负载对甲基苯磺酸作为催化剂这一过程中,需要经过清洗、烘干、高温活化2 h、冷却、浸泡、静置、抽滤、洗涤、干燥5 h等步骤,对于合成乙酸乙酯的教学演示实验来说稍显复杂,可适当给学生普及活性炭在负载物质作为催化剂方面的相关知识。
李建壮等[20]则发现当使用超声功率为500 W、醇酸比为2.5∶1.0、催化剂用量为6.0%、反应时间为90 min、反应温度为90 ℃时,乙酸乙酯收率达92.4%,可见,这种方法也较为方便、环保、绿色。
2.3.3 FeCl3·6H2O作为催化剂
氯化铁即路易斯酸,在酯化反应过程中,Fe3+诱导乙酸羧氧的孤对电子,从而使羰基易被亲核的醇进攻发生加成反应,在酸作用下脱水成酯。王小三等[21]通过化学计量数测得乙酸乙酯的理论产量来评价催化剂的效果,认为选取FeCl3·6H2O作为催化剂,不仅催化效率高,且无毒、无污染、易得,最终产率为63.4%。
2.3.4 蒙脱土作为催化剂
由于路易斯酸催化酯化反应效果较好,并基于中学实验教学所要求的现象明显、简易快速等特点,唐凡单等[22]选择具有很强的吸附能力和阳离子交换性能[23]的蒙脱土(Montmorillonite,MMT)作为酯化反应的催化剂,认为MMT的成分中含有路易斯酸,并且MMT层间以范德华力结合,键能很弱,易解离,水分子很容易进入层间;同时,MMT晶体中有许多金属阳离子和羟基亲水基,因此,具有较强的吸水性,通过实验证明,0.05 g蒙脱土作催化剂,约3 min就能得到乙酸乙酯,且可循环使用3次,由此可见,蒙脱土确实不失为一种良好的绿色、高效、环保、经济的催化剂,但学生对蒙脱土知之甚少,需要教师结合相关资料介绍蒙脱土的组成及基本性质。
3 结语
制备乙酸乙酯的反应存在多种加热方式及装置,在产物得率、操作难度等方面各有利弊。同时,近几年众多学者对乙酸酯化反应的催化剂进行了广泛研究,都取得了快速发展,催化剂的范围和催化活性都有很大改善,但这些体系仍存在许多问题亟待解决,建议未来继续深入研究,希望开发一种高效、绿色的催化剂并实现商业化生产应用。
[参考文献]
[1]崔小明.我国醋酸乙酯合成技术及市场分析[J].乙醛醋酸化工,2015(12):9-15.
[2]朱志荣.乙酸乙酯制备演示实验的改进[J].化学教学,2015(2):59-62.
[3]宋心琦,课程教材研究所,等.化学—选修5—有机化学基础[M].北京:人民教育出版社,2007.
[4]刘 帅,蔡小蔓,陈建新.同位素示踪法在研究酯化反应机理中的两个疑问[J].化学教与学,2018(9):30-31.
[5]董 啸.对有机化学中酯化反应过程描述的商榷[J].中学化学教学参考,2016(7):67-68.
[6]郭子亮.对乙酸乙酯制备实验的思考[J].实验教学与仪器,2016(S2):59.
[7]宋心琦.化学—必修2[M].北京:人民教育出版社,2007.
[8]王祖浩.化学—选修5:有机化学基础[M].南京:江苏凤凰教育出版社,2009
[9]王磊册.化学—第二册(必修)[M].济南:山东科学技术出版社,2019.
[10]刘 敏,魏良怡.乙酸乙酯制备演示实验的再改进设计[J].化学教学,2015(12):65-67.
[11]朱志荣.乙酸乙酯制备演示实验的改进[J].化学教学,2015(2):59-62.
[12]孔令琦,丁 伟.正交试验优选实验室制备乙酸乙酯的方法[J].化学教学,2014(4):51-53.
[13]鲍文亮,林美凤,刘丽君.水浴条件下乙酸乙酯制备实验的改进[J].化学教学,2019(10):64-66.
[14]李 嘉.乙酸乙酯制备实验的微型化改进[J].化学教育(中英文),2018(15):76-77.
[15]陈正旺,叶 敏,王青豪,等.微型实验在高校有机化学实验教学中的作用[J].江西化工,2019(6):36-38.
[16]徐常龙,陶春元,柳闽生.硫酸氢钠催化合成乙酸乙酯[J].九江学院学报:自然科学版,2005,20(4):53-54,66.
[17]李继忠.对甲苯磺酸催化合成乙酸正丁酯[J].合成化学,2003,11(5):457-458.
[18]曹艳林,周冰倩,王春杰.對甲苯磺酸催化合成苯甲酸正己酯[J].江西化工,2018(5):92-94.
[19]张荣莉,张翠歌,孙艳艳,等.《有机化学实验》教学中乙酸乙酯制备实验改进[J].洛阳师范学院学报,2017,36(11):44-46.
[20]李建壮,王崇景,楚红英,等.一种利用对氨基苯磺酸催化合成乙酸乙酯的方法:中国,109734587A[P].2019-05-10.
[21]王小三,魏 峥.几种常见固体酸催化乙酸乙酯合成实验研究[J].广东化工,2019,46(12):14,30.
[22]唐凡单,李忠恒,周丽梅.蒙脱土(MMT)催化乙醇和乙酸的酯化反应实验[J].中学化学教学参考,2019(17):57-59.
[23]《化学化工大辞典》编委会.化学化工大辞典(下)[M].北京:化学工业出版社,2003.
