溶液体系中迷迭香酸与肌球蛋白的相互作用及其对蛋白理化特性的影响
2020-07-04陈雪珂戴宏杰朱瀚昆王洪霞张宇昊
周 扬,陈雪珂,戴宏杰,余 永,朱瀚昆,王洪霞,张宇昊*
(西南大学食品科学学院,重庆 400715)
肌球蛋白是肉及肉制品中最主要的蛋白质,约占肌肉总蛋白的1/3,是蛋白功能特性的主要承担者,对肉制品品质起关键性作用[1-2]。迷迭香是肉制品加工、贮藏等过程中常见的调料,赋予了产品特殊风味并起到抗氧化等作用,其中起主要作用的成分为多酚类化合物。迷迭香酸(rosmarinic acid,RA)是一种水溶性多酚,被鉴定为迷迭香提取物的主要成分之一,具有抗氧化、抗炎、抗血栓生成、抗菌等生物活性,广泛应用于食品、医药、化妆品等领域[3]。
目前,将RA或迷迭香提取物用于延缓肉类制品的脂肪氧化和蛋白质氧化已有报道。高辉等[4]在火腿肠中添加了适量RA,有效延缓了火腿肠的脂肪氧化。张晓洁[5]将RA添加到明胶膜中用于猪肉的保鲜研究,结果表明RA可以提高明胶膜的抗氧化性,延缓腊肉的脂质氧化。此外,也有将迷迭香提取物添加到肉类产品中,贾娜等[6]将迷迭香提取物添加到鸡肉糜中,具有抑制鸡肉糜在冷藏过程中的脂肪氧化作用,并改善了肉制品的品质。其中,RA等多酚类物质会与肉制品中的蛋白质发生相互作用,进而影响蛋白质的结构特征和理化特性,导致其功能特性发生改变。诸多研究表明,蛋白质与多酚类化合物之间的相互作用分为可逆的非共价相互作用和不可逆的共价相互作用,但因为蛋白质的高度复杂性、多酚的多反应活性、蛋白与多酚种类及反应条件的不同,其相互作用呈现出复杂性。目前,关于肉类蛋白与RA的互作研究大部分都基于氧化条件下对于蛋白凝胶特性的影响。而在非氧化条件下,肌球蛋白与RA在溶液体系中的相互作用及其与蛋白理化特性的内在联系的研究较少。
本研究以肌球蛋白和RA为原料制备混合溶液,运用荧光光谱、圆二色谱、电泳等方法表征RA与肌球蛋白的相互作用,并测定不同盐浓度条件下肌球蛋白的构象变化和功能特性等指标,旨在探究溶液状态下RA与肌球蛋白的相互作用及其对肌球蛋白理化特性的影响,并阐明相关机理。
1 材料与方法
1.1 材料与试剂
新鲜猪里脊肉、大豆油 重庆市北碚区永辉超市;RA(纯度97%) 上海阿拉丁试剂公司;甘氨酸生工生物工程上海有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、过硫酸铵、β-巯基乙醇(β-mercaptoethanol,β-ME)、三羟甲基氨基甲烷(Tris,分析纯)、四甲基乙二胺、考马斯亮蓝R-250(分析纯) 上海佰晔生物科技中心;标准蛋白(分子质量10~200 kDa) 加拿大Fermentas公司;三磷酸腺苷二钠盐、乙二醇-双-(2-氨基乙醚)四乙酸(ethylenebis(oxyethylenenitrilo)tetraacetic acid,EGTA)、5,5-二硫代双-(2-硝基苯甲酸)(5,5’-dithio bis-(2-nitrobenzoic acid),DTNB)、溴酚蓝(bromophenol blue,BPB)、丙烯酰胺(分析纯,质量分数30%) 北京索莱宝科技有限公司;氯化钠成都市科龙化工试剂厂;其他试剂均为分析纯。
1.2 仪器与设备
JA3003B型电子天平 上海精天电子仪器有限公司;PHS-25型数显酸度计 杭州雷磁分析仪器厂;QL 901 Vortex型涡旋混合器 海门市其林贝尔仪器制造有限公司;XHF-D型高速分散器 宁波新芝有限公司;Heraeus Multifuge X3R型高速冷冻离心机 美国赛默飞世尔科技公司;722-P型紫外-可见光分光光度计 上海菁华科技仪器有限公司;F-4500型荧光分光光度计 日本日立公司;Power PacTM型基础电泳仪 美国Bio-Rad公司;G:BOX EF型凝胶成像系统 英国Syngene公司;MOS-500型圆二色谱仪 法国Bio-Logic公司;ZEN3690型粒度仪 英国马尔文仪器公司。
1.3 方法
1.3.1 肌球蛋白的提取
参照Liu Ru等[7]的方法略作修改。为了防止蛋白质变性和蛋白质水解,用于制备肌球蛋白的溶液要在4 ℃进行保存。取猪里脊肉,切成肉糜状,加入10 倍体积的试剂A(0.1 mol/L KCl,20 mmol/L Tris-HCl缓冲液,用盐酸调节pH值至7.5)。用均质机在10 000 r/min条件下将其均质1 min。混合物在4 ℃放置15 min,5 000 r/min、4 ℃离心5 min。取沉淀,加入5 倍体积的试剂B(0.45 mol/L KCl,5 mmol/L β-ME,0.2 mol/L乙酸镁,1 mmol/L EGTA,20 mmol/L Tris-HCl缓冲液,用马来酸调节pH值至6.8),再加ATP,使其最终浓度为10 mmol/L,混合物在4 ℃放置90 min,10 000 r/min、4 ℃离心10 min。取上清液,加入5 倍体积的1 mmol/L KHCO3进行缓慢稀释,4 ℃放置20 min,10 000 r/min离心10 min(4 ℃)。取沉淀,加入2.5 倍体积的试剂C(0.5 mol/L KCl,5 mmol/L β-ME,20 mmol/L Tris-HCl缓冲液,用盐酸调节pH值至7.5),4 ℃保存10 min,然后缓慢加入7 倍体积的1 mmol/L KHCO3,同时,加入MgCl2使其最终浓度为10 mmol/L。将形成的混合物在4 ℃保存12 h,10 000 r/min、4 ℃离心10 min。取沉淀物,即为肌球蛋白,4 ℃保存,3 d内使用,肌球蛋白含量的测定采用双缩脲法。
1.3.2 肌球蛋白-RA混合液的制备
将提取的肌球蛋白分散于20 mmol/L Tris-HCl(pH 7.0)缓冲液中,并与RA溶液(溶于相同缓冲液)混合均匀,RA添加质量分数2%。向混合液中加入固体NaCl,使NaCl的最终浓度分别为0.2、0.4、0.6、0.8、1.0 mol/L,搅拌均匀,得到一系列不同盐浓度条件下的肌球蛋白-RA混合液(myosin-rosmarinic acid,M-RA)。对照组(M)不含RA。
1.3.3 色氨酸荧光测定
采用荧光分光光度仪检测肌球蛋白的内源色氨酸荧光[8]。室温下,将肌球蛋白分散于20 mmol/L Tris-HCl缓冲液(含0.6 mol/L NaCl,pH 7.0)中,将RA溶液(溶于相同缓冲液)按照不同比例混合,得到一系列混合溶液,其最终肌球蛋白质量浓度为0.2 mg/mL,RA质量浓度为0~0.014 mg/mL。混合均匀后测量在3 个不同温度(298、308、318 K)条件下的肌球蛋白荧光光谱。激发波长为295 nm,激发和发射狭缝宽度均设置为5 nm,扫描范围为300~500 nm。
Stern-Volmer方程:
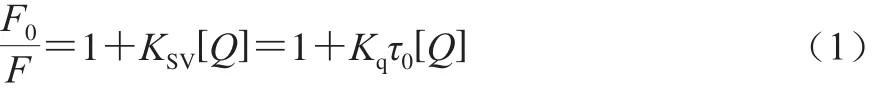
式中:F0和F分别为淬灭剂不存在和存在的荧光强度;KSV为速率常数/(L/mol);Kq为猝灭常数/(L/(mol·s));[Q]为淬灭剂的浓度/(mol/L);生物大分子τ0=10-8s-1。
Lineweaver-Burk静态猝灭公式:
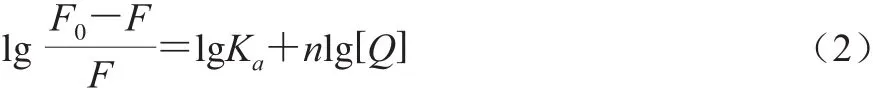
式中:Ka为表观结合常数/(L/mol);n为结合位点;[Q]为荧光猝灭剂的浓度/(mol/L)。
Van’t Hoff等式:

式中:K为温度T时的结合常数;R为气体常数;ΔH为焓变;ΔS为熵变;ΔG为吉布斯自由能。
1.3.4 表面疏水性
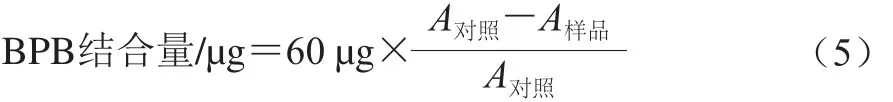
参照Chelh等[9]的方法略作修改。将样品调至蛋白质量浓度为2 mg/mL,取2 mL样液于离心管中,分别加入60 μL的1 mg/mL溴酚蓝溶液,振荡均匀,10 000 r/min离心10 min。取上清液再次离心后于595 nm波长处测定吸光度。以缓冲溶液为空白对照,蛋白结合的BPB含量作为疏水性指标,计算如式(5)所示:
1.3.5 总巯基测定
参照Liu Jianhua等[10]的方法,并略作修改。将样品调至蛋白质量浓度为2 mg/mL,取1 mL样液悬浮于2 mL的Tris-甘氨酸缓冲液(0.086 mol/L Tris,0.09 mol/L甘氨酸,4 mmol/L EDTA,8 mol/L尿素,pH 8.0)中,加入0.5 mL 10 mmol/L Ellman试剂(0.2 g DTNB溶解于50 mL的Tris-甘氨酸缓冲液中),混合均匀后静置30 min,于412 nm波长处测吸光度。以缓冲溶液为空白对照,计算如式(6)所示:
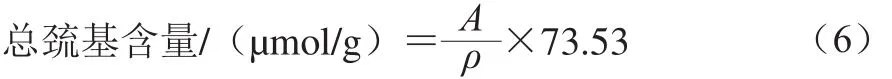
式中:A为412 nm波长处的吸光度,ρ为样品的蛋白质量浓度/(mg/mL)。
1.3.6 电泳分析
制备12%分离胶、4%浓缩胶。将样品调至蛋白质量浓度为2 mg/mL,取20 μL样品并添加5 μL样品缓冲液(250 mmol/L Tris-HCl,pH 6.8)、0.1 g/mL十二烷基硫酸钠、5 mg/mL溴酚蓝、体积分数50%甘油、体积分数5% β-ME,沸水浴5 min后立即于冰水浴中冷却,上样量为10 μL。电流为15 mA,待溴酚蓝从浓缩胶跑到分离胶中部后,电流调至25 mA,电泳结束后用考马斯亮蓝R-250染色液进行染色,2 h后用脱色液振荡脱色,待条带清晰后拍摄电泳图谱。
1.3.7 圆二色谱扫描
采用圆二色谱仪测定肌球蛋白的二级结构。将样品调至蛋白质量浓度为0.1 mg/mL,圆二色谱扫描波长范围为190~250 nm,扫描速率为100 nm/min,样品池光径为1 mm。以缓冲液为空白对照,计算如式(7)所示:
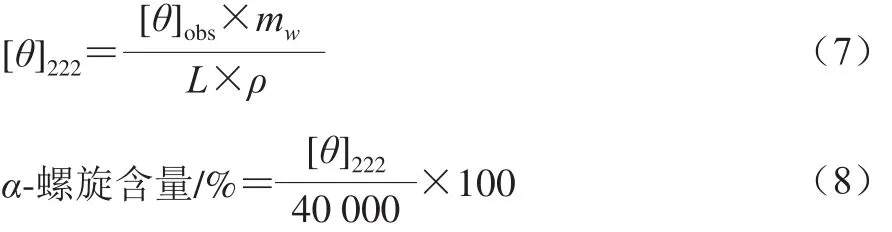
式中:[θ]222为2 2 2 n m波长处的摩尔椭圆率/(deg·cm2/dmol);[θ]obs为222 nm波长处的椭圆率/mdeg;mw为肌球蛋白的平均残基分子质量,取115 g/mol;ρ为肌球蛋白质量浓度/(mg/mL);L为比色皿光程长度/mm。
1.3.8 溶解度和浊度测定
溶解度:将样品调至蛋白质量浓度为2 mg/mL,4 ℃、10 000 r/min离心15 min,测定上清液中的蛋白浓度,蛋白溶解度计算如式(9)所示:

浊度:将样品调至蛋白质量浓度为2 mg/mL,于370 nm波长处测定吸光度。
1.3.9 Zeta电位和粒径测定
采用马尔文粒径仪测定肌球蛋白样品的电位和粒径分布。将样品调至蛋白质量浓度0.5 mg/mL,粒度分析仪为He-Ne光源,功率5 mW,散射角90°,平衡时间60 s。
1.3.10 乳化特性测定
采用浊度法测定肌球蛋白的乳化性质[11]。将样品调至蛋白质量浓度为0.2 mg/mL,取8.0 mL置于离心管中,并加入2.0 mL大豆油,10 000 r/min均质1 min,立即从距离心管底0.5 cm的地方取匀浆液50 μL,加入到5 mL质量分数为0.1%的SDS溶液中,振荡混匀后于500 nm波长处测定吸光度记为A0;静置10 min再次在相同的位置取匀浆液50 μL,加入到5 mL相同SDS溶液中,振荡混匀后测定吸光度记为A10。以0.1% SDS溶液为空白对照,乳化活力和乳化稳定性的计算公式如下:
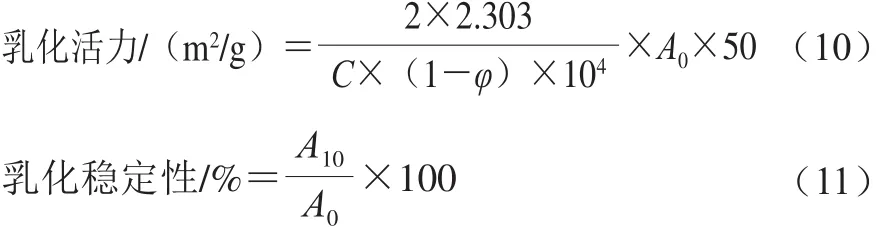
式中:A0、A10为乳状液在第0、10分钟的吸光度;φ为油相体积分数(φ=0.2);C为蛋白质量浓度/(mg/mL)。
1.4 数据分析
数据处理采用SPSS 17.0和Origin 8.0软件,每次实验重复3 次。在分析过程中对数据进行方差分析,利用Duncan多重比较进行显著性分析,P<0.05,差异显著。
2 结果与分析
2.1 荧光光谱分析
2.1.1 色氨酸荧光结果
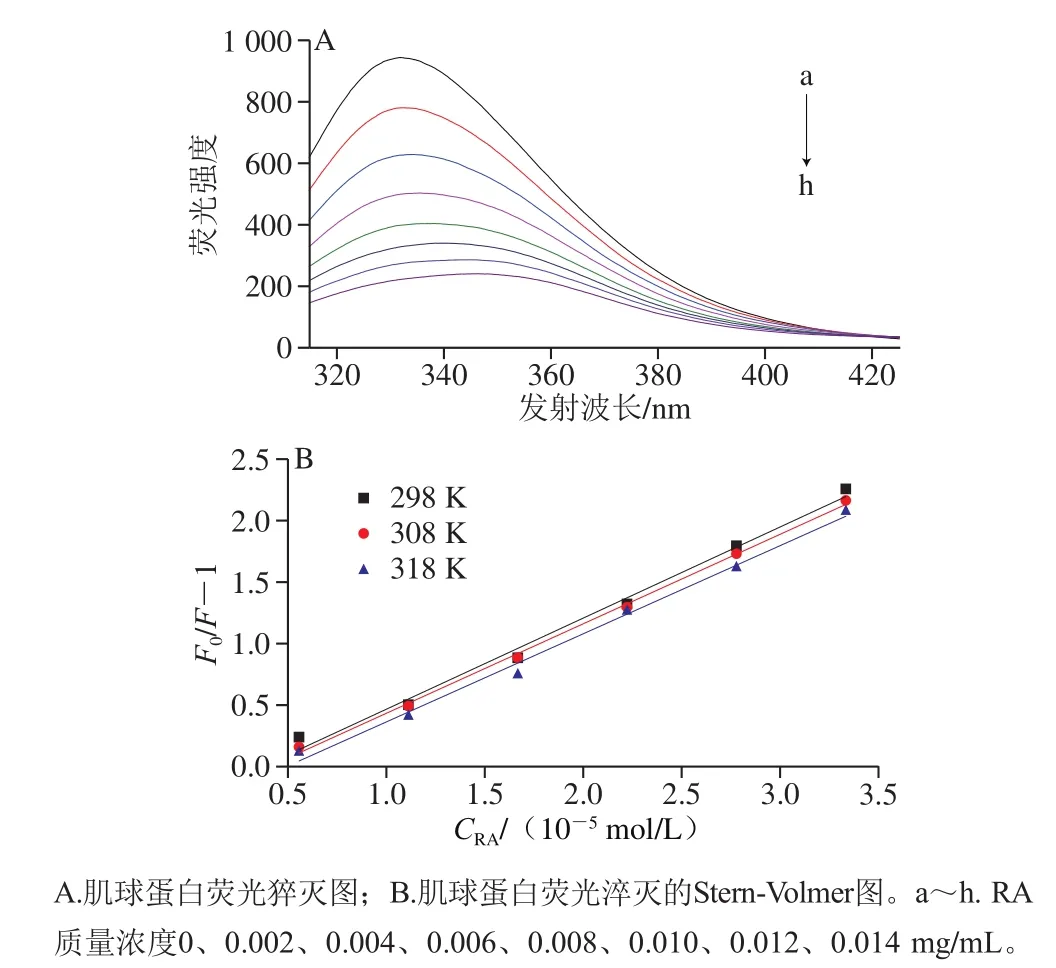
图1 RA对肌球蛋白内源荧光的淬灭作用Fig. 1 Effect of RA concentration on tryptophan fluorescence of myosin

表1 不同温度下RA与肌球蛋白相互作用的猝灭常数(Kq)和速率常数(Ksv)Table 1Stern-Volmer quenching constants for M-RA system at different temperatures
在一定的激发波长下,蛋白质分子中的芳香族氨基酸(色氨酸、酪氨酸和苯丙氨酸)可以产生荧光,其中,色氨酸的荧光最强[12]。蛋白溶液中添加多酚后,可能会导致荧光强度降低,即荧光猝灭,故可以通过研究蛋白的色氨酸荧光了解蛋白与多酚之间的相互作用。如图1A所示,当激发波长为295 nm时,肌球蛋白被激发后展现出很强的荧光强度。随RA添加量的增加,肌球蛋白的荧光强度逐渐降低,且伴随着最大发射峰出现明显的红移现象(从332 nm移至344 nm),说明RA对于肌球蛋白内源荧光具有明显的猝灭作用,二者可能通过相互作用促使蛋白结构展开,进而使色氨酸从蛋白内部疏水性位置暴露到极性环境中[13]。
一般而言,导致蛋白质荧光猝灭的方式通常可分为动态猝灭和静态猝灭。为进一步阐明RA对肌球蛋白的猝灭机理,采用经典Stern-Volmer方程对荧光数据进行分析[14]。如图1B、表1所示,随温度升高,猝灭曲线的斜率(Ksv)逐渐降低,且猝灭常数Kq远大于最大动态猝灭常数(2.0×1010L/(mol·s))[15],说明RA引起的肌球蛋白荧光猝灭是分子之间结合形成复合物所引起的静态荧光猝灭,而不是由分子扩散和碰撞所引起的动态荧光猝灭。
2.1.2 结合情况和作用力类型判断

表2 不同温度下RA与肌球蛋白结合的相关常数和方程Table 2Regression equations and correlation coef ficients for RA-M system at different temperatures

表3 RA和肌球蛋白相互作用的热力学参数Table 3 Thermodynamic parameters of interaction between RA and myosin
如表2所示,温度对肌球蛋白与RA的结合常数影响不大,Ka值均大于104L/mol,且可形成一个结合位点,表明RA与肌球蛋白之间结合力很好。
如表3所示,通过反应的热力学参数的计算可大致确定作用力的类型。肌球蛋白与RA的作用过程是一个放热过程(ΔH<0),熵增过程(ΔS>0)及自发过程(ΔG<0),且熵增加是肌球蛋白与RA相互作用过程的主要驱动力。在水溶液中,ΔS>0,可认为二者之间主要的作用力为疏水作用,这是因为水溶液中有离子间的静电作用使得ΔH<0[16]。因此,肌球蛋白与RA之间以疏水相互作用为主,还包括氢键和范德华力等,如图2所示。He Wenjia等[17]分析热力学结果得到,矢车菊素-3-O-葡萄糖苷(cyanidin-3-O-glucoside,C3G)与β-乳球蛋白主要通过氢键和疏水相互作用结合,C3G与β-酪蛋白则主要通过氢键和范德华力进行相互作用。这些不同的结果可能是由于蛋白和多酚种类及状态不同所致。
2.2 表面疏水性分析
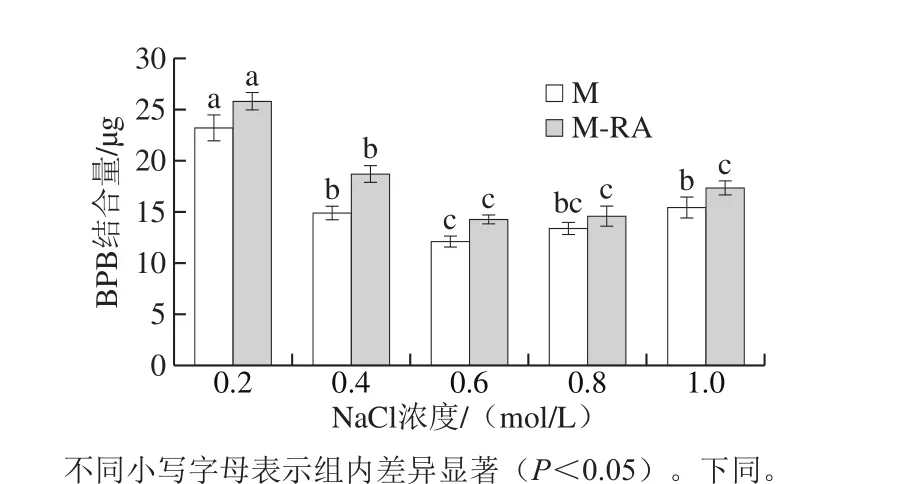
图2 不同NaCl浓度下RA对肌球蛋白表面疏水性的影响Fig. 2 Effect of RA on surface hydrophobicity of myosin at different NaCl concentrations
如图2所示,当NaCl浓度从0.2 mol/L增加至0.6 mol/L时,两组疏水性均呈显著减少的趋势(P<0.05),这可能是因为随NaCl浓度升高,蛋白质周围的亲水基团逐渐结合水分子,允许部分疏水性氨基酸残基包埋在蛋白质分子内部,引起表面疏水性下降。当NaCl浓度从0.6 mol/L增加至1.0 mol/L时,M组疏水性显著增加(P<0.05),而M-RA组无显著变化(P>0.05),这可能是因为肌球蛋白在高盐浓度下出现盐析作用导致疏水作用增加,而添加RA可以抑制这种作用。总体而言,添加RA导致肌球蛋白疏水性升高,说明RA可以促进肌球蛋白结构的展开,暴露埋藏在蛋白分子内部的疏水性基团。结合色氨酸荧光结果,进一步表明添加RA可以促使蛋白结构展开并暴露疏水性基团,从而利于肌球蛋白与RA发生疏水相互作用。
2.3 总巯基分析
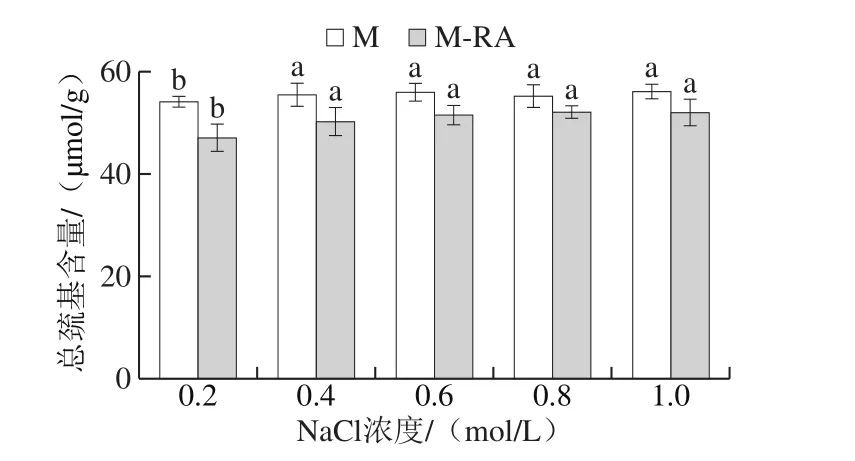
图3 不同NaCl浓度下RA对肌球蛋白总巯基的影响Fig. 3 Effect of RA on total sulfhydryl content of myosin at different NaCl concentrations
总巯基包括埋藏在蛋白分子内部和暴露在蛋白分子表面的巯基,暴露于分子表面的巯基极易被氧化成二硫键,引起蛋白质分子间交联,进而影响蛋白质的功能特性[18]。如图3所示,当NaCl浓度从0.2 mol/L增加至0.4 mol/L时,两组总巯基含量均显著增加(P<0.05);NaCl浓度在0.4~1.0 mol/L范围内,两组总巯基含量无显著变化(P>0.05),说明此时NaCl浓度对蛋白巯基含量无显著性影响。总体而言,添加RA导致肌球蛋白总巯基含量下降,这可能是因为RA促进蛋白结构展开,埋藏在蛋白分子内部的部分巯基暴露出来,进而被氧化为二硫键等导致巯基含量降低[19]。此外,巯基的减少还可能是因为酚类化合物与蛋白巯基发生相互作用。贾娜等[20]将迷迭香提取物添加到肌原纤维蛋白中,迷迭香提取物中的多酚类化合物均含有巯基结合位点,因而使得巯基含量下降。Tang Changbo等[21]研究发现高浓度的多酚能与蛋白中的巯基发生共价结合,生成巯基-醌加成物。

图4 不同NaCl浓度下RA对肌球蛋白SDS-PAGE的影响Fig. 4 Effect of RA on SDS-PAGE pattern of myosin at different NaCl concentrations
为了进一步验证溶液体系中RA与巯基是否发生了相互作用,分析RA对肌球蛋白SDS-PAGE图谱的影响。如图4所示,肌球蛋白由大约200 kDa的肌球蛋白重链(myosin heavy chain,MHC)亚基谱带和分子质量大约15~25 kDa的3 条肌球蛋白轻链(myosin light chain,MLC)亚基,以及43 kDa的肌动蛋白杂条带组成。在SDS-PAGE中,非还原条件下(-β-ME),随NaCl浓度的增加,两组蛋白分子组成无明显区别,在浓缩胶顶部均存在高分子聚合物。在还原条件下(+β-ME),这些聚合物得到分解,说明聚合物主要是通过二硫键交联产生。此外,MHC带处浓度明显减少,说明非还原条件下,该条带并非单纯的MHC组分,还包含了部分由二硫键交联形成的聚合物。与M组相比,还原和非还原条件下M-RA组图谱均无明显变化,也就是说所有聚合物是通过二硫键交联而非RA导致的共价交联所产生,说明肌球蛋白与RA之间作用以非共价作用为主,故在电泳条件下,SDS溶液可以破坏这些弱键,使得图谱没有明显差异。
2.4 圆二色谱分析
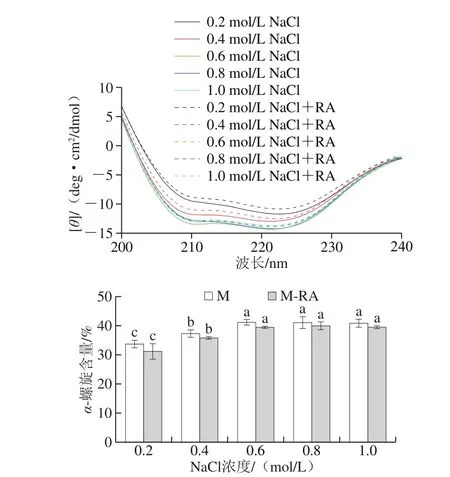
图5 不同NaCl浓度下RA对肌球蛋白二级结构的影响Fig. 5 Effect of RA on secondary structures of myosin at different NaCl concentrations
如图5所示,两组肌球蛋白在208 nm和222 nm波长附近均出现2 个强负吸收峰,表明螺旋结构的存在并作为二级结构的主要部分,随NaCl浓度增加,两组α-螺旋结构含量显著增加(P<0.05),这可能是因为α-螺旋结构是由蛋白质的羰基(—CO)和氨基(NH—)之间的氢键所维持的,高离子强度下受静电屏蔽作用更有利于氢键的形成和稳定。
总体而言,添加RA后,肌球蛋白的α-螺旋含量降低,说明RA可以促进肌球蛋白双螺旋杆状尾部结构的解旋,导致肌球蛋白结构进一步得到展开,这与表面疏水性结果一致。此外,RA的羟基可与蛋白质多肽链的羰基形成氢键,这可能会破坏肌球蛋白分子内氢键平衡,从而破坏其稳定性。
2.5 肌球蛋白与RA的互作机制
如图6所示,在溶液中,肌球蛋白与RA之间主要通过疏水相互作用结合,不存在共价相互作用,添加RA可以促进肌球蛋白结构展开,暴露出更多的活性基团,进一步利于肌球蛋白与RA之间发生疏水相互作用。肌球蛋白与RA之间的相互作用除了可以影响蛋白分子的结构特征,还可能会进一步影响其理化特性。
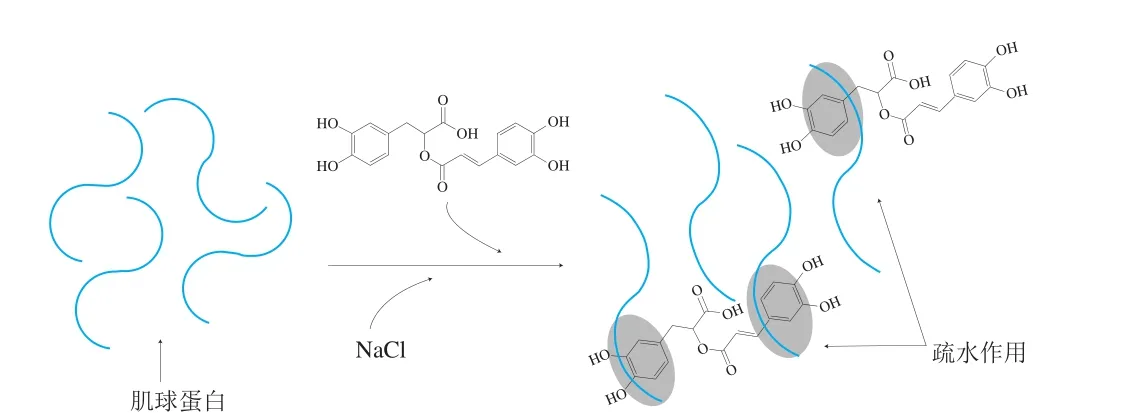
图6 溶液中肌球蛋白与RA的互作机制Fig. 6 Mechanism underlying interaction between myosin and RA in aqueous solution
2.6 溶解度和浊度分析
如图7所示,当NaCl浓度从0.2 mol/L增加至0.6 mol/L时,两组的溶解度均呈显著增加趋势(P<0.05),而浊度呈现相反变化趋势,这是因为在0.2 mol/L NaCl条件下,肌球蛋白分子以不溶性的纤丝形式存在;随NaCl浓度增加,盐离子逐渐破坏肌球蛋白分子间静电相互作用,抑制丝状体的形成,蛋白分子表现为可溶性单体或寡聚体[22]。当NaCl浓度高于0.6 mol/L时,M组溶解度呈现微弱的下降趋势,这可能是因为分子间的静电斥力减弱允许蛋白分子相互靠近以致发生聚集,且由于疏水基团的互作用,导致溶解度下降[20]。总体而言,添加RA后,肌球蛋白的溶解度降低,浊度增加,这可能是因为RA促进了肌球蛋白结构展开,疏水性基团得到暴露,并改变了蛋白分子的带电状况,导致蛋白聚集,从而改变了肌球蛋白的溶解度和浊度。
2.7 Zeta电位和粒径分析
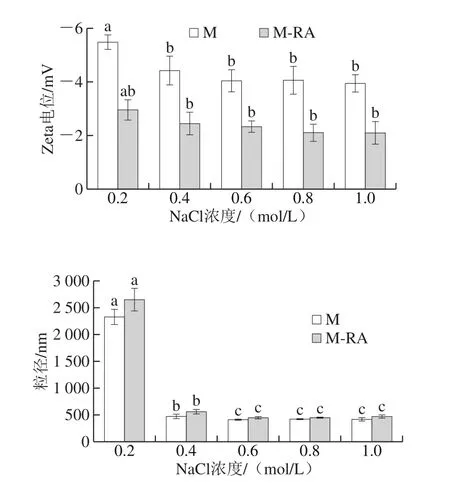
图8 不同NaCl浓度下RA对肌球蛋白粒径和Zeta电位的影响Fig. 8 Effects of RA on particle size and zeta potential of myosin at different NaCl concentrations
Zeta电位描述了溶液体系中颗粒之间的静电相互作用,可以表征溶液体系的稳定性[23-24]。如图8所示,Zeta电位为负值,表明肌球蛋白呈负电荷。随着NaCl浓度的增加,肌球蛋白Zeta电位的绝对值降低,这可能是由于盐离子的引入对蛋白分子表面扩散双电层产生压缩作用[25]。总体而言,添加RA后,Zeta电位的绝对值明显降低,这可能是因为肌球蛋白与RA结合后对电荷产生的的屏蔽作用,导致肌球蛋白表面负电荷数量减少,减弱了蛋白分子间的静电斥力,使得蛋白分子之间倾向于相互聚集[26]。
粒径反映了溶液体系中粒子的大小与分布,测定蛋白质粒径能直观地看出蛋白质聚集情况[27]。如图8所示,与肌球蛋白浊度的变化结果一致,在0.2 mol/L NaCl下,肌球蛋白呈难溶性的细长丝状,蛋白分子聚集成团,故粒径较大;而随NaCl浓度的升高,聚集的蛋白分子经历先解聚再进一步解离的过程,并以可溶性单体形式存在,粒径显著减小(P<0.05)。总体而言,添加RA后,蛋白粒径增加,这可能是因为RA促进了肌球蛋白表面疏水性的升高,疏水作用是蛋白质聚集现象的主要作用力,这种聚集在一定程度上影响了蛋白质分子的粒径分布。此外,肌球蛋白与RA之间的相互作用对肌球蛋白电荷的屏蔽作用降低了蛋白稳定性,也会增大其粒径。
2.8 乳化特性分析
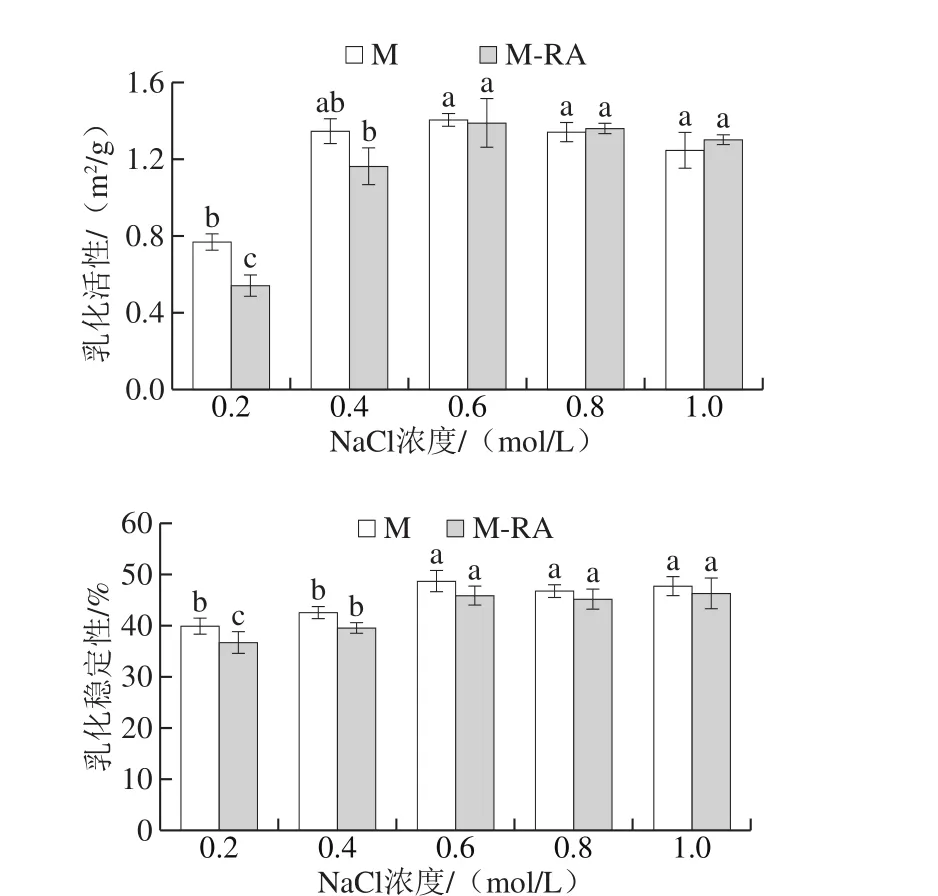
图9 不同NaCl浓度下RA对肌球蛋白乳化活性和乳化稳定性的影响Fig. 9 Effects of RA on EAI and ESI of myosin at different NaCl concentrations
在肉制品加工中,乳化性直接影响乳化肉制品的质构、黏着性、保油保水性和出品率,并对最终产品的品质起决定性作用。如图9所示,当NaCl浓度从0.2 mol/L增加至0.6 mol/L时,两组乳化活性和乳化稳定性均呈显著增加趋势(P<0.05),当NaCl浓度高于0.6 mol/L时,两组乳化性和乳化稳定性变化不明显。溶解度是影响蛋白乳化性的重要因素,吴菊清等[28]研究表明蛋白乳化性与其溶解度呈正相关,与表面疏水性呈负相关。随NaCl浓度增加,肌球蛋白的溶解度逐渐增大,蛋白能迅速移到油水界面形成界面膜参与乳化,进而提高了乳化活性;溶解度的增加还提高了分布在油水界面的蛋白质浓度,蛋白可以更好地包裹在油滴表面,从而增强了乳化稳定性。
添加RA后,0.2~0.4 mol/L NaCl条件下,乳化活性和乳化稳定性明显降低,这可能是因为肌球蛋白RA与的相互作用导致肌球蛋白溶解度降低,故乳化能力减弱。0.6~1.0 mol/L NaCl条件下,虽然RA降低了肌球蛋白的溶解度,但乳化性没有明显差别,乳化稳定性差异也较小,这可能是因为RA的添加改变了体系的亲水亲油平衡值,使蛋白更容易在油水界面展开,从而弥补了溶解度差异带来的影响。曹云刚[29]研究发现低浓度表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)对肌原纤维蛋白乳化活性和乳化稳定性无明显影响,但高浓度EGCG显著降低了肌原纤维蛋白的乳化活性和乳化稳定性。故在实际应用中,要考虑多酚类化合物或香辛料的种类及其使用量对产品功能性质的影响[30],避免对产品品质产生不良影响。
3 结 论
本研究分析了溶液状态下肌球蛋白与RA之间的相互作用。色氨酸荧光结果表明,RA对肌球蛋白的内源荧光具有较强的静态猝灭作用,且RA与肌球蛋白主要通过疏水相互作用自发进行结合。总巯基和电泳结果表明,肌球蛋白与RA之间不存在共价交联。表面疏水性和圆二色谱结果表明,添加RA可以促进肌球蛋白结构展开,α-螺旋含量降低,更多活性基团暴露,表面疏水性增加。不同NaCl条件下,添加RA会降低Zeta电位的绝对值,导致肌球蛋白的溶解度降低,浊度和粒径增大。低盐浓度下(0.2~0.4 mol/L),添加RA降低了肌球蛋白的乳化性,中高盐浓度时(0.6~1.0 mol/L)时,RA对肌球蛋白的乳化性影响较小。
