大豆分离蛋白与单糖、双糖、多糖共价复合物的冻融特性及结构表征
2020-07-04王玉莹张安琪周国卫王喜波
王玉莹,张安琪,周国卫,王 琳,王喜波*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
大豆分离蛋白(soybean protein isolate,SPI)为蛋白质质量分数在90%以上[1],富含有多种必需氨基酸和不饱和脂肪酸的优质蛋白[2],是少数可与动物蛋白比拟的植物蛋白,由于其具有表面活性而常被用作乳化剂,但是蛋白质的乳化特性会受到外界因素的影响,当温度降低时,水相会形成尖锐冰晶会刺破油水界面膜,使乳液呈现失稳状态。
蛋白质改性是改善蛋白质的结构和功能性质的有效方法[3],化学改性由于显著效果常用作蛋白质改性,如糖基化、脱酸胺化、磷酸化、羧甲基化、共价交联等[4]。其中,糖基化改性仅通过加热不需要催化剂就能提高蛋白质的稳定性,是一种理想的改性蛋白质的方法[5]。窦超然等[6]制备的冻融稳定型糖基化SPI乳液的分层系数和出油率显著降低。孙洪蕊等[7]发现湿法糖基化能够制备抗冻融SPI复合物。Zhang Zeyu等[8]利用超声辅助提高了大豆蛋白冻融性质,明显降低了冻融循环后乳析指数(creaming index,CI)和粒径。Yu Jie等[9]利用酶改性获得不同水解度的SPI水解物,观察发现酶改性后的乳液在3 次冻融循环后蛋白没有明显的沉淀絮凝现象。Zang Xiaodan等[10]通过木瓜蛋白酶和植酸酶处理修饰的SPI可以显著提高冷冻的稳定性,并能承受多种环境因素。Chen Yebao等[11]揭示了经热诱导后,SPI纳米颗粒形成稳定Pickering乳液的冻融稳定性的重要性。
综上,目前关于SPI与多糖共价复合物冻融性质的研究较多,但对SPI与单糖和双糖共价复合物冻融性质研究鲜有报道。本实验在前人研究的基础上,比较分析SPI与单糖、双糖、多糖共价复合物在冻融循环后的功能稳定性并优化出最佳反应条件,以期寻求制备冻融稳定型糖基化SPI的最佳工艺为冷冻产品提供新的技术思路。
1 材料与方法
1.1 材料与试剂
葡萄糖(glucose,G) 上海国药集团化学试剂有限公司;麦芽糖(maltose,M) 北京化学试剂厂;葡聚糖(dextran,D) 国药集团化学试剂有限公司;九三大豆油 市售;其他试剂均为分析纯。
1.2 仪器与设备
FJ200高速分散均质机 上海沪析实业有限公司;AVP-1000型高压均质机 德国APV公司;F-2700荧光分光光度计 上海棱光技术有限公司;TU-1800型紫外-可见分光光度计 上海菁华分析仪器公司;Nicolet is5傅里叶变换红外光谱仪 上海力晶科学仪器有限公司;Mr-90恒温磁力搅拌器 华北试验仪器厂;MS104TS分析天平上海右一仪器有限公司;FDU-1200冷冻干燥机 深圳市科力易翔仪器设备有限公司;数显型恒温水浴锅上海硕光电子科技有限公司。
1.3 方法
1.3.1 SPI提取
参考Sorgentini等[12]采用碱溶酸沉法提取,凯氏定氮法测定SPI蛋白质量分数为90.23%。
1.3.2 糖基化SPI的制备
将SPI分别与G、M、D按一定质量比(1∶1、2∶1、3∶1、4∶1、5∶1)溶解于0.01 mol/L pH 7.0磷酸盐缓冲液,配成一定蛋白质量分数(2%、3%、4%、5%、6%)的溶液,室温搅拌4 h后,加入微量叠氮化钠防止滋生微生物并于4 ℃冰箱中过夜。取不同样品溶液于水浴锅(60、70、80、90、100 ℃)反应(1、2、3、4、5 h),反应结束后,样品置于冰水浴冷却10 min使反应停止,然后样品在2 000 r/min离心20 min,取上清液于蒸馏水中透析24 h,冷冻干燥备用。共价复合物分别为SPI-G、SPI-M、SPI-D。
1.3.3 乳化性测定
参考Perace等[13]方法,略有改进。用0.1 mol/L pH 7.0的磷酸盐缓冲溶液溶解样品,取30 mL样品和10 mL大豆油混合,置于高速乳化机,在11 000 r/min均质1 min以形成乳浊液,分别在0 min与10 min从底部吸取100 μL加入10 mL(0.1%)SDS中,于500 nm波长处测定吸光度,以0.1% SDS溶液为空白。乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsifying stability index,ESI)计算公式如下:
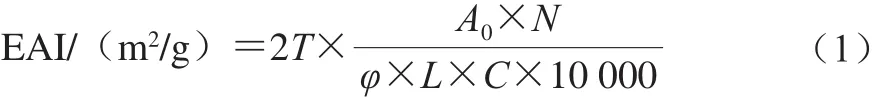
式中:T为2.303;A0为第0分钟时的吸光度;N为稀释倍数(100);φ为体系中油相所占的体积分数(0.25);C为蛋白质质量浓度/(g/mL);L为比色池光径(1 cm)。

式中:A0为第0分钟时的吸光度;A10为第10分钟时的吸光度;∆T为时间差10 min。
1.3.4 高压均质制备乳液工艺
用磷酸盐缓冲溶液(10 mmol/L,pH 7.0)溶解样品SPI-G、SPI-M、SPI-D,并加入体积分数10%~30%的大豆油,置于高速乳化机,在11 000 r/min处理3 min形成粗乳液,然后高压均质(60 MPa)处理得微乳液。加入0.02%的叠氮化钠,防止微生物污染。
1.3.5 冻融处理
将新制备的样品乳液20 mL转移到具塞试管内,-20 ℃冰箱中冷冻储存22 h,取出后于20 ℃水浴解冻2 h[14],取部分样品进行冻融稳定性分析,如此循环3 次冻融。
1.3.6 CI测定
经冻融处理后乳液分层。用刻度尺量取底部透明或浑浊的乳清层高度与乳液总高度,乳液的冻融性质CI表示[15]。CI计算如式(3)所示:

式中:HS为乳清层高度/cm;HT为乳液总高度/cm。
1.3.7 出油率测定
参考Palanuwech等[16]方法,略有改进。将1 000 g大豆油与0.015 g苏丹III充分混合,苏丹III油溶液与乳液按质量比4∶1精确放入离心管内混匀,10 000 r/min离心20 min后于508 nm波长处测吸光度,以大豆油为空白。出油率计算如式(4)所示:

式中:φ为出油率/%;m0为苏丹III油溶液质量;me为乳液质量;a为苏丹III油溶液吸光度与离心后苏丹III油溶液吸光度的比值;φd为乳液中油相的质量分数/%。
1.3.8 接枝度测定
将样品SPI-G、SPI-M、SPI-D配制成4 mg/mL的样品溶液,取200 μL样品溶液加入到4 mL邻苯二甲醛溶剂[17],混匀后于35 ℃水浴中保温反应2 min,以邻苯二甲醛溶剂试剂作空白,在340 nm紫外波长处测定吸光度,接枝度计算如式(5)所示:

式中:DG为接枝度/%;A0为接枝反应前吸光度;A1为接枝反应后吸光度。
1.3.9 傅里叶变换红外光谱测定
取适量冷冻干燥后的样品与一定量溴化钾混合,研磨成粉末后压成薄片,设置分辨率为4 cm-1,扫描次数32 次,随后用傅里叶变换红外光谱仪进行全波段(4 000~400 cm-1)扫描[18]。
1.3.10 荧光光谱测定
用磷酸盐缓冲溶液(10 mmol/L,pH 7.0)将样品SPI-G、SPI-M、SPI-D配制成蛋白质质量分数为0.5%的样品溶液,设置激发波长347 nm,发射波长扫描范围375~550 nm[19]。然后用0.01 mol/L pH 7.0磷酸盐缓冲液稀释20 倍使其质量分数为0.025%,设置激发波长290 nm,发射波长扫描范围300~400 nm。激发和发射的狭缝均为5.0 nm,扫描速率240 nm/min[20]。
1.4 数据处理
2 结果与分析
2.1 共价复合物制备工艺优化
2.1.1 反应温度对反应产物冻融稳定性的影响
在SPI与糖的质量比2∶1、反应时间3 h、蛋白质量分数4%条件下,研究反应温度对SPI-G、SPI-M、SPI-D乳化性和1、2、3 次冻融循环后CI的影响。
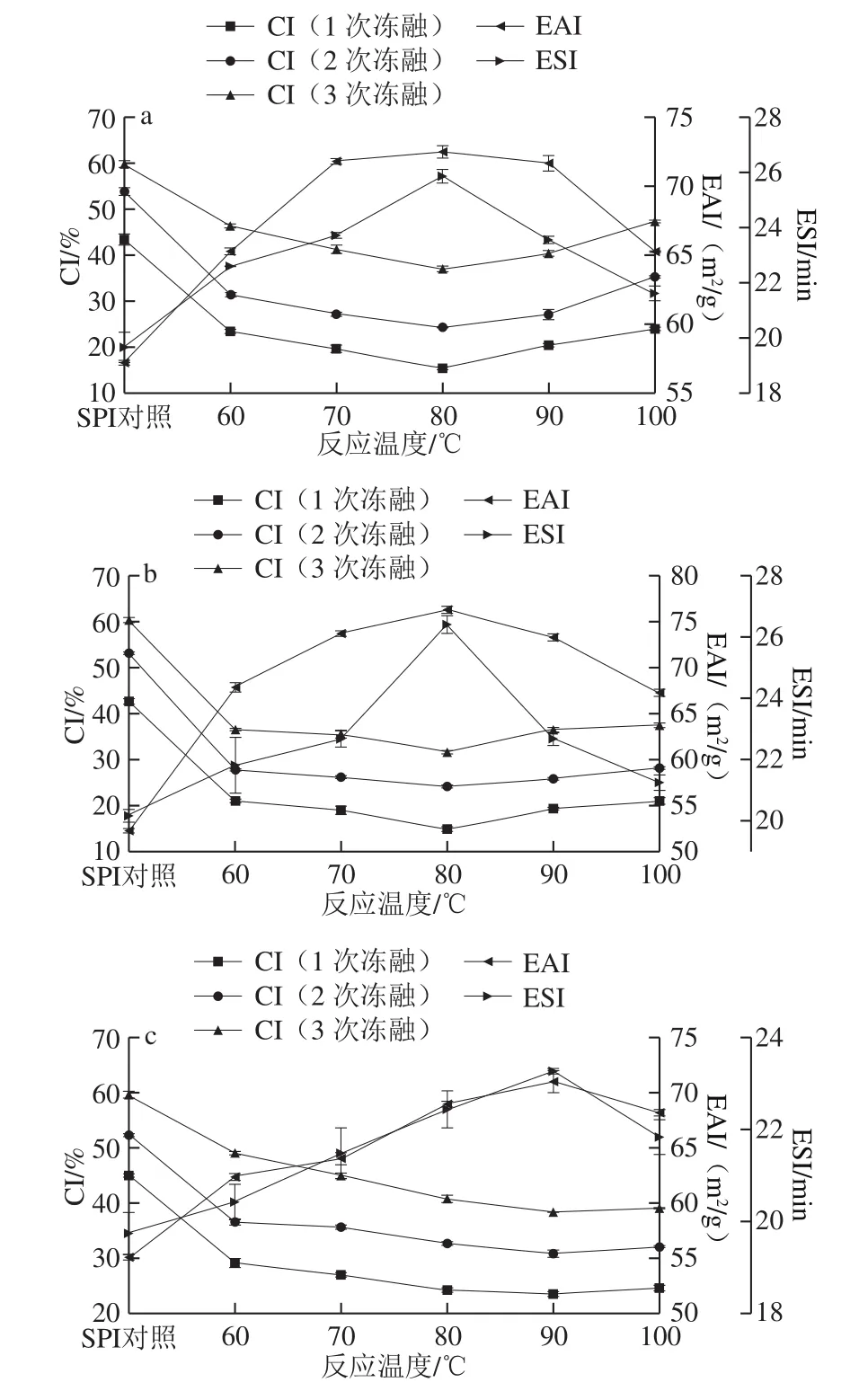
图1 反应温度对SPI-G(a)、SPI-M(b)、SPI-D(c)乳化性和CI的影响Fig. 1 Effect of reaction temperature on the emulsifying activity and creaming index of SPI-G (a), SPI-M (b), and SPI-D (c)
研究表明,温度能够提高美拉德反应速率,加快反应进程[21]。乳化性是蛋白质作为功能性食品配料应用于冷冻食品中的一项重要的功能性质[22],从图1a、b可知,EAI和ESI都随着温度的升高而上升,并均在80 ℃达到最大。从图1c可知,SPI-D的EAI和ESI也呈增大趋势,并在90 ℃达到最大。这是因为在一定范围内增加温度,蛋白质的肽链展开,增加了游离氨基数量,进而提高了与糖的结合几率,增加反应效率。但随着温度进一步升高,乳化性显著降低,可能是因为加热温度过高,蛋白质严重变性[23]。CI是表明乳液冻融稳定性的一个重要指标,CI越低,乳液状态越稳定[24]。如图1所示,温度逐渐升高,CI先减小后增大。SPI-G和SPI-M在80 ℃显示了最低的CI,SPI-D在90 ℃显示了最低的CI,但与80 ℃时的CI相差不大。这是因为温度升高,促进接枝反应,糖包裹了蛋白形成立体网络,提高了接枝物对外界环境的抵抗力[25]。综合比较,SPI-M的乳化性升高幅度和CI降低程度,均高于SPI-G和SPI-D。这可能是由于糖的分子结构有所不同,形成不同的空间位阻。考虑到反应温度过高时蛋白质会变性,选择80 ℃作为反应温度进行后续研究。
2.1.2 反应时间对反应产物冻融稳定性的影响
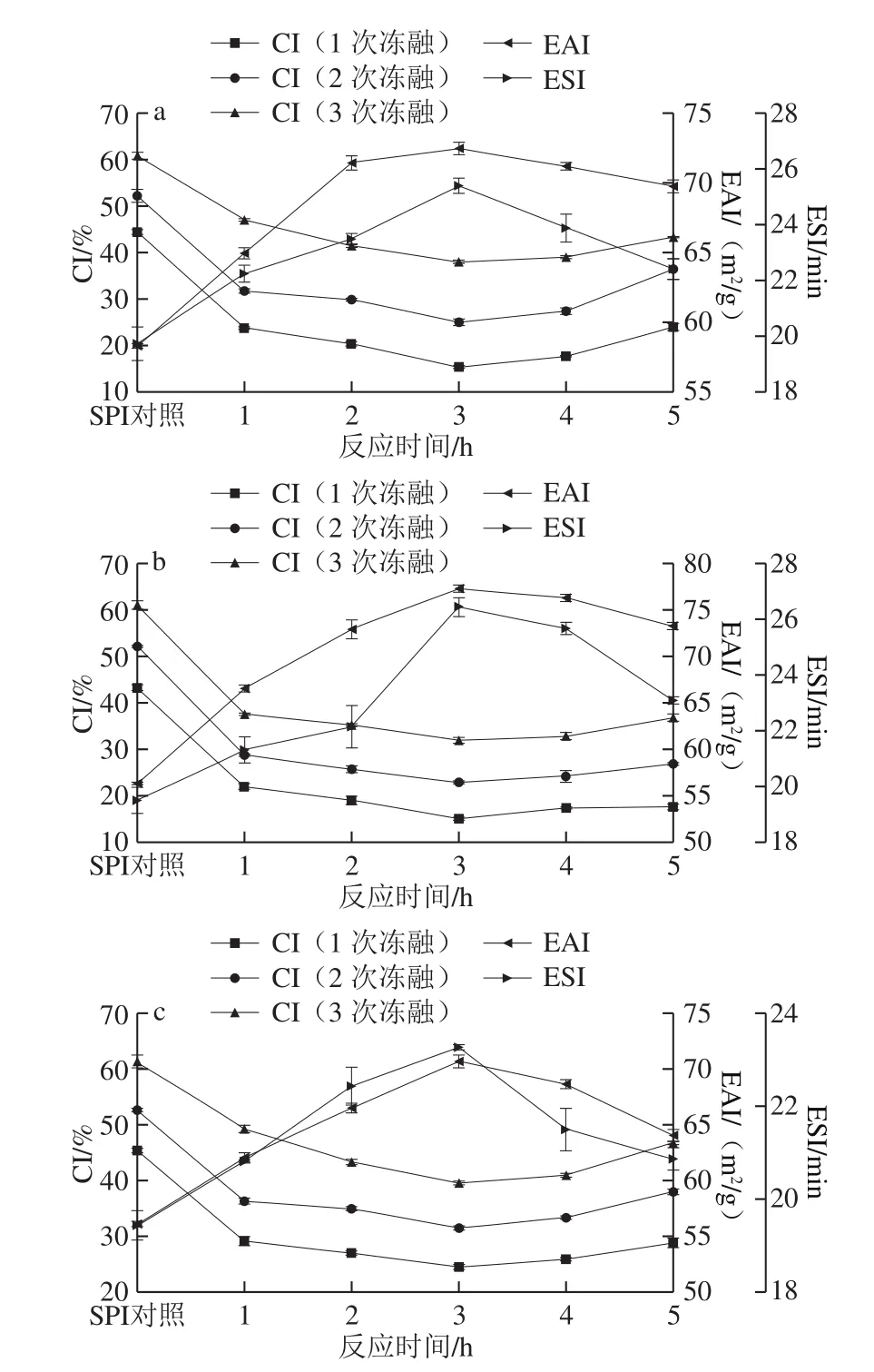
图2 反应时间对SPI-G(a)、SPI-M(b)、SPI-D(c)乳化性和CI的影响Fig. 2 Effect of reaction time on the emulsifying activity and creaming index of SPI-G (a), SPI-M (b), and SPI-D (c)
在SPI与糖的质量比2∶1、反应温度80 ℃、蛋白质量分数4%条件下研究反应时间对SPI-G、SPI-M、SPI-D乳化性和1、2、3 次冻融循环后CI的影响。
由图2可知,随着反应时间的延长SPI-G、SPI-M、SPI-D的EAI和ESI均呈现先上升后下降的趋势,反应时间为3 h时最大。可能是因为反应时间延长,使得维持蛋白质结构的次级键被破坏,肽链变得疏松,SPI的溶解度增加,促进了接枝反应,增加了SPI的表面活性[26]。而反应时间过长,暴露更多疏水基团,促使蛋白质重新聚集,使接枝物的EAI和ESI降低。如图2所示,CI随加热时间的延长,逐渐降低而又上升,同样是在反应3 h表现出最好的冻融性质,可能是因为加热时间过长,糖过度引入,疏水基团增多,蛋白质聚集,失去亲水亲油平衡,破坏稳定的界面膜,使接枝物的CI降低[27]。综合来看,SPI-M的冻融性质均好于SPI-G和SPI-D。结合考虑能源损耗,最终选择反应时间3 h进行后续研究。
2.1.3 蛋白质量分数对反应产物冻融稳定性的影响

图3 蛋白质量分数对SPI-G(a)、SPI-M(b)、SPI-D(c)乳化性和CI的影响Fig. 3 Effect of protein concentration on the emulsifying activity and creaming index of SPI-G (a), SPI-M (b), and SPI-D (c)
在SPI与糖的质量比2∶1、反应时间3 h、反应温度80 ℃条件下研究蛋白质量分数对SPI-G、SPI-M、SPI-D乳化性和1、2、3 次冻融循环后CI的影响。
由图3可知,随着蛋白质量分数的增大,接枝物的EAI和ESI同样出现先升高又下降的趋势,在蛋白质量分数达4%时,SPI-G、SPI-M、SPI-D的乳化性最优,其中SPI-M乳化性最好。可能是因为SPI浓度的上升提高了蛋白质分子与糖分子的碰撞机会,促进美拉德反应的发生,提高了乳化性,但随着蛋白质量分数的进一步提高,导致溶液黏度增大、流动缓慢,进而阻碍了接枝反应的发生[7]。SPI-G、SPI-M、SPI-D接枝物的CI均随蛋白质量分数的增加而呈现先下降后上升的趋势,并在4%时冻融性质最佳,SPI-M的下降幅度最大。可能是因为蛋白质量分数越大,反应效率越高,但蛋白质量分数过大,蛋白与糖的空间位阻变大,降低碰撞几率,不利于接枝反应的发生进而使乳液的冻融稳定性下降[28]。考虑到反应程度及经济问题,选择蛋白质量分数4%进行后续研究。
2.1.4 SPI与糖质量比对反应产物冻融稳定性的影响
在反应温度80 ℃、反应时间3 h、蛋白质量分数4%条件下研究SPI与糖质量比对SPI-G、SPI-M、SPI-D乳化性和1、2、3 次冻融循环后CI的影响。
SPI和糖的美拉德反应是基团之间特定的交联反应,一定的比例不仅可以提高反应的进程,而且能降低副反应的发生[7]。由图4a、b可知,在蛋白质量分数一定的情况下,随着G、M比例的减少,接枝物的EAI呈明显上升趋势,ESI与EAI变化趋势基本一致,这是因为引入适量的糖,亲水基团的增多使产物的极性增加,继而提高溶解性,增加界面活性,所以提高了产物的乳化活性[29]。但随着糖比例进一步降低,蛋白质与糖接枝物的乳化性逐步降低。由图4c可知,D的添加会提高SPI-D的乳化性,仅质量比1∶1时有明显变化,随糖的比例减少,下降趋势明显,这是因为D分子质量大,迁移速率缓慢,醛基浓度太低,较少的糖不足以与蛋白充分发生反应。虽然接枝物的乳化性都有提高,但SPI-G、SPI-D的升高幅度远小于SPI-M,这可能是由于G、M、D内部结构不同,M更易于与SPI结合。图4中接枝物的CI均随着糖的引入而呈现降低的趋势,这是因为糖有增稠作用,增加了乳液中未冻结水的含量,提高了水相的黏度,增强了膜的厚度,降低了对外界环境的敏感度进而提高产物冻融稳定性[22],但仍是SPI-M在SPI与糖质量比4∶1表现出最好的冻融性质。考虑到改性应当以SPI为主体并分析考虑了乳化性、CI及经济问题,选取SPI-G、SPI-M、SPI-D分别在SPI与糖质量比3∶1、4∶1、1∶1为最佳反应参数。

图4 SPI与糖质量比对SPI-G(a)、SPI-M(b)、SPI-D(c)乳化性和CI的影响Fig. 4 Effect of mass ratio between SPI and sugar on the emulsifying activity and creaming index of SPI-G (a), SPI-M (b), and SPI-D (c)
2.2 共价复合物的性质分析
不同改性产物制备的最佳单因素组合条件:SPI-G的制备条件为反应温度80 ℃、反应时间3 h、蛋白质量分数4%、SPI与G质量比3∶1;SPI-M的制备条件为反应温度80 ℃、反应时间3 h、蛋白质量分数4%、SPI与M质量比4∶1;SPI-D的制备条件为反应温度90 ℃、反应时间3 h、蛋白质量分数4%、SPI与D质量比1∶1。在此条件下平行实验同时设对照组。
2.2.1 美拉德反应产物的出油率分析
乳液冻融后的不稳定作用使部分脂肪游离,通过出油率可以测定乳液的稳定性,出油率越低,乳液越稳定[30]。由图5可知,随着冻融次数的增加,SPI的出油率急剧增加。接入糖之后出油率显著下降,可能是因为糖的加入,使溶液得极性增加,静电斥力变大,减少了脂肪的聚集。经过3 次冻融循环后,与SPI相比,SPI-G的出油率分别降低了4%、16%、22%;SPI-M的出油率分别降低了4.8%、16.8%、22.6%;SPI-D的出油率分别降低了2%、12%、17%。优化后的产物乳化性能较好,但仍是SPI-M比SPI-G和SPI-D稳定,说明优化的反应参数能够提高改性产物的冻融稳定性。

图5 SPI及SPI-G、SPI-M、SPI-D冻融循环3 次的出油率Fig. 5 Oiling off of SPI, SPI-G, SPI-M, and SPI-D after one, two and three freeze-thaw cycles
2.2.2 共价复合物的接枝度分析

图6 SPI-G、SPI-M、SPI-D的接枝度Fig. 6 Degrees of grafting of SPI-G, SPI-M, and SPI-D
对于蛋白,接枝表示在氨基侧链的活性基团引入糖分子的侧链,使复合物表现出糖的亲水特性,水溶性增加,一定程度上改善了蛋白质的功能特性[31]。SPI与糖形成共价复合物的比率通过接枝度体现。由图6可知,SPI-M的接枝度明显高于SPI-G和SPI-D的接枝度,SPI-G和SPI-D的接枝度分别为24.23%和17.5%,而SPI-M的接枝度最高,达到27.2%。可能是因为不同种类的糖结构不同,而M更易与SPI发生反应。
2.2.3 共价复合物的傅里叶变换红外光谱分析
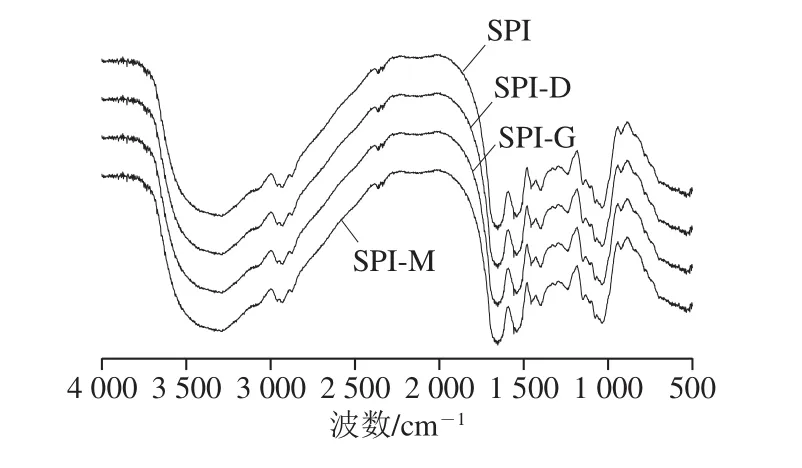
图7 SPI及SPI-G、SPI-M、SPI-D傅里叶变换红外光谱图Fig. 7 Fourier transform infrared spectra of SPI and SPI-G,SPI-M, and SPI-D
大豆蛋白与糖的共价复合改性是将糖分子以共价键的形式接入到SPI分子中,其特征是羟基的引入[26],在傅里叶变换红外扫描特征吸收上体现为在波数为3 700~3 200 cm-1处有一个较宽的伸缩振动峰,CO键在波数1 260~1 000 cm-1处也出现较强的振动[32-33]。由图7可知,复合物SPI-G、SPI-M、SPI-D均在3 700~3 200 cm-1处的吸收峰变宽,说明美拉德反应发生后,羟基数量增加,引起了振动吸收。同时反应产物在1 260~1 000 cm-1处吸收峰明显增强,表明C—N数量增加。并且SPI-G、SPI-M、SPI-D的吸收振动均强于SPI,其中SPI-M相较于SPI-G和SPI-D复合物,具有更强的吸收振动。蛋白质的二级结构影响蛋白质分子构象的稳定性,由表1可知,反应产物与SPI相比,α-螺旋含量减少,β-转角含量增加,说明蛋白质从有序向为无序状态转变,提高了分子的柔性,其中SPI-M的二级结构改变最大,SPI-D的二级结构改变最小。综上,证明了SPI与糖是以共价键的方式结合发生美拉德反应,改善了复合物的冻融稳定性。

表1 SPI及SPI-G、SPI-M、SPI-D二级结构含量Table 1Secondary structure contents of SPI and SPI-G, SPI-M, and SPI-D%
2.2.4 共价复合物的荧光强度分析

图8 SPI及SPI-G、SPI-M、SPI-D在激发波长347 nm(a)和290 nm(b)的荧光光谱图Fig. 8 Fluorescence spectra of SPI and SPI-G, SPI-M, and SPI-D at excitation wavelengths of 347 nm (a) and 290 nm (b)
美拉德反应特征荧光物质的典型荧光光谱为激发波长在320~370 nm处时,发射波长在420~440 nm范围内有最大的荧光强度[34]。如图8a所示,激发波长为347 nm进行扫描,SPI在451.6 nm波长处有最大荧光强度,而SPI-G、SPI-M、SPI-D复合物分别在431.6、429.6 nm和433.6 nm波长处有最大荧光强度,λmax向短波长方向移动,发生了蓝移,并且复合物的荧光强度均高于SPI,表明发生了美拉德反应。色氨酸主要影响SPI的内源荧光,对环境的变化非常敏感,因此较快反映蛋白质的构象变化[35]。如图8所示,激发波长为290 nm进行扫描,复合物与SPI相比,λmax均向长波长方向移动,发生了不同程度的红移,并且可明显看出SPI-M复合物的红移程度比SPI-G和SPI-D更大,表明SPI与M发生更深程度的美拉德反应,暴露了更多的色氨酸残基,使其极性增加。
3 结 论
本实验以乳化性和CI为指标,分别对SPI与G、M、D的接枝反应条件进行优化,得出SPI-G、SPI-M、SPI-D复合物最佳反应参数分别为:反应温度80 ℃、反应时间3 h、蛋白质量分数4%、SPI与G质量比3∶1;反应温度80 ℃、反应时间3 h、蛋白质量分数4%、SPI与M质量比4∶1;反应温度90 ℃、反应时间3 h、蛋白质量分数4%、SPI与D质量比1∶1。优化的SPI-G的EAI和ESI分别为对照品的1.22 倍和1.29 倍,经过3 次冻融循环后,CI分别降低了28.03%、26.50%、22.84%;优化的SPI-M的EAI和ESI分别是对照品的1.41 倍和1.29 倍,经过3 次冻融循环后,CI分别降低了28.03%、28.30%、29.57%;优化的SPI-D的EAI和ESI分别为对照品的1.26 倍和1.19 倍,经过3 次冻融循环后,CI分别降低了20.9%、20.81%、24.55%,发现无论从冻融稳定性还是经济能源方面,SPI-M的性质均好于SPI-G和SPI-D。
出油率分析表明优化后的美拉德反应产物冻融性质显著提高;接枝度分析表明SPI与M形成共价复合物的比率明显高于SPI与G和D形成共价复合物的比率;傅里叶变换红外光谱分析表明糖分子以共价键的形式接入到SPI分子中;荧光分析表明蛋白结构发生改变。本实验优化出湿热条件下SPI与单糖、双糖、多糖共价复合物最佳反应条件,提高了SPI的冻融稳定性,并降低改性温度、节约了能源,降低糖的添加,减少了成本,为冷冻食品提供新的技术依据。
