口腔鳞癌中NF-κBp65、IL-6表达与巨噬细胞极化的关系
2020-06-30钱娴娴冯红超宋宇峰
钱娴娴 冯红超 宋宇峰
超过80%的口腔颌面部恶性肿瘤为口腔鱗状细胞癌(oral squamous cell carcinoma,OSCC),尽管目前有一系列综合治疗方法,如放化疗、手术治疗、基因治疗等,但OSCC的长期疗效仍不能令人满意[1]。因此,OSCC的早期诊断及分子靶向治疗是必要的。研究表明,肿瘤自身分泌的炎症因子可能刺激核因子-κB(nuclear factor kappa B,NF-κB)通路的持续激活,促进OSCC的转移[2]。自1999 年以来,Duffey等[3]研究发现头颈部鳞癌的癌细胞能够自分泌白介素-6(Interleukin-6,IL-6),并且IL-6基因中包含NF-κB家族核转录因子的结合位点。学者们还发现,肿瘤相关巨噬细胞(Tumor associated macrophages,TAMs)与肿瘤的侵袭、转移密切相关。为探讨在OSCC中NF-κB、IL-6的表达及其二者与巨噬细胞表型极化的关系,本研究应用免疫组化SP法对15 例正常组织及42 例OSCC组织中NF-κBp65、IL-6的表达及CD68+、CD163+巨噬细胞的浸润进行了检测。
1 资料与方法
1.1 基本资料
收集贵阳市口腔医院及贵州医科大学附属医院2015~2016 年临床资料完整的正常组织15 例、OSCC标本42 例。纳入、排除标准:OSCC患者均经病理确诊,术前未接受放、化疗等治疗,正常组织取自癌旁2.0 cm外的黏膜组织。OSCC患者女性11 例、男性31 例,年龄25~78 岁,平均60.38 岁,无淋巴结转移17 例,有淋巴结转移25 例,中分化及低分化共16 例,高分化26 例。本研究由伦理委员会审查批准,所有患者签署了知情同意书。
1.2 方法
1.2.1 检测方法 4%中性甲醛固定标本,常规石蜡包埋,4 μm连续切片,脱蜡,水化,EDTA高压抗原修复,添加一抗在4 ℃孵育过夜,染色。NF-κB p65小鼠抗人单克隆抗体(稀释度1∶300)、IL-6小鼠抗人单克隆抗体(稀释度1∶200)(北京博奥森生物技术有限公司);CD68小鼠抗人单克隆抗体(稀释度1∶75)、CD163小鼠抗人单克隆抗体(稀释度1∶80)、SP免疫组织化学试剂盒、二氨基联苯胺(DAB)显色、苏木精复染液(北京中杉金桥生物技术有限公司);严格按照试剂盒说明书方法并在相同条件下进行染色,磷酸盐缓冲液(PBS)代替一抗作阴性对照。
1.2.2 结果判定 2 名病理医师协助观察染色结果,综合染色强度及阳性细胞数百分比进行判定,NF-κBp65阳性染色为细胞核或细胞质呈现棕黄色细小颗粒,IL-6阳性染色显示为细胞质呈现棕黄色细小颗粒,高倍镜(×400)下每张切片观察10 个视野(每个视野约100 个肿瘤细胞),分别观察计分,阳性细胞数<10%计1 分,2 分(11%~50%),3 分(50%~75%),>75%计4 分;染色强度评分:无色0 分,浅色1 分,棕黄色2 分,棕褐色3 分,然后根据乘积分数分4 个等级:0~2 分(-),3~4 分(+),6~8 分(++),9~12 分(+++),分数≥3为阳性、<3为阴性。CD68+巨噬细胞阳性染色显示细胞质有棕黄色细小颗粒,CD163+巨噬细胞阳性染色显示细胞膜呈现棕黄色细小颗粒,在高倍镜下观察5 个非重叠的间质及癌巢,并计数阳性细胞。
1.3 统计方法

2 结 果
2.1 在OSCC及正常组织中NF-κBp65、IL-6的表达及CD68+、CD163+巨噬细胞的浸润情况
在OSCC组织中,NF-κBp65、IL-6的表达及CD68+、CD163+巨噬细胞的浸润数量高于正常组织,且差异具有统计学意义(P<0.05),NF-κB p65阳性染色主要分布在为细胞核或细胞质内,呈棕褐色小颗粒,IL-6阳性染色为细胞质呈现棕黄色小颗粒,NF-κB p65、IL-6在正常组织中极少量表达,CD68+、CD163+巨噬细胞的浸润主要集中在肿瘤间质内,CD68+巨噬细胞阳性染色显示细胞质有棕黄色细颗粒,CD163+巨噬细胞阳性染色显示细胞膜有棕黄色小颗粒,CD68+、CD163+巨噬细胞在正常组织中少量表达(图1、表1)。
2.2 OSCC中NF-κBp65、IL-6的表达及CD68+、CD163+巨噬细胞的浸润与临床病理资料的关系
在OSCC中,NF-κBp65、IL-6的表达及CD68+、CD163+巨噬细胞的浸润数量均与患者年龄、性别无关(P>0.05);在有淋巴结转移组中NF-κBp65的表达、CD68+及CD163+巨噬细胞的浸润高于无淋巴结转移组(P<0.05);CD68+巨噬细胞在中低分化组的浸润数量高于高分化组(P<0.05);在不同分化组中,NF-κBp65及IL-6的表达、CD163+巨噬细胞的浸润数量差异无统计学意义(P>0.05)(表2~3)。
2.3 OSCC中NF-κBp65、IL-6的表达及CD68+、CD163+巨噬细胞浸润数量的相关性
NF-κBp65与IL-6的表达呈正相关(r=0.316,P=0.041),CD68+巨噬细胞与CD163+巨噬细胞的浸润数量呈正相关(r=0.590,P=0.000);NF-κBp65的表达与CD68+、CD163+巨噬细胞的浸润数量均呈正相关(r=0.746,P=0.000;r=0.491,P=0.001);IL-6的表达与CD68+巨噬细胞的浸润数量呈正相关(r=0.336,P=0.029)。

图1 OSCC及正常组织中NF-κBp65、IL-6的表达及CD68+、CD163+巨噬细胞的浸润 (×400)Fig 1 Expression of NF-κBp65,IL-6 and infiltration of CD68+,CD163+ macrophages in OSCC and normal tissues (×400)
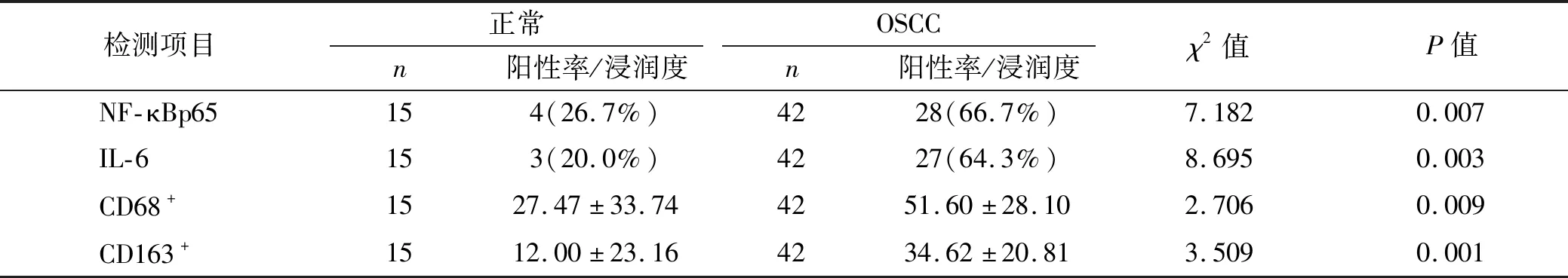
表1 OSCC及正常组织中NF-κBp65、IL-6的表达及CD68+、CD163+巨噬细胞的浸润Tab 1 Expression of NF-κBp65,IL-6 and infiltration of CD68+,CD163+ macrophages in OSCC and normal tissues

表2 OSCC中NF-κBp65、IL-6的表达与临床病理资料的关系 [n(%)]Fig 2 Relationship between the expression of NF-κBp65,IL-6 in OSCC and the clinicopathologic parameters [n(%)]

表3 OSCC中CD68+及CD163+巨噬细胞的浸润数量与临床病理资料的关系Tab 3 Relationship between the CD68+,CD163+ macrophages infiltration in OSCC and the clinicopathologic parameters
3 讨 论
目前通过研究肿瘤标志物在OSCC中的表达来了解OSCC发生发展已成为研究热点。已有研究发现靶向肿瘤细胞表达的NF-κB可以诱导抗肿瘤免疫应答[4],显示NF-κB可能是OSCC治疗的有效靶标;还有研究表明对巨噬细胞特异性治疗具有明显效果[5],所以以TAMs极化调节为靶点的抗肿瘤免疫治疗具有可行性;IL-6的高表达与患者的不良预后也具有相关性,所以IL-6被提议作为一种检测恶性肿瘤的诊断标志物也具有可行性。
NF-κB是真核转录因子结构相关的蛋白家族,包括5个成员,即RelA(p65)、RelB、c-Rel、p50(NF-κB1)、p52(NF-κB2)。其中p65(RelA)能发挥转录激活功能,是NF-κB主要的功能蛋白。异常激活NF-κB通路会导致多种疾病发生,例如慢性炎症、自身免疫性疾病、肿瘤等[6]。通常,NF-κBp65结合IκB抑制蛋白存在于细胞质中,在通路被外界刺激(射线、机械刺激等)或内部信号(炎症因子、化学因子等)激活下,发生磷酸化并降解,NF-κBp65进入细胞核并结合相应的靶序列,在肿瘤抗凋亡机制中起重要作用[7]。因此,IκB的磷酸化和p65核转位是NF-κB激活的标志。本研究中,NF-κBp65在OSCC组织的细胞质及细胞核中均有表达,在细胞核中有明显的阳性表达,特别是在有淋巴结转移的OSCC中,呈现深褐色表达。在NF-κB的经典激活途径中,上游信号磷酸化IKK复合物并激活IKKα/β,且磷酸化IκBα,并发生泛素化,随后NF-κB核转位,还与核内靶基因启动子区域的κB序列结合,从而发挥调节作用。在旁路激活途径中,p100在诱导激酶(NIK)和IκBα的作用下,被降解为其活性衍生物p52,并且与RelB结合以调控基因的转录。早期有学者已经提出癌症中IKK-NF-kB途径的上游组分突然变化或肿瘤微环境中的促炎刺激可能活化NF-κB信号传导途径[8]。
IL-6是一种多功能细胞因子,可调节癌症的多种信号通路(例如细胞增值和凋亡、血管生成、侵袭和转移),促进肿瘤发生[9]。在前列腺癌中,IL-6可通过磷脂酰肌醇激酶-蛋白激酶途径来促NF-κB激活[10]。
巨噬细胞可分化为两种类型:M1型(抗炎)和M2型(促肿瘤浸润、转移、血管生成)[11]。TAMs即浸润在肿瘤组织及其周围的巨噬细胞,目前认为TAMs的功能更偏向于M2型巨噬细胞[12]。CD68是巨噬细胞的标志,而M2型巨噬细胞则高表达CD163、CD206等,在本研究中,CD163用于标记M2型巨噬细胞、CD68用于标记巨噬细胞。本课题组前期研究显示:OSCC中存在大量巨噬细胞浸润,且TAMs可通过分泌VEGF、VEGF-C来促进肿瘤的生长和转移[13]。
本研究结果显示:NF-κBp65、IL-6、CD68+及CD163+巨噬细胞在OSCC中有明显的高表达或高浸润,与多数研究结果相似,提示四者的异常表达或浸润可能与OSCC的发生发展有关。同时在对照组中未见NF-κBp65的表达增高,提示NF-κBp65在OSCC中有较强的活性。在OSCC淋巴结转移组中,NF-κBp65的表达、CD68+及CD163+巨噬细胞的浸润均高于无淋巴结转移组,由此推测,三者表达升高可能与OSCC的淋巴结转移、侵袭能力成正相关。CD68+巨噬细胞的浸润数量和OSCC分化程度有关,显示出在中、低分化的OSCC中,肿瘤微环境中的巨噬细胞会更多的聚集,炎性细胞高水平浸润对肿瘤的发展起到很大作用。NF-κBp65、IL-6的表达、CD163+巨噬细胞的浸润和分化程度无关,可能因样本量较少或癌组织的组织学分级比例不同导致;有研究表明,多种细胞或病毒的癌蛋白可激活NF-κB,其作为联系炎症与癌症的桥梁,可通过炎症反应来参与细胞的癌变[14],IL-6也可调节癌细胞增殖来促肿瘤发生,由此本研究推测NF-κB和IL-6可能与癌变有关而与癌变后的肿瘤分化无关,不过这还需增大样本量后进一步验证。CD163+巨噬细胞与CD68+巨噬细胞浸润的差异较小,说明在OSCC中,TAM多表达为M2型巨噬细胞,与多数研究结果一致。
本研究中NF-κBp65与IL-6的表达呈正相关,表明NF-κB表达增加可能导致IL-6的高表达,反过来,IL-6高表达亦可能会促进NF-κB通路的激活。已发现IL-6的5'端启动子序列含有NF-κB家族转录因子结合位点,IL-6是重要的NF-κB依赖性细胞因子之一,也就是说,IL-6是受NF-KB调控的靶分子[15]。NF-κBp65的表达和CD68+、CD163+巨噬细胞的浸润呈正相关,提示NF-κB信号通路可能参与了巨噬细胞表型极化的过程,这与以往研究结果相似[16]。IL-6的表达与CD68+巨噬细胞的浸润数量呈正相关,IL-6R是传递IL-6 信号的唯一受体,而TAMs表面存在IL-6受体,IL-6与巨噬细胞表型极化相关[15]。
综上所述,本研究推测OSCC中NF-κB、IL-6的高表达和M2型巨噬细胞的高浸润可能促进肿瘤的侵袭与转移,三者在肿瘤的发生发展中可能起相互促进作用,NF-κB和IL-6可能参与了巨噬细胞的表型极化过程;猜测可以通过改变IL-6的分泌量来影响NF-κB信号途径的激活从而调节巨噬细胞极化表型来对抗肿瘤免疫治疗,至于IL-6激活NF-κB信号通路、激活的NF-κB产生IL-6以及调节巨噬细胞表型极化的作用机制仍需扩大样本量后进行深入研究。
