白菜花器官脱落过程的BcAZPG1表达研究
2020-06-28韦俊涛陈凌云
韦俊涛,陈凌云
(浙江农林大学农业与食品科学学院,杭州 310000)
在自然界中,植物细胞的生长受动态平衡的调节[1,2],脱落是植物脱落多余器官的过程。离区发育是植物完成生活周期的重要组成部分,精确调控的细胞分离是离区发育的重要特征之一,果胶是细胞壁多糖的重要组成成分,其降解在离区发育中起到重要作用[3.4]。植物细胞壁的果胶降解涉及一系列酶的参与,包括多聚半乳糖醛酸酶(PGs)、果胶甲酯酶(PMEs)以及果胶裂解酶(PLLs)等[5]。已有证据表明,PG在拟南芥、番茄、油菜等多个物种的花、果荚、叶和果实等器官的离区发育过程中起到非常重要的作用。通过对离区相关发育的PG基因的功能发挥作用,能够更好的认识离区发育的分子机理以及多糖代谢的过程,对于蔬菜等农作物的产量、品质等农艺性状的了解有更重要的发展意义和实践医用价值,为今后更好的育种和栽培提供了理论依据。
1 材料与方法
1.1 实验材料
以与白菜同一亚种的‘油青四九’菜心自交系为材料(该材料只要55d即可完成整个生育周期)供转基因验证基因功能使用。采用启动子同和表达载体侵染哥伦比亚野生型的拟南芥的方法进行转化对比验证,以获得所需目标转基因植株。
1.2 RNA的提取及反转录
用Trizol法提取植物RNA,通过以下方法来检测:将电泳槽、锥形瓶、胶板、制胶用的梳子用清水清洗干净,用75%酒精浸泡3h以上,并用保鲜膜将其包牢,倒掉酒精晾干备用。重新稀释TAE缓冲液1L,注入电泳槽,并用新稀释的TAE缓冲液制备1%的琼脂糖凝胶,凝固后备用。取1.2μgRNA样品放入进口的PCR管中,加入8μL RNA Loading Buffer,并用0.1%的DEPC水补足至12μL,混匀后放在PCR仪中65℃变性5min。迅速置于冰上,点样,120V电泳15min。用凝胶成像仪观察电泳结果。质量好的RNA条带清晰,无拖尾现象,并且28S条带与18S条带亮度比值接近2:1,最后反转录成cDNA作模板。
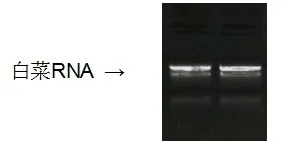
图1 白菜RNA提取结果,文中所有构建载体以此为模板Fig1 RNA extraction results from Brassica rapa,All constructed vectors in this paper used this as template.
1.3 构建启动子GUS报告基因的载体侵染拟南芥
利用获得的Bra027210基因序列,定位到白菜数据库中,根据转录方向寻找到该基因上游1500~2000bp核苷酸处,设计两对引物,引物为p027210-4Fp和p027210-4Rp(见表1),用KOD酶PCR扩增Bra027210基因序列,经过测序验证后进行大肠杆菌的转化与质粒的提取,随后用冻融法转化农杆菌GV3101,获得目标载体菌液。最后通过农杆菌介导启动子-GUS融合表达载体转化拟南芥的方法{6}来获得拟南芥T1代种子,随后通过无菌培养的方法筛选出所需转基因材料(如图2)。
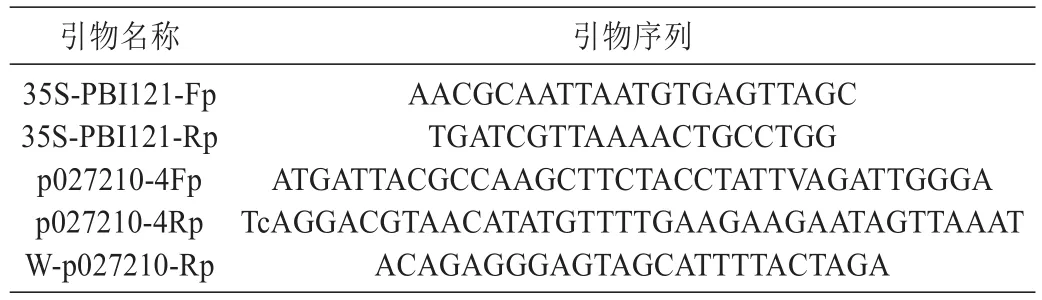
表1 试验中设计的引物序列Table 1 Primer Sequence used in this study

图2 拟南芥侵染筛选过程Fig2-The screening process of Arabidopsis thaliana infection
1.4 Bra027210启动子表达载体的拟南芥表达分析
在哥伦比亚野生型拟南芥中,用侵染的方法将Bra027210启动子表达载体导入,然后经过筛选出来的T1代,用特异物对为35S-PBI121-Fp和W-p027210-Rp来检测和筛选出阳性T1代单株,等到其生长至盛花期,用上述引物继续验证兵对不同组织器官进行GUS染色分析。GUS染色分析的方法如下:配制GUS染液(1.9 mmol·L-1 X-Gluc(Sangon,CN),20%methanol,0.5 mmol·L-1 potassium ferricyanide,0.5 mmol·L-1 potassium ferrocyanide,和 0.3%Triton X-100 in 0.2 mol·L-1 sodium phosphate buffer(pH 7.0))后,取500μl染色液到1.5 ml离心管中,将阳性单株的整簇花序在染液中浸没后,37℃放置24-36h后,用体式显微镜观察和拍照。
2 结果与分析
2.1 启动子的克隆及融合表载体的构建
将用特异引物p027210-4Fp和p027210-4Rp扩增得到的Bra027210的全长CDS序列,全长约2000bp左右,用菜心提取的DNA作为模板,经入门载体连接和LR反应后,经35S-PBI121-Fp.和35S-PBI121-Rp检测,胶图结果(图3)与预定长度相符合,将该启动子片段与经过双酶切(HindIII/XbaI)的线性载体PBI101,通过同源重组的方式获得的菌液检测结果(图3下右边)显示1-9号菌液与数据库序列匹配,经测序成功的菌液转化农杆菌后侵染拟南芥花序,用GUS染色的方式来验证其在模式植物拟南芥中的表达部位,从而确定其是否是真正控制白菜花瓣脱落的主导因子。

图3 Bra027210启动子目的片段、质粒及载体扩增结果Fig3 Amplification ofBra027210promoter target fragment,plasmid and vector
2.2 白菜花脱落相关PG基因的表达模式分析
拟南芥已成功地被用作研究植物一系列发育过程的模型系统,但很少有人对拟南芥的脱落进行研究。这主要是因为这种植物不会脱落它的叶子和失去的组织(萼片、花瓣和花药)为生化或分子分析提供了少量的离区材料。将构建好的载体用侵染方法转化到哥伦比亚野生型拟南芥中,对其进行筛选得到T1的单株,用设计的特异引物35S-PBI121-Fp和W-p027210-Rp进行验证(图4)。对p027210-PBI121载体的转基因拟南芥T1代单株在盛花期与落花期之间取一簇花序进行GUS染色分析结果表明,Bra027210的启动子能够特异的在花脱落时期启动基因的表达,它能在花脱落的特定部位表达(图5),说明Bra027210为一个在花脱落期发挥作用的多聚半乳糖醛酸酶基因。
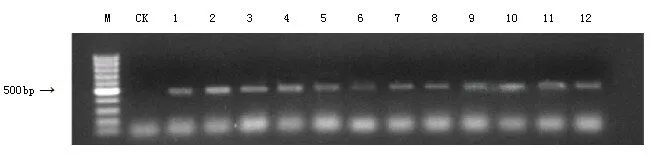

图4 Bra027210启动子载体转基因拟南芥阳性检测结果Fig4 The test results of Bra027210promoter vector transgenic arabidopsis positive

图5 Bra027210启动子载体在拟南芥中的表达情况Fig5 Bra027210Promoter Vector Expression in Arabidopsis
3 结论与讨论
为了解Bra027210基因表达的调控作用和进一步分析其表达模式,后期我们还可以通过PCR扩增对其进行检测验证。同时我们可以在后期实验中通过亚细胞定位在洋葱表皮细胞中看该基因的瞬时表达情况,来判断Bra027210是否是一个有功能的启动子,从而说明Bra027210的启动子可能是一个花脱落期间的特异启动子。本文用GUS染色的方法来验证启动子融合表达载体p027210-PBI121:GUS的转基因拟南芥植株,分析研究表明,GUS能够在特定的花器官脱落的时期在特定的部位有表达信号。进一步分析结果表明,它主要在花瓣的脱落部位特定表达,而不是在叶片、花瓣、根等其他部位表达。用一个普通野生型拟南芥也进行GUS染色对比,发现没有任何的GUS信号,更是充分证明了该启动子基因在花(器官)脱落中发挥了重要作用。
