体素内不相干运动联合生物标志物在非小细胞肺癌疗效评价中的应用
2020-06-27陈英海杜春娟刘志冰李绵利刘长民
韩 霞 陈英海 杜春娟 刘志冰 李绵利 刘长民
1 滨州医学院附属医院肿瘤科 山东 滨州 256603;2 天津市急救中心 天津 300000
肺癌总患者人数约占恶性肿瘤患者的14%左右,是恶性肿瘤死亡的主要原因之一[1]。我国有超过一半的肺癌患者确诊时已为晚期,失去了根治性手术的机会。目前主要采用放化疗为主的综合治疗。准确诊断、早期评估疗效、制定个体化的治疗方案是提高肺癌治愈率,降低死亡率的关键。早期患者的术后病理及免疫组化结果可为术后治疗及预后提供有价值的信息,但有相当多的晚期患者难以取得病理学诊断信息。血清肿瘤标志物表达水平会随治疗及病情发生变化,加之操作简便,易被患者接受,目前逐渐成为早期评价疗效的理想选择。体素内不相干运动(intravoxel incoherent motion, IVIM)不仅可提供组织水分子运动的参数,而且能反映组织灌注的程度。本研究旨在应用IVIM早期评估晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)放化疗疗效,分析IVIM各参数在肺癌放化疗前后的变化及与血清血管内皮生长因子(vascular endothelial growth factor,VEGF)、缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)水平的相关性,以期寻找一种能对晚期NSCLC疗效评价、预后评估提供有价值参考信息的技术手段。
1 资料与方法
1.1 病例资料 病例来源于2015年9月至2017年6月在滨州医学院附属医院肿瘤科就诊的66例行放化疗治疗的晚期NSCLC患者,结果均经病理证实。所有参与本研究的患者在实验前对本次实验目的及过程均有充分的了解,患者表示自愿参与本次实验,并签署知情同意书,符合医学伦理学要求并经本院伦理委员会审批通过。收集所有患者的临床和病理诊断信息,包括性别、年龄、东部肿瘤协作组(eastern cooperative oncology group,ECOG)评分、临床分期、病理类型、吸烟状况、血清CEA等。
1.2 治疗方案 放射治疗计划由两位经验丰富的副高以上放疗科医师设计,采用调强放射治疗(intensity modulated radiation therapy, IMRT),DT 2.0 Gy/d,5 f/w,总剂量DT 60 Gy。同步化疗方案采用EP或TP方案,化疗于放疗开始后的第 1、4周给予,剂量为EP方案【顺铂(DDP)25 mg/m2×3 d,依托泊苷(VP-16)50 mg/m2×5 d】,TP方案(多西他赛75 mg/m2,第1天,顺铂25 mg/m2×3 d)。
1.3 检查方法
1.3.1 MRI扫描设备及扫描方案 采用德国Siemens公司生产Magnetom Skyra 3.0T MR成像仪,采用8通道体部线圈,运用并行采集技术。患者仰卧位,头先进,双上肢举起置于头顶,扫描前行呼吸、屏气训练,患者平静呼吸,检查中尽量避免咳嗽。扫描序列为轴位 T1WI、T2WI、DWI、IVIM,冠状位 TW2。轴位参数为T2WI/TSE-BLADE(TR 3 000 ms,TE 85 ms,FOV 400 mm,矩阵 320×320,NSA 1,层厚 5 mm,层数 30),T1WI/VIBE-DIXON(TR 4.11 ms,TE 1.31 ms,FOV 400 mm,矩阵 320×234,NSA 1,层厚1.5 mm,层数 80~128),DWI/EPI(TR 4700 ms,TE 50 ms,FOV 400×380, 矩阵 128×128,NEX 1,层厚 5 mm,层数 30,b 值设置为 0,600 s/mm2)。冠状位参数为TW2/HASTE(TR 500 ms,TE 23 ms,FOV 450 mm,矩阵 320×256,NSA1,层厚 5 mm,层数 30),IVIM/EPI(TR 4 600 ms,TE 60 ms,FOV 450×302,矩阵 148×148,层厚 5 mm,层数 30)。b 值取10个,设0、20、40、60、80、160、200、400、600、800 s/mm2。
1.3.2 MRI的数据采集与计算 数据分析采用德国癌症研究中心开发的图像处理软件(medical imaging interaction too1kit,MITK;MITK Diffusion,Version 2014),将扫描所得多b值DWI图像加载到MITK软件的IVIM模块下,将b值调至170 s/mm2,参照 T1WI 以及 T2WI扫描图像,由 2 名高年资影像医师勾画感兴趣区(ROI),应选取病灶最大截面实性部分,避开肉眼所见钙化、血管、坏死等区域,同时还应保持不同参数图中 ROI 均为圆形,位置一致。分别独立测量并记录,由MITK-Diffusion后处理软件自动计算出灌注分数(f)值、真弥散系数(D)值和假弥散系数(D*)值。每个区域对 D、 D*及f值重复测量3次,最终结果取平均值。
1.4 患者血清VEGF、HIF-1α检测 所有患者入组前1周及治疗4周时从外周血管抽取静脉血5 mL,常温下以3 000 r/min离心15 min,分离血清后置于-80℃低温冰箱里贮存待测。采集同期在我院健康体检中心体检的健康志愿者的清晨、空腹静脉血标本为对照组,采用同样方法离心分离血清置于-80℃低温冰箱里贮存待测。采用Rayto型酶标仪、双抗体夹心酶联免疫吸附法(ELISA) 测定,试剂盒购自上海酶联生物科技有限公司。
1.5 疗效评估 根据放疗末期或放疗结束后1~3月内CT检查评价疗效,所有患者均依据实体瘤疗效评价标准RECIST 1.1[2](revised respond evaluation criteria in solid tumors)评价肿瘤对放化疗治疗的反应。评价标准为:完全缓解(complete response,CR),肿瘤完全消失;部分缓解(partial response,PR),肿瘤最大径缩小≥30%;病变稳定(stable disease,SD),肿瘤最大径变化介于PR和PD之间;病变进展(progressive disease,PD),肿瘤最大径增加≥20%或者有其他部位的转移。将CR、PR归为治疗敏感组,SD、PD归为治疗不敏感组。
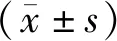
2 结果
2.1 患者基本情况 共66例患者确诊为NSCLC并纳入研究,所有患者全部完成治疗。4例患者未能按时间点进行MRI检查;3例患者图像伪影较大,予以剔除;最终共59例NSCLC放化疗患者纳入统计分析。根据放疗末期或放疗结束后1~3月内CT影像评价疗效,分为疗效敏感组(CR+PR)和疗效不敏感组(SD+PD)。其中疗效敏感组41例 (69.5%),全部为PR病例,无CR病例;疗效不敏感组18例(30.5%),其中SD 18例,无PD病例。患者资料见表1。NSCLC 组血清VEGF为(208.95±15.19)pg/mL,血清HIF-1α为(1.49±0.15)ng/mL,健康志愿者组血清VEGF 水平为(73.55±7.68)pg/mL,血清HIF-1α水平为(0.42± 0.12)ng/mL,NSCLC 组血清 VEGF、HIF-1α明显高于健康志愿者组(P均<0.01),见表2。
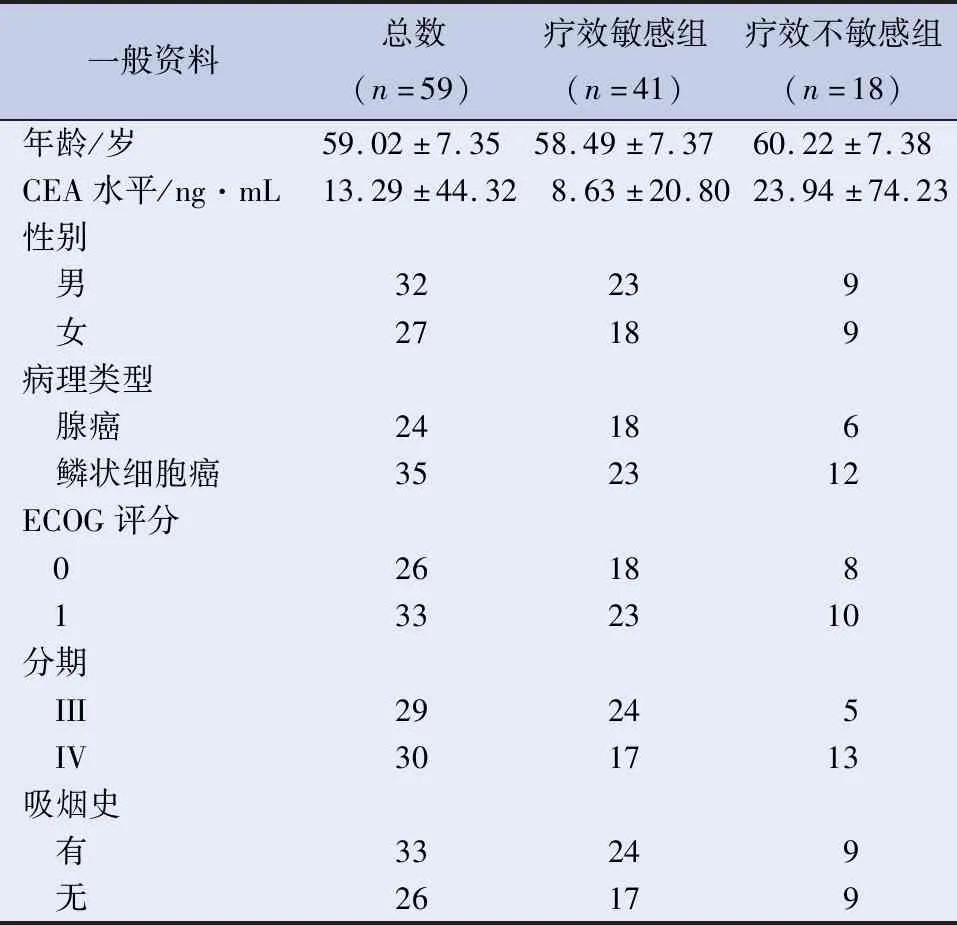
表1 患者基本资料
注:两组分期例数比较,P<0.05。

表2 患者血清VEGF与HIF-1α水平
注:与健康志愿者组比较,**P<0.01。
2.2 IVIM各参数及血清VEGF、HIF-1α水平与临床因素的关系 不同年龄、不同病理类型患者治疗前D值有差异(P<0.05),年龄≤60岁患者D值稍高一些,腺癌患者高于鳞状细胞癌患者。不同分期、不同病理类型患者治疗前D*值有差异(P<0.05),III期患者、腺癌患者D*更高。不同病理类型、吸烟史不同患者治疗前f值有差异(P<0.05),腺癌、不吸烟患者f值更高。放化疗前血清VEGF水平与患者年龄、性别、ECOG评分、吸烟史、治疗前CEA水平无关,与患者病理类型、临床分期有关(P<0.05)。腺癌治疗前VEGF水平高于鳞状细胞癌,IV期患者治疗前VEGF水平高于III期患者;放化疗前血清HIF-1α水平与患者年龄、病理类型、ECOG评分、吸烟史无关,与患者性别、临床分期、治疗前CEA水平有关(P<0.05),女性治疗前HIF-1α水平略高于男性,IV期患者治疗前HIF-1α水平高于III期患者,CEA水平大于5 ng/mL的患者治疗前HIF-1α水平高于CEA水平小于等于5 ng/mL的患者。
2.3 IVIM各参数及血清VEGF、HIF-1α水平与放化疗疗效的关系 不同疗效组间治疗前参数比较显示:疗效敏感组治疗前D值明显低于疗效不敏感组(P<0.05),f值明显高于疗效不敏感组(P<0.05),D*值在两组间未见明显差异。不同疗效组间治疗后参数比较显示:治疗后D、D*、f值在疗效敏感组和疗效不敏感组之间差异无统计学意义。不同疗效组间治疗前后参数变化值比较显示:疗效敏感组D变化值高于疗效不敏感组(P<0.01);D*及f变化值在两组间无统计学差异。治疗后血清VEGF、HIF-1α表达水平及治疗前后变化值在不同疗效组间存在统计学差异(P<0.05);治疗前血清VEGF、HIF-1α表达水平在不同疗效组间未见统计学差异,见表3。
2.4 受试者工作特征曲线计算各参数预测疗效的效能 单因素分析结果显示治疗前D值(pre-D)、治疗前f值(pre-f)、D变化值(△D)、治疗后VEGF(post-VEGF)、VEGF变化值(△VEGF)、治疗后HIF-1α值(post-HIF-1α)、HIF-1α变化值(△HIF-1α)在预测近期疗效有一定价值(P<0.05)。将这7个值分别行ROC曲线分析(图1~7)。结果显示:△D值曲线下面积最大(AUC=0.808),诊断效能明显优于pre-D值(AUC=0.659)和pre-f值(AUC=0.714,但三者之间差异无统计学意义。ΔD诊断界值取0.29×10-3mm2/s时,其预测放化疗疗效效能最佳,敏感性、特异性分别为 51.2%、100%。△HIF-1α值曲线下面积最大(AUC=0.867),诊断效能优于post-VEGF(AUC=0.802)、△VEGF(AUC=0.666)和post-HIF-1α(AUC=0.738),其中△HIF-1α和△VEGF差异有统计学意义(P<0.05)。△HIF-1α其诊断界值取0.29 ng/mL时,其预测放化疗疗效的效能最佳,敏感性、特异性分别为73.2%,88.9%。
将预测放化疗疗效有意义的指标纳入Logistic二元回归分析(表4),结果显示:△HIF-1α、pre-f值预测放化疗疗效有意义(P<0.05)。将△HIF-1α、pre-f值进行ROC曲线分析(图8),结果显示:VEGF、HIF-1α联合IVIM参数预测放化疗敏感性的ROC曲线下面积为0.974,敏感性为87.8%,特异性为100%。
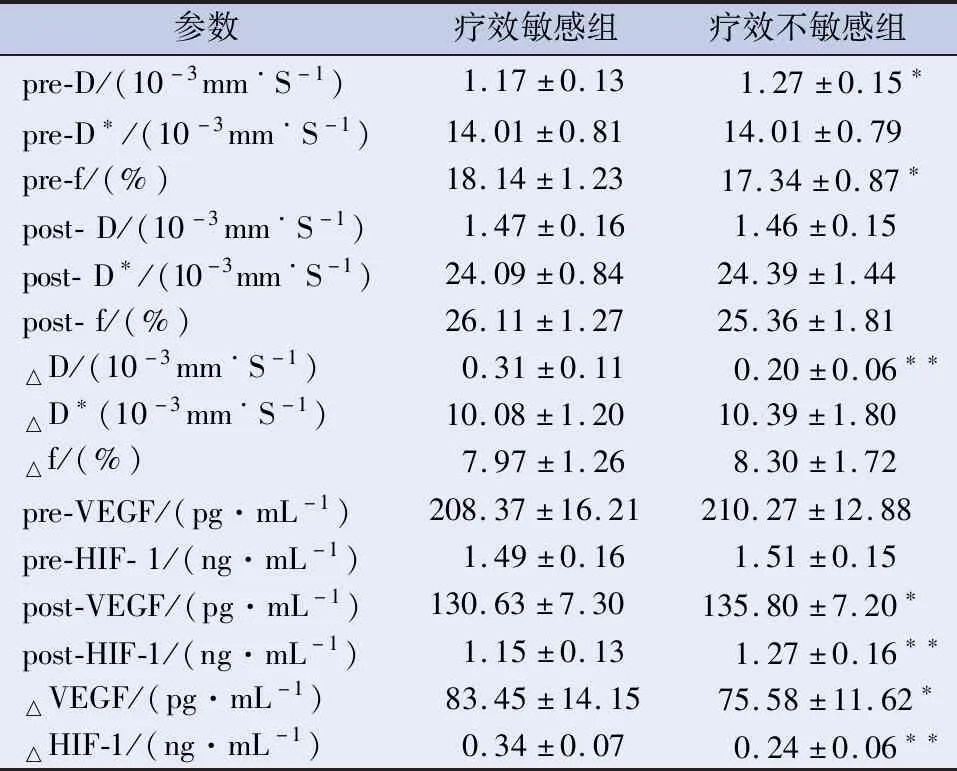
表3 IVIM各参数及血清VEGF、HIF-1α水平与患者近期疗效的关系
注:*P<0.05;**P<0.01。
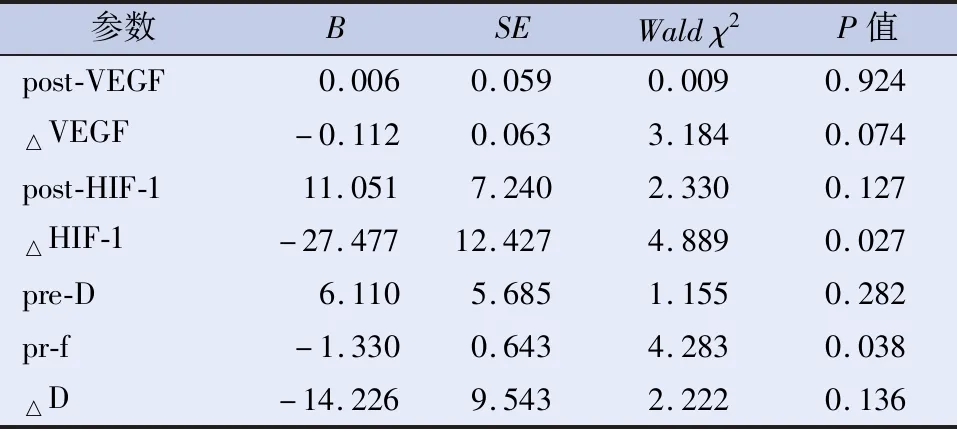
表4 VEGF、HIF-1α联合IVIM参数的Logistic回归
3 讨论
近年来,尽管医疗诊治水平不断进步,但肺癌的发病率及死亡率一直居高不下,甚至呈上升趋势,严重威胁人类健康。肺癌易早期转移,放化疗作为其主要的治疗手段,在不同个体之间疗效差异明显[3]。依据患者个体情况,对不同患者采用最适宜的个体化治疗方案,提高局部晚期NSCLC五年生存率仍是目前具有挑战性的课题。肿瘤的个体化治疗需要在治疗前或治疗早期就能够预测肿瘤的治疗效果或预后,以便及时制定及调整患者的最佳治疗方案。目前评价肿瘤疗效的方法是以传统形态学为基础的实体瘤治疗疗效评价标准(RECIST)[2],该方法存在观察周期长,不能早期、实时反映肿瘤治疗效果等局限性。故现迫切需要一种更为敏感的检测手段来指导患者的治疗方案以提高治疗效果。
近年来,功能磁共振成像迅速发展,其对疾病的研究已从形态学深入到分子水平层面,可定性、定量分析活体组织内细胞和分子水平的异常变化,为疾病的诊断及治疗评价提供了新的平台。磁共振弥散加权成像(diffusion weighted imaging,DWI)作为目前唯一无创评估活体组织内水分子扩散运动的成像技术,其通过表观扩散系数(apparent diffusion coeffiient, ADC)来量化水分子的弥散受限程度,间接反映组织微观结构的病理、生理信息[4]。然而组织内无规则的运动不仅包括水分子的扩散,还包括微循环的血流灌注。DWI 计算出的ADC值不能单纯反映活体组织内水分子运动情况。为弥补此缺陷,Le Bihan等[5]在1987年首次提出体素内不相干运动模型(IVIM),该模型能将纯水分子的扩散和微循环灌注所致的“假扩散”区分开来,能定量评估组织内的扩散及灌注情况,而且能在不使用外源性造影剂的前提下区分组织内单纯水分子扩散效应和组织毛细血管灌注效应。近年来,应用IVIM模型评价各种恶性肿瘤放化疗疗效的研究越来越多,其价值亦被认可,如宫颈癌[6]、肝癌[7]、乳腺癌[8]、直肠癌[9]等。关于IVIM在肺部应用的研究不多,主要集中在肺部病变的鉴别诊断方面,应用IVIM评价肺癌放化疗疗效的报道甚少。
我们研究发现肺癌患者放化疗后D值、f值较治疗前有所升高,治疗前疗效敏感组的D值低于疗效不敏感组,而f值恰好相反,提示治疗前的D值、f值可用来预测近期疗效。我们还发现治疗后4周疗效敏感组的D值增长率高于疗效不敏感组,考虑原因为疗效敏感组对放化疗治疗更为敏感,细胞凋亡、坏死出现的较早、较显著,D值呈不断升高趋势,疗效好者增加程度更大,这与 Liu[10]及蔡靖等[11]的研究结果一致。而李妹[12]发现治疗前 PR组D值轻度高于SD组,D*值PR组轻度低于SD 组,差异无统计学意义。本研究中D*值治疗前、治疗后、治疗前后变化值及治疗后4周f值、f变化值在疗效敏感组和疗效不敏感组间差异均无统计学意义,这可能与D*值受信噪比影响较大,可重复性差,测量结果不稳定[13]有关;放疗后时间较短,两组的f值变化在治疗后4周差异无统计学意义。
多数肿瘤组织均具有缺氧的微环境,它可通过促进多种转录因子及靶基因的表达,使肿瘤细胞在缺氧环境下生存、增殖、侵袭及转移。乏氧不仅诱导HIF-1α过表达,而且还诱导VEGF等细胞因子表达,两者之间协同作用,促进肿瘤细胞转移[14]。多项研究显示肺癌患者血清VEGF、HIF-1α水平随临床分期的增加、原发肿瘤大小及淋巴结转移而显著上升,高表达者预后差,其可作为判断肺癌恶性程度、疗效预测及不良预后的评价指标[15-16]。Roskoski[17]认为化疗前血清VEGF水平能够在一定程度上预测化疗疗效,其水平增高可能与化疗耐药有关。我们研究发现,放化疗后患者血清中VEGF、HIF-1α水平较治疗前均下降,疗效敏感组患者下降水平更为明显,并且治疗后的VEGF水平对评估疗效的指导意义要优于治疗前的VEGF水平。这些发现与杨杨[18]的研究一致。
本研究应用ROC曲线分析各参数预测近期疗效的价值发现,D变化值及HIF-1α治疗前后变化值的曲线下面积更大,其诊断效能优于其它指标,D变化值诊断界值取0.29×10-3mm2/s,HIF-1α变化值诊断界值取0.29 ng/mL时,其预测放化疗疗效效能最佳。当检测值≥此阈值时,可预测治疗结束后一个月肿瘤能完全或部分缓解。VEGF、HIF-1α联合IVIM参数预测放化疗敏感性的ROC曲线下面积为0.974,敏感性为87.8%,特异性为100%,进一步提高了预测效能。
综上所述,通过IVIM检查联合血清VEGF和HIF-1α检测,可以在一定程度上早期预测放化疗治疗的敏感性,以便及时调整治疗方案。但是,本研究仍存在许多不足之处,尤其是入组样本量较少,仅初步探索了放化疗后4周的参数变化,针对IVIM各参数对于肿瘤治疗后各个时间点以及长期生存的预测作用,需将来进一步扩大样本量进行前瞻性、全方位的研究。HIF-1α作为缺氧诱导下最重要的转录因子,其表达增加可使肿瘤血管形成相关基因的表达升高。目前,有关抗血管生成的研究及治疗进行得如火如荼,相信不久的将来以HIF-1α为靶点的治疗可能成为肿瘤治疗的新突破。
