klotho通过Wnt/β-catenin通路抑制高磷诱导的人主动脉平滑肌钙化
2020-06-21刘海军解修花杨秀芹李延国
刘海军,解修花,杨秀芹,王 莹,李延国
(1山东医学高等专科学校,山东 临沂 276000;2临沂市人民医院)
血管钙化(Vascular calcification,VC)往往导致较差的临床结果和较大的心血管疾病风险。在慢性肾脏病(Chronic kidney disease,CKD)患者中,VC被认为是一个主要的心血管危险因素[1]。血管平滑肌细胞(Vascular smooth muscle cells,VSMCs)在VC形成过程中起着关键作用,能够将其收缩表型转变为成骨细胞和成软骨细胞样表型[2],其中复杂的细胞内信号通路控制着VSMCs的成骨/成软骨分化[3],是许多钙化抑制因素及钙化促进因素综合平衡的结果。Klohto作为一种抗衰老基因在健康人群及疾病患者矿物质及骨代谢过程中发挥重要作用,其缺乏已经在CKD患者中普遍存在,并被证实直接参与VC的发展。有研究显示,klotho在CKD患者中具有预防动脉钙化和减少动脉僵硬度的作用[4]。但Klotho对VC保护作用的具体机制尚不明确。本研究利用基因转染的方法,探讨Klotho对高磷诱导的人主动脉平滑肌细胞(Human aortic smooth muscle cells,HASMCs)钙化的保护作用机制。
1 材料与方法
1.1HASMCs的培养及钙化的诱导 HASMC及其培养基购自ScienCell公司(美国)。将HASMC置于37℃,95% CO2孵箱中孵育,每1~2天换液1次,第3~8代用于本实验。传代后的细胞经胰蛋白酶消化后接种于六孔板中,待细胞贴壁后,换成磷浓度分别为1.3 mmol/L(正常磷浓度)、2.6 mmol/L(高磷浓度)的培养基。细胞培养时间为9 d。换用不同培养基的第1天记为第0天。直径6 cm培养皿中细胞处于对数生长期,生长状态良好时即可冻存。离心去上清液后取0.8 ml胎牛血清重悬细胞沉淀,加入80 μl二甲基亚砜混匀,封入冻存管,放入-80℃冰箱保存。
1.2klotho基因转染 转染试剂lipofectamine2000及质粒购自美国invitrogen公司。将质粒pcDNA3.1-GFP-KL(含有klotho全长基因序列)通过转染试剂分别转染至正常磷浓度和高磷浓度组,转染48 h,具体操作按说明书进行。
1.3实验分组 实验分4组:I组,正常磷浓度组;Ⅱ组,高磷浓度培养组;Ⅲ组,正常磷浓度+klotho转染组;Ⅳ组,高磷浓度+klotho转染组。
1.4各组钙化程度的检测 茜素红染色法鉴定细胞的钙盐沉积,光镜下观察细胞外基质呈现橙色着色、细胞呈淡紫色着色为钙盐沉积染色阳性。细胞外基质钙含量的定量检测:弃去上层培养基,PBS缓冲液洗涤细胞3次,0.6 mol/L盐酸去钙化,37℃脱钙24 h。收集上清液用钙离子定量检测试剂盒(北京中生北控公司)测定盐酸悬液中的钙含量。剩余细胞提取细胞总蛋白,BCA蛋白检测试剂盒法测定蛋白含量。用蛋白含量校正钙含量(mmol/g)。
1.5指标蛋白的表达 准备细胞,弃掉培养液,预冷PBS浸泡、清洗3次,倒掉PBS,加蛋白裂解液和抗胰蛋白酶,于4℃冰箱15 min,次日超声裂解。用BCA法测定碱性磷酸酶(ALP)、Runt相关转录因子2(Runx2)、骨保护素(OPG)、骨桥蛋白(OPN)、β-连环蛋白(β-catenin)。电泳分离蛋白,转膜、封闭后加入一抗(兔抗人单克隆抗体)、二抗(羊抗兔Ig-罗丹明标记二抗),将ECL发光液加到膜上,经X胶片曝光显影,以光扫描仪记录蛋白印迹的实验结果。以目的蛋白条带与GAPDH条带光密度的比值作为目的蛋白的相对表达量。
2 结果
2.1HASMCs形态 倒置相差显微镜下观察,正常磷浓度下培养的HASMCs细胞呈梭形或多角形,细胞生长融合后,细胞间平行排列成束或呈放射状,具备平滑肌细胞生长的“波峰-波谷”样生长特点,符合VSMC形态学特征。在荧光显微镜下,转染pcDNA3.1-GFP-KL质粒的HASMCs呈现绿色荧光,证明转染成功。见封二图1-3。
2.2茜素红染色结果 Ⅰ组细胞基质未着色,细胞呈褐色,可见细胞外基质钙盐沉积染色不明显;Ⅱ组细胞外基质呈暗红色,可见明显钙化结节,细胞仍为褐色,细胞外基质钙盐沉积染色阳性。与Ⅱ组相比,Ⅳ组细胞外基质中有钙盐沉积,其程度较Ⅱ组轻;Ⅲ组细胞外基质钙盐几乎无沉积,未见着色。见封二图4-7。
2.3细胞外基质钙含量测定结果 Ⅰ组:(1.22±0.19) mmol/g;Ⅱ组:(1.86±0.04) mmol/g;Ⅲ组:(1.21±0.19) mmol/g;Ⅳ组:(1.63±0.04) mmol/g。4组比较有统计学意义(F=11.32,P<0.01)。两两比较显示:Ⅱ组含量明显高于其他各组(P<0.05);Ⅰ组与Ⅲ组之间差异无统计学意义(P>0.05)。
2.4Western blot结果 各组相关指标均有统计学意义。两两比较显示:Ⅱ组ALP、Runx2及β-catenin蛋白表达最高(P<0.05),OPG及OPN蛋白表达最低(P<0.05);Ⅰ组与Ⅲ组各蛋白表达无统计学意义(P>0.05)。见表1、封二图8。
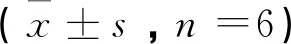
表1 各组指标蛋白的表达
3 讨论
高磷血症是CKD患者的常见临床特征,与动脉中层钙化的发生发展密切相关,被认为是与心血管发病率和死亡率密切相关的主要危险因素[5]。高磷诱导的VC是一种由VSMCs的成骨/软骨分化促进的病理过程。VSMCs暴露于高磷酸盐环境中,类似于CKD患者的病理生理状态,已被证明可通过调节骨基质在血管壁的沉积过程启动其向外转分化成骨样细胞。本研究利用高磷诱导HASMCs的成骨细胞钙化及转分化,结果显示:细胞外基质呈暗红色,可见明显钙化结节,细胞仍为褐色,细胞外基质钙盐沉积染色阳性,细胞外基质钙含量明显升高,且高磷培养组ALP蛋白表达明显升高,符合VC的生物学特点。
许多因素已被证明对骨形成是至关重要的,其中Runx2和Wnt/β-catenin信号尤为重要,因为它们是成骨细胞分化启动所必需的通路的功能连接元件。Wnt/β-catenin信号已被证实参与高磷酸盐诱导的VSMCs成骨转分化和动脉中膜钙化的发展[6]。Runx2是一个关键的成骨细胞转录因子,对软骨细胞的成熟和成骨分化至关重要。它最初被认为只在骨骼发育过程中表达,现在已知它在钙化发育过程中在血管内膜和血管内侧被激活。Runx2的表达由Wnt信号通路通过人T细胞/淋巴细胞增强因子协同转录因子的直接结合来调控[7]。Wnt通路激活规范的途径的特征是细胞质中的β-Catenin的积累和随后的核易位。本研究结果显示:高磷培养组Runx2和β-catenin蛋白表达明显升高;给予klotho基因转染后,Runx2和β-catenin蛋白表达显著下降,且高磷+klotho基因转染组钙化程度明显减轻,细胞外基质钙含量明显减少。提示klotho通过影响Wnt/β-catenin信号通路发挥了抑制HASMCs钙化的作用。
OPN是一种富含唾液酸的分泌型磷酸化糖蛋白,在体内广泛表达,在VSMCs和动脉内皮细胞中表达尤其高,是VC的重要抑制因子。研究发现,体外培养的高磷、高钙浓度培养基中,HASMCs的OPN mRNA及OPN蛋白表达均明显增加[8]。OPG缺乏的小鼠骨质疏松症和血管钙化均增加,其水平与血液透析患者VC相关[9]。本研究结果显示:高磷浓度培养的HASMCs细胞中OPN及OPG蛋白表达均减少,而高磷浓度+Klotho基因转染组OPN及OPG蛋白表达均显著增加。提示OPN及OPG蛋白是高磷诱导HASMCs转分化和钙化的抑制因子,对VC的发生具有保护性作用。但其具体机制仍然需要进一步研究。
综上所述,高磷诱导VSMCs发生钙化是一个涉及到多种细胞因子的活性过程。Klotho基因转染能够降低高磷诱导的HASMCs钙化,其作用机制可能与下调Wnt/β-catenin信号通路导致OPG、OPN蛋白表达增加有关。应用外源性的Klotho或者影响Klotho表达的调节剂有望成为临床预防和治疗VC的一个靶点。
