Stanford A型主动脉夹层术后急性肾功能损伤危险因素分析及预后
2020-06-19查正彪,潘友民,郑智等
Stanford A型主动脉夹层是极凶险的心血管疾病,发病急,容易发生大血管破裂和脏器缺血[1]。孙氏手术(四分支人工血管置换+远端象鼻支架植入术)是Stanford A型夹层治疗的标准术式之一,手术创伤大,术后病死率接近17%~26%[2]。急性肾功能损伤(acute kidney injury,AKI)是Stanford A型主动脉夹层术后常见并发症,发生率约为1%~25%,病死率接近15%~16%[3-4]。本研究拟比较Stanford A型主动脉夹层术后发生急性肾功能损伤和未发生急性肾功能损伤两组病人预后,分析发生急性肾功能损伤的高危因素。
对象与方法
一、对象
2014年5月~2016年5月我院收治Stanford A型夹层术后发生急性肾功能损伤病人75例,作为病例组(AKI组),按照年龄±2岁和体重±5 kg按1∶1匹配75例Stanford A型夹层术后肾功能正常者作为对照组(非AKI组)。剔除标准:既往有慢性肾功能损伤;合并重要脏器损伤(如脑血管意外、严重肺部感染、心力衰竭、肝功能不全等)。术后发生AKI定义为术后首次血肌酐绝对值>176 μmol/L,或绝对值升高>44 μmol/L,或无尿、少尿(每小时<0.5 ml/kg),持续>12小时。永久肾损伤定义为随访血肌酐绝对值>707 μmol/L,或持续少尿、完全丧失肾功能超过1个月[5]。死亡定义为住院或随访期间任何原因导致的死亡。大剂量血管活性药定义为多巴胺、多巴酚、肾上腺素和去甲肾上腺素等升压药累积量每分钟>20 μg/kg,且合用两种以上升压药血压仍有下降趋势。术后低氧血症定义为氧合指数(动脉血氧分压/吸氧浓度)≤300 mmHg。早期并发症定义为术后住院期间出现以下并发症:死亡、出血、肺部感染、新发脑卒中、心力衰竭、透析。远期并发症定义为术后随访期间出现以下并发症:死亡、透析、心力衰竭、永久肾损伤。数据定义参照STS美国胸外科协会风险评分模型[6-7]。
二、方法
150例病人均在深低温停循环下行孙氏手术。术中鼻咽温降至25℃左右,平均动脉压维持在60~90 mmHg,选择性脑灌注时间12~31分钟,主动脉阻断时间100~193分钟,体外循环时间138~390分钟。术后急查血常规、血生化、凝血等指标,监测尿量每小时1此,收集术后30天内并发症情况。顺利出院病人电话和门诊随访3年,复查CT和肾功能,随访率97.0%。收集术后随访1个月、12个月、24个月、36个月并发症情况。
三、统计学分析

结 果
1.一般情况:150例病人平均年龄(59.0±5.3)岁,平均体重(70.0±9.2)kg。AKI组体外循环时间和升主动脉阻断时间长于非AKI组,差异有统计学意义(P<0.05)。ROC曲线确定体外循环时间超过200分钟(AUC=0.752,灵敏度=72.2%,特异度=61.1%)是术后发生AKI的界值。AKI组大剂量血管活性药使用率,大量输血率高于非AKI组。AKI组静力型肾血管受损率高,术后低氧血症发生率高,差异有统计学意义(P<0.05)。见表1。

表1 两组一般资料的单因素分析
注:EF:射血分数
2.并发AKI危险因素筛选:多因素分析共纳入6个危险因素:升主动脉阻断时间,体外循环时间>200分钟,大剂量血管活性药使用,大量输血>2000 ml,术后低氧血症和静力型肾血管受损。条件Logistic回归分析显示:静力型肾血管损伤和围术期大剂量血管药物使用是Stanford A型夹层术后发生急性肾功能不全的主要独立危险因素。围术期大剂量血管活性药使用发生AKI的风险是非大剂量血管活性药病人的3.455倍;静力型肾血管损伤发生AKI的风险是动力型或无肾血管损伤病人的8.726倍。见表2。
3.住院早期和远期预后比较:AKI组术后早期并发症发生比例约是非AKI组的1.9倍(56.0%和29.3%)。AKI组术后肺部感染比例高、使用呼吸机时间长,两组比较差异有统计学意义(P<0.05)。两组术后早期死亡率,出血、新发脑卒中和心力衰竭等并发症比较,差异无统计学意义(P>0.05)。见表3。顺利出院病人随访3年,随访率97%,平均随访28个月。AKI组远期并发症发生比例约是非AKI组的4倍(52.2%和12.7%)。AKI组术后1个月、12个月、24个月及36个月免于远期并发症生存率分别为94.2%、91.2%、80.5%和26.4%,非AKI组分别为100%、98.6%、91.5%和77.8%,(Log-rankP<0.01)。图1。AKI组远期死亡率、心力衰竭、透析率、永久肾损伤发生比例高于非AKI组。见表4。
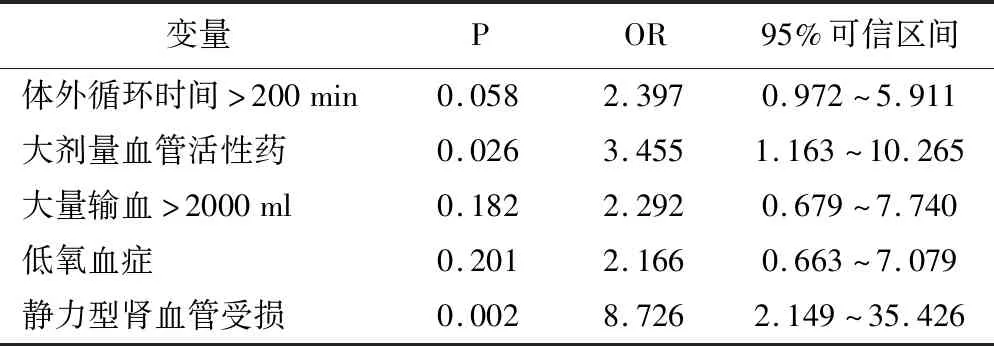
表2 Stanford A型主动脉夹层急性肾功能损伤条件Logistic多因素分析
图1两组病人术后3年随访免于远期并发症生存率曲线
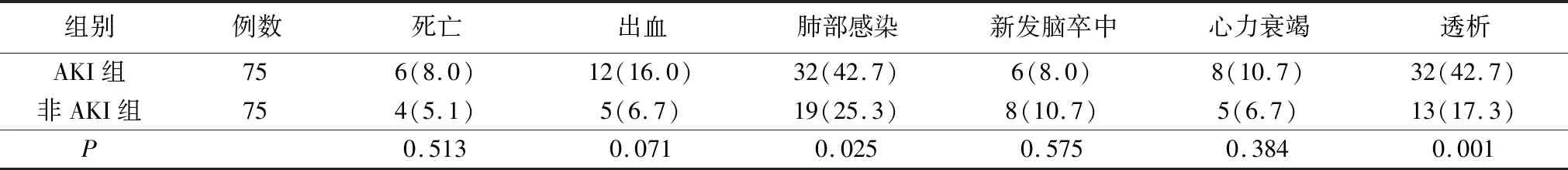
表3 两组病人早期并发症比较 [例(%)]

表4 两组病人3年随访结果比较 [例(%)]
讨 论
本研究显示Stanford A型夹层术后发生急性肾功能损伤病人预后相对较差,早期并发症率约增加1.9倍,肺部感染率约增加1.7倍,远期并发症率约增加4倍,我们认为可能与肾源性水钠潴留、炎症因子和毒素蓄积,肺水多、缺氧,呼吸机带管时间长,肺部感染几率大,导致术后早期病死率高。严重缺血或肾毒性会导致肾实质遗留不同程度损伤,即使血液透析也无法逆转肾功能,部分病人需要长期透析或出现永久肾损伤,导致远期预后不佳。同以往研究不同,由于年龄和体重对术后评估肾功能有较大干扰,我们设计年龄±2岁和体重±5 kg的1∶1病例对照研究消除混杂偏倚,通过条件Logistics回归分析发现,围术期大剂量血管活性药使用和静力型肾血管受损是这类病人术后发生急性肾功能损伤的独立危险因素。
血管活性药在心血管手术围术期广泛应用,帮助稳定血流动力学,改善病人心功能和组织灌注。由于病人个体差异及医生用药习惯的不同,血管活性药物使用差异明显。我们研究发现,围术期大剂量血管活性药使用是Stanford A型主动脉夹层病人术后发生急性肾功能损伤的独立高危因素。大剂量血管活性药影响全身血流重新分布,尤其是去甲肾上腺素,可引起肾血管强烈收缩,肾储备功能下降时易诱发急性肾缺血性损伤,严重时导致不可逆肾实质坏死,因此,不推荐去甲肾肾上腺素作为一线升压药。大剂量血管活性药使用多见于术后补液、强心和纠酸等处理后循环维持仍不满意者,如严重出血渗血、心包填塞、心功能不全等,盲目加大血管活性药剂量适得其反,积极寻找病因比较可取,如纠正凝血紊乱、开胸探查、心功能太差者给予ECMO辅助,才能从根本上解决问题,降低脏器缺血损伤。
主动脉夹层撕裂常累及肾血管,常见的肾动脉受累有二种类型:动力型,假腔压力梯度升高导致肾动脉真腔受压供血减少;静力型,漂浮内膜堵塞肾动脉开口或肾动脉开口处假腔血栓化造成肾动脉真腔狭窄。本研究显示,静力型肾动脉血管受损病人术后更容易发生急性肾功能损伤。Stanford A型夹层胸降主动脉植入象鼻支架撑开真腔,近端主破口修复,假腔血流减少压力下降,真腔血流回升,动力型肾动脉血管受损,肾血流可恢复,而静力型肾动脉血管受损,肾脏假腔供血或假腔闭塞,肾血流改善不明显,术后肾功能恢复差。尤其双侧静力型肾动脉受损,术后极容易诱发急性肾功能损伤。极少数情况,肾脏有缺血,但双侧肾脏代偿及残存肾代偿,不足以导致肾功能损伤[8-9],这种情况在Stanford A型主动脉夹层术后不常见,A型主动脉夹层手术创伤大,血管撕裂严重,肾脏负荷重,多数代偿能力不足,因而同期肾动脉血运重建很有必要。根据术中彩超或造影评估肾动脉血流,如果孙氏手术后肾动脉血流改善不明显,这类病人需要积极行内膜开窗或肾动脉支架植入术。本组病例中我们曾尝试为3例肾动脉主干急性近闭塞病人同期植入肾动脉裸支架开通血管,2例病人围术期肾功能都得到明显改善。因此,我们主张解决夹层病变同时尽可能恢复所有重要脏器的血供,包括肾脏,即便同期处理会延长手术时间和增加手术创伤,但对病人预后有积极作用。
综上所述,围术期大剂量血管活性药使用和静力型肾血管受损是术后并发急性肾功能损伤的独立高危因素,术后并发急性肾功能损伤病人预后相对较差。本研究仍有不足,虽然单中心存在一定选择性偏倚,主动脉夹层疾病凶险,治疗费用昂贵,本组纳入病例都是经济条件可以和有手术治疗意愿的病人,但相关经验和大数据研究仍值得国内其他临床中心参考。
