肺纯磨玻璃结节的高分辨率CT表现与临床病理学及基因特征
2020-06-17林吉兴申磊磊侯晓明李家开王钰琦
林吉兴,申磊磊,侯晓明,李家开,王钰琦
解放军总医院海南医院胸外科,海南 三亚 572000
随着人们健康体检意识的不断提高及高分辨率CT(HRCT)的广泛应用,肺部磨玻璃影(GGOs)检出率逐年升高,根据GGOs内部成分及密度的不同,又细分为纯磨玻璃结节(pGGOs)和部分实性磨玻璃结节(mGGOs)[1]。mGGOs在临床工作中经手术切除后病理几乎均为早期肺癌,主要表现为微浸润性腺癌(MIA)和早期浸润性腺癌(IA)[2]。而pGGOs的病理表现不一而足,多数提示为肺癌早期阶段,但又可见于局灶炎症、水肿、肺泡出血及局限性纤维化等病变[3],且pGGOs多为年轻女性患者,术后患者又出现诸如慢性伤口疼痛、慢性刺激性干咳等症状,并一定程度上影响生活质量。因此,术前如何通过无创手段对pGGOs进行定性诊断,并从而指导患者后期的随访、治疗方案及预后,已成为目前的研究热点和难点。
国内外多研究GGOs的HRCT表现和病理之间的相关性[2-4],将pGGOs单独研究的重点仅放在其HRCT表现上[3-5];且目前国内尚未有从手术治疗视角及基因突变角度分析pGGOs的研究。既往研究显示,肺部GGOs的生长遵循从非典型腺瘤样增生(AAH),AIS,MIA到IA的自然进展规律[5-6],近年来基因突变因素在肿瘤发生发展及增殖过程中扮演极为重要的角色[7]。因此,本研究回顾分析pGGOs的HRCT表现与临床病理学及EGFR基因特征之间的关系,通过术前HRCT特征探讨pGGOs的病理及EGFR基因突变情况,以期对其准确定性提供一定价值,希望能给后续研究提供思路,现报道如下:
1 资料与方法
1.1 一般资料
回顾性分析2013年4月~2019年4月于解放军总医院海南医院胸外科行手术切除的86例pGGOs患者的相关资料。其中男性30例,女性56例,年龄21~78岁。纳入标准:患者具备准确及完整的临床和病理资料;影像系统中有完整的高分辨CT图像,层厚≤1.5mm;肺内单发纯磨玻璃结节影,最长径≤3 cm;一般情况良好,心肺功能可以耐受开胸或胸腔镜手术。排除标准:影像系统上无层厚≤1.5 mm的图像;病灶最大径>3 cm;mGGOs及实性结节;其他恶性肿瘤肺转移结节或接受过放化疗者;心肺功能差,无法耐受全麻开胸或胸腔镜手术。因原位腺癌(AIS)患者术后5年生存率为100%,而MIA患者术后5年生存率为100%或接近100%[6,8],故将IA患者作为IA组,MIA、AIS和AAH患者设为对照组。其中IA组患者41例,对照组45例(MIA患者25例,AIS患者14例,AAH患者6例)。
1.2 检查方法
所有患者均以德国西门子64排螺旋CT扫描,吸气相后屏气从肺尖向肺底扫描,包括两侧胸壁和腋窝。扫描参数为:管电压120 kV,管电流100 mAs,准直器宽度0.625mm,扫描层厚1.5mm。
1.3 图像分析
所获取的图像均由2名高年资工作经验10年以上的放射科医生在不知情患者术后病理结果情况下阅片,统一窗设定为(WW:1600,WL:-600),记录分析结节的位置:右肺上叶、中叶、下叶,左肺上叶、下叶。结节的影像特点:形态(圆形、类圆形或不规则形)、大小(最大径)、边缘(分叶征、毛刺征)、病变周围情况(胸膜牵拉征、血管集束征)、体积、质量等并得出一致结果。
其中pGGOs的体积和质量的测量方法如下:应用高级肺结节分析软件,操作步骤:选择要进行测量的一组轴位图像(1.25 mm)数据,进入容积分析界面后,由软件根据所选结节的位置选择相应的算法对结节进行分割并显示出结节的分割图像,结果为分割满意,否则确定为分割不满意并从研究对象中剔除。软件自动计算出分割后结节的体积V(mm3)[9]。根据CT值与物理密度的线性相关性[10-11],将测出的平均CT值+1000转换为假定物理密度ρ(单位为mg/cm3)。采用公式m=ρ×V/1000计算出磨玻璃结节的质量m(单位为mg)[12]。
1.4 统计学分析
采用SPSS20.0统计学软件,对数据进行正态性和方差齐性检验,正态分布的计量资料用均数±标准差表示,两组间资料比较采用独立样本t检验;非正态分布的计量资料采用中位数(上下四分位数)表示,组间比较采用非参数检验。计数资料用率表示,组间比较用χ2检验,以P<0.05为差异有统计学意义。用受试者工作特征曲线(ROC)分析IA组与对照组在直径、体积及质量方面的临界值、诊断敏感度、特异度。
2 结果
2.1 IA组和对照组的一般资料及手术情况比较
两组患者在年龄、性别及既往吸烟史方面差异均无统计学意义(P>0.05,表1),在手术方式上的差异有统计学意义(P<0.05),IA组患者更多接受肺叶切除术,对照组患者更多行亚肺叶(肺段和楔形切除)切除术。
2.2 IA组和对照组的影像学特征比较及cut-off值分析
根据HRCT影像特征,两组患者在pGGOs的直径、体积及质量方面差异有统计学意义(P<0.001,表2),但在平均CT值和转化密度上差异并无统计学意义(P>0.05)。反映边缘特征方面,在分叶和毛刺上差异有统计学意义(P<0.05),而在pGGOs的形状、胸膜牵拉征和血管集束征等方面的差异无统计学意义(P>0.05)。影像学资料显示某患者72岁男性,左肺下叶pGGO,直径约15 mm,体积1033 mm3,分叶、胸膜凹陷征;术后病理证实为MIA(图1)。ROC曲线分析以10.8 mm为临界值鉴别肺IA组和对照组,敏感度为58.5%,特异度为84.4%,AUC为0.753(图2)。用ROC曲线分析体积大小的临界值为870 mm3,AUC值为0.773,诊断敏感度52.5%,特异性95.2%(图3)。用ROC曲线分析质量的临界值为306.9 mg,AUC值为0.769,诊断敏感度53.7%,特异性93.3%(图4)。

表1 IA组和对照组的一般临床资料Tab.1 Baseline and surgical characteristics in IA and control group
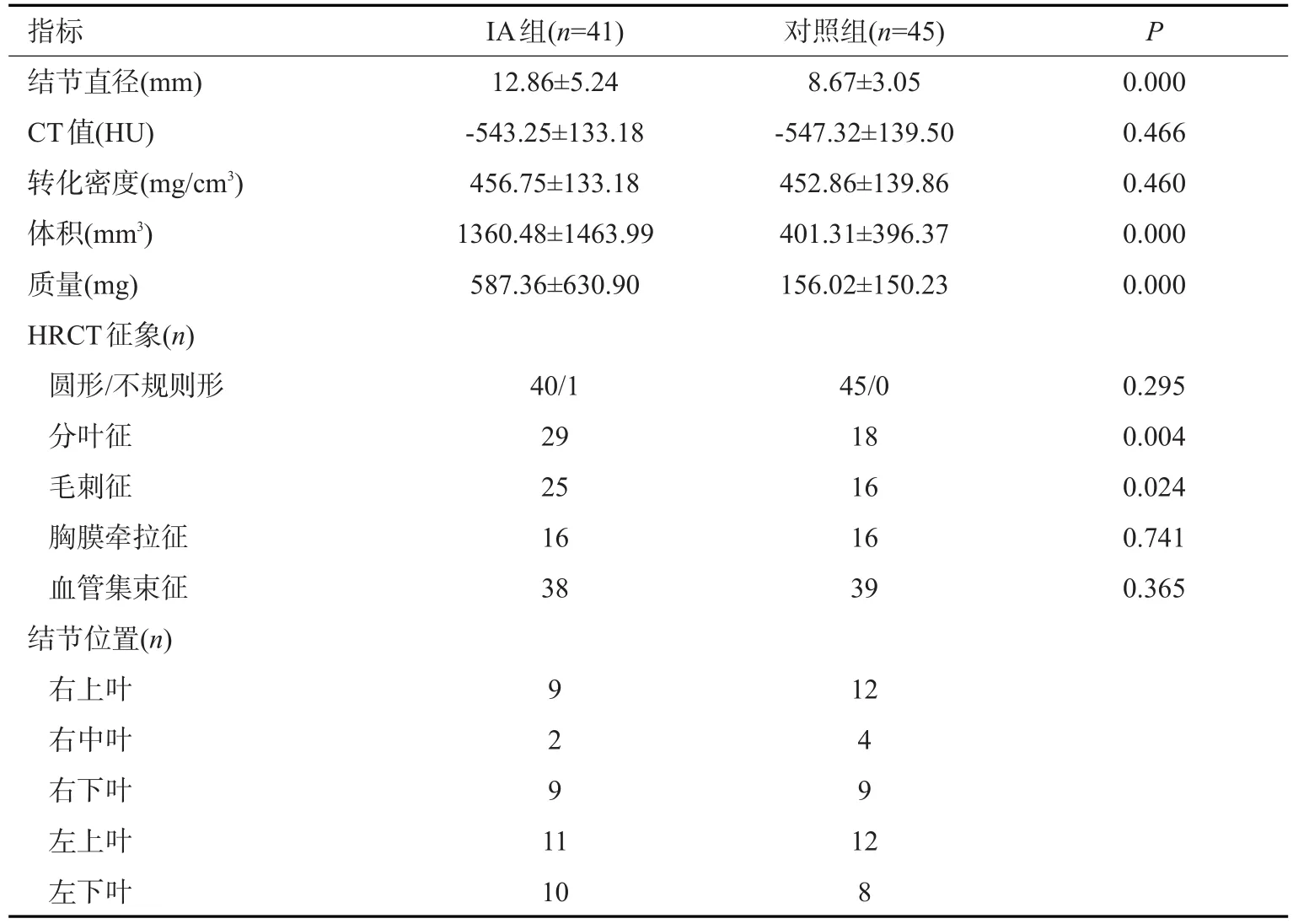
表2 IA组和对照组的HRCT影像特征(Mean±SD)Tab.2 HRCT findings in IA and control group
2.3 IA组和对照组的基因突变结果比较
对照组仅有8名患者行术后常见基因突变检测,有2例EGFR基因突变,分别表现为L858R突变和20外显子插入突变;IA组中有20例行术后基因状态检测,有9例EGFR突变,包括6例L858R突变和3例19外显子缺失突变,无KRAS、HER2、BRAF、EML4-ALK、ROS1等基因突变。两组间在基因突变方面差异并无统计学意义(P>0.05,表3)。

表3 IA组和对照组的基因突变结果Tab.3 Genetic mutation results in IA and control group
3 讨论
本研究中显示,浸润性腺癌组和对照组在年龄、性别及吸烟史等方面差异均无统计学意义。有报道认为在年龄方面,对照组有年轻化的趋势[13],体现了人们体检意识提高,越来越多的癌前病变及MIA被发现,所以HRCT表现为pGGOs的年轻患者,应高度重视并及时做出正确的影像诊断及建议,避免错过最佳手术时机。性别分布方面,腺癌在女性中所占比例逐渐提高,本研究与既往文献一致,这可能与女性血清雌激素水平较高有关[14-15]。吸烟史方面,本研究中两组吸烟史患者均较少且无统计学差异,这也与病理为浸润性腺癌及癌前病变有关[6]。
本研究中两组患者在手术方式上差异有统计学意义,IA组患者更多接受肺叶切除术,对照组患者更多行亚肺叶(肺段和楔形切除)切除术,这与术前的影像学判断有关。pGGOs直径较大,边缘不规则,有毛刺、分叶、胸膜牵拉、血管集束等高度提示潜在恶性的影像学特征,且结节位置较深,楔形切除困难或肺段切除无法保证足够切缘的,更多选择肺叶切除。尽管如此,如何制定合适的手术切除范围仍是目前争相探索的焦点。肺叶切除联合系统性淋巴结清扫是目前治疗早期肺癌的标准术式[16],但pGGOs往往是生长较慢或侵袭性较低的早期病变,亚肺叶切除(肺段切除和楔形切除)由于可以保留健康肺组织及术后肺功能,而不影响术后的总生存时间和无复发生存率,在临床中愈加受到认可[17-18]。但两者间的最终比较结论,还要等待日本和美国两项RCT结果。pGGOs尚未有淋巴结转移的报道,且系统性淋巴结清扫并未给早期肺癌患者带来更好的生存获益[6,19]。本研究中,两组在淋巴结清扫方面并无差异,且无一例淋巴结受累,因此,结合既往文献报道,对于pGGOs,完全可以无需系统性淋巴结,或仅行淋巴结采样。
在pGGOs的影像学特征方面,本研究中两组患者在pGGOs的直径、体积及质量方面有统计学差异,但在平均CT值和转化密度上并无统计学差异。既往文献报道认为结节大小是评价pGGOs是否发生浸润的重要指标,研究显示直径大于9.6 mm可区分腺癌有无浸润[20]。随着pGGOs直径变大,其恶性率也直线上升,小于10mm时,恶性率为47.4%,而大于10 mm时,恶性率可达70.1%[21]。本研究ROC曲线分析,以10.845 mm为临界值鉴别肺IA和对照组,敏感度为58.5%,特异度为84.4%,AUC值为0.753,大于10 mm的pGGOs患者中,IA占比71.4%,而≤10 mm的pGGOs患者中,IA占比仅32%,与上述研究结果相符。因此目前共识[22]建议对持续存在的直径≥10 mm的pGGOs行手术切除或活检。结节的生长具有空间生长的各向异性,因此仅靠直径大小不能全面评估结节的膨胀性生长过程,而体积测量是个很好的指标[23]。研究显示AIS/MIA的体积为1955±1576 mm3,IA的体积为4171±3798 mm3,两者间差异有统计学意义[24]。Son等[25]的研究也显示AIS、MIA和IA之间在体积上存在差异。亦有研究显示,当体积≥542mm3时,GGOs多表现为浸润性生长,曲线下面积为0.740[21]。本研究中IA组体积为1418.41±1479.88 mm3,对照组体积为401.26±391.62 mm3。用ROC曲线分析体积大小的临界值为870 mm3,AUC值为0.773,诊断敏感度52.5%,特异性95.2%。最新研究可见不同浸润程度的pGGOs的体积生长有一定的区间范围,不同研究结果因不同软件算法存在一定差异,这解释了本研究和其它研究中临界值的差异。同理,这也体现在结节的质量上,本研究中两组患者的pGGOs在质量上也有统计学差异,用ROC曲线分析质量的临界值为306.9 mg,AUC值为0.769,诊断敏感度53.7%,特异性93.3%。在平均CT值这个指标上,有研究认为GGOs的平均CT值可预测其浸润成分[26]。Lee等[27]研究发现,在直径>15 mm的pGGOs中浸润性腺癌和非浸润性腺癌的两组间平均CT值有显著性差异,阈值为-472 HU,提示CT值越高,浸润程度越高。但本研究中,IA组和对照组的平均CT值并无显著性差异,这可能跟pGGOs的部位、检查时患者呼吸状态及背景肺有无肺气肿等方面有关[23]。因此,多项研究证实,随着pGGOs直径的变大,其体积及质量也在变化,病理性质遵循从AAH,AIS,MIA到浸润性腺癌的自然进展规律[6],直径、体积及质量的测量,在和病理性质的相关性上有举足轻重的作用,如今后在临床影像实践过程中逐步应用,更有利于结节良恶性的甄别。
在反映pGGOs的边缘和内部特征方面,本研究中两组患者在分叶和毛刺上有统计学差异,IA组患者的影像学更多表现出分叶和毛刺的恶性病变特征,而对照组在这两项上明显较少。在pGGOs的形状、胸膜牵拉征和血管集束征等方面两组患者并无明显统计学差异。既往研究发现,分叶、毛刺、边界不清、不规则形状、胸膜牵拉征、空泡征及血管集束征均提示恶性病变[28-29],Lee等[30]发现恶性pGGOs出现分叶征的比例明显高于良性(63.6%vs8.0%,P<0.05),认为分叶征是恶性病变的独立危险因素(OR=13.769,P=0.016),这和本研究结果一致。但在Kim等[31]的研究中,pGGOs的边缘被分为光滑、毛刺、分叶及毛刺伴分叶,发现边缘特征与结节恶性程度并无明显相关性。在临床实践中,pGGOs的分叶征、毛刺征、不规则形状、胸膜牵拉征、空泡征及血管集束征可以在一定程度上帮助区分其良恶性,甚至浸润程度。
随着肺癌靶向治疗的发展,多项研究着眼于肺癌相关的驱动基因,研究发现EGFR突变率在pGGOs中为36%[32]。Yang等[33]发现EGFR突变与GGOs的直径及体积密切相关。而本研究中,对照组(MIA+AIS)有8例行常见基因突变检测,仅有2例EGFR基因突变(25%),浸润性腺癌组中有20例行基因状态检测,其中EGFR突变9例(45%),未见KRAS、EML4-ALK、ROS1等基因突变,两组间在基因突变方面并无明显统计学差异,其中原因可能与对照组行基因检测病例较少有关。本研究中对照组及IA组的EGFR突变率分别为25%和45%,与其他报道类似[34-35],后期还应建议更多的患者行术后基因检测,以期在两组间基因突变状态方面有更多发现。
综上所述,肺纯磨玻璃结节的病理表现多样,结合HRCT影像特征及图像分析有助于对其定性诊断并指导后续随访策略及制定手术方案。对于直径大于10.8mm,体积大于870 mm3及质量大于306.9 mg的纯磨玻璃结节,伴有分叶征、毛刺征等恶性影像学特征,应积极微创手术,手术方式根据影像学及患者意愿,主要以亚肺叶切除联合淋巴结活检术,可获得令人满意的预后效果。本研究的局限性主要是单中心回顾性研究,难免存在病例选择偏移和样本量较少等因素对结果的干扰,后期将继续完善研究。