孕酮调节腺苷信号通路缓解大鼠神经病理性疼痛*
2020-06-16胡志妍贾改丽俞陈陈朱雅冰
苏 颖 胡志妍 贾改丽 李 莉 俞陈陈 朱雅冰 谢 红
(1 温州医科大学附属第二医院 育英儿童医院麻醉与围术期医学科,温州 325027;2 苏州大学附属第二医院麻醉科,苏州 215000;3 温州医科大学附属第二医院 育英儿童医院 浙江省麻醉学重点实验室,温州 325027;4 温州医科大学附属第一医院麻醉科,温州 325015)
国际疼痛学会定义由躯体感觉系统损伤或疾病引起的疼痛为神经病理性疼痛 (neuropathic pain, NP)[1]。NP 常继发于创伤、糖尿病、感染及癌症等,主要表现为痛觉过敏、异常性疼痛和自发性疼痛。NP 患病人数逐年增加,严重影响病人的生活质量,但目前临床治疗效果欠佳。NP 对于机体是一种慢性应激,能引起机体生理和心理等发生异常变化。其中对维持机体内环境稳定有重要作用的生殖内分泌系统是最易受到影响的系统之一。睾丸产生睾酮,是生殖内分泌系统敏感的靶器官。男性睾酮水平降低不仅影响免疫系统干扰炎症反应[2],还易使机体产生疼痛和不愉快情绪[3]。疼痛能激活大脑边缘系统的终纹床核(bed nuclei of the stria terminals, BST)神经元,该脑区是协调应激以及神经内分泌改变的重要脑区[4],也与疼痛引起的厌恶情绪密切相关[5]。从机体整体水平调节与NP 相关重要系统的功能比,仅治疗神经损伤部位更有助于NP 的改善。内源性神经类固醇孕酮对脑和脊髓都有保护作用,利于NP 的恢复[6,7],但其机制还未完全清楚。
孕酮影响具有镇痛作用的内源性腺苷水平,腺苷的镇痛作用主要是通过G 蛋白偶联腺苷A1 受体(adenosine 1 receptor, A1R)介导[8]。至今国内外尚无研究调节机体生殖内分泌系统靶器官功能对NP 影响的报道。因此,本实验通过建立坐骨神经结扎损伤(chronic constriction injury, CCI)模型,测定背根神经节 (dorsal root ganglion, DRG) 和脊髓背角(spinal dorsal horn, SDH)以及生殖内分泌系统靶器官睾丸和疼痛相关脑区BST 的腺苷上游信号胞外5'-核苷酸酶(ecto-5'-nucleotidase, CD73)和腺苷下游信号A1R 的表达,探讨孕酮治疗NP 时睾丸和BST腺苷信号改变对NP 的影响,为NP 的治疗提供更多研究基础和新思路。
方 法
1. 实验动物和主要试剂及仪器
实验用SPF 级SD 大鼠32 只,体重230±20 g,购自温州医科大学实验动物中心。实验主要试剂:孕酮(美国Sigma公司),DPCPX(美国Sigma公司),甲醇和乙腈(色谱纯,德国Merk 公司),NT5E/CD73 抗体(兔抗多克隆抗体,中国Proteintech 公司),Adenosine A1 Receptor 抗体(兔抗多克隆抗体,中国Proteintech 公司)。主要仪器:von Frey 电子自动测痛仪(美国Life Science 公司),336 爪/尾刺激痛觉测试仪(美国Life Science 公司),UPLC/MS/MS 液质联用仪(美国Waters 公司),石蜡切片机(德国Leica 公司),显微镜(日本Nikon 公司),蛋白质电泳设备(美国BIO-RAD 公司),超低温冰箱(美国Thermo 公司)。
2. 动物模型建立、分组及处理
32 只大鼠按随机数字表分为4 组 (n = 8):假手术组(Sham + 溶剂组,Sham + VEH 组)、模型组(CCI + VEH 组)、腺苷A1 受体拮抗剂组(DPCPX组,腹腔注射2 mg·kg-1,结扎后第14 天开始连续给药14 天,先后间隔半小时给予DPCPX 和孕酮)[9]、孕酮组(PROG 组,腹腔注射12 mg·kg-1,结扎后第14 天开始连续给药14 天)[10,11]。参照Bennett 等的方法,建立CCI 大鼠模型,结扎右后肢坐骨神经。为避免操作差异,所有动物的手术操作由同一人进行,术后大鼠单笼饲养。CCI 模型建立后第7 天,痛阈降低30%以上,且出现术侧爪内收、后足轻度外翻和跛行,显示模型成功,否则予以剔除。术前1 天、术后第7、14、21 和28 天给药后进行机械性缩足阈值 (mechanical withdrawal threshold, MWT)和热缩足反射潜伏期 (thermal withdrawal latency, TWL) 两种行为学测试。术后第28 天行为学测试后取血清测定血清睾酮含量;每组3 只大鼠甲醛灌注,取L4-5DRG 和对应的脊髓节段检测CD73 免疫组化阳性细胞;每组5 只大鼠进行L4-5DRG 和对应的脊髓节段取材,检测A1R 蛋白表达,并进行睾丸和BST 脑区取材,检测CD73 和A1R 蛋白表达。
3. MWT 的测定
用von Frey 电子自动测痛仪检测大鼠MWT。实验时将大鼠置于有机玻璃罩内,底部为用金属丝制成的网格垫,测试前让大鼠适应30 min,此期间大鼠活动较多,有便溺行为,仔细清理网格上的粪便,30 min 后用von Frey 细丝垂直刺激大鼠右后足底部中间的区域(未实施手术的足底则刺激与之相同的区域),待大鼠有明确反应(如舔足、突然收缩或抖足等)时,记录液晶显示器上的数字度数,该读数即为大鼠的机械缩足反射阈值;最大施加力度为55 g,每次测试至少间隔约10 min,等候刺激引起的行为反应(如舔足等)完全消失后再给予下一次刺激;MWT 为3 次测试的平均值。
4. TWL 的测定
采用336 爪/尾刺激痛觉测试仪测定大鼠TWL。参数设定:加热头空闲时激光发射强度为20%,加热头测试工作时激光发射强度为60%,切断时间30 s,以防测试时间过长对动物造成损伤,触发温度30℃;将实验大鼠置于透明玻璃板上,照射大鼠右侧后足足底至出现抬腿回避时间为热缩足反射潜伏期;每次刺激间隔5 min,测3 次取平均值。
5. 液质联用(LC-MS/MS)检测血清睾酮含量
连续给药14 天行为学检测后取血,参考Gao等[12]的方法并加以改进,测定大鼠血清睾酮含量。
色谱条件:色谱柱:Waters Acquity UPLC HSS C18(100 mm×2.1 mm×1.7 μm);流动相:0.1% 乙酸(流动相A),乙腈(流动相B),流速0.4 ml·min-1;柱温30℃;样品室温度10℃;进样量为10 μl,采用梯度洗脱程序:60% A~40% B,1 min;10% A~90% B,1.5 min;60% A~40% B,1.4 min。
质谱条件:采用ESI 正电离模式,多离子反应监测(MRM),毛细管电压为3 000 V,锥孔电压38 V,离子源温度150℃,脱溶剂气温度500℃;锥孔气流量50 L·h-1;脱溶剂气流量均为1 000 L·h-1;碰撞气为氩气,碰撞能量22 V;母离子:289.1,子离子:97.1。标准质量测定采用FBS 血清-睾酮溶液。
6. 免疫组化检测DRG 和SDH 的CD73 表达
连续给药14 天行为学检测后以5%水合氯醛深麻醉大鼠,待意识消失后开胸经左心室-升主动脉插管,生理盐水快速灌注至右心室流出液透亮后,再灌注4%多聚甲醛150 ml,见肝脏发白、四肢僵直,将大鼠L4-5DRG 和对应脊髓节段取出,4%多聚甲醛固定24 h 后,梯度蔗糖溶液脱水,石蜡包埋,做连续冠状切片,片厚4 μm,54℃恒温水浴展片,晾干备用。依次60℃烤片、二甲苯脱蜡至水化、梯度乙醇脱水、枸橼酸修复液中高压热修复抗原;3%过氧化氢封闭后分别加入兔抗鼠CD73 抗体(1:500)或兔抗鼠A1R 抗体(1:500),37℃孵育2 h 后PBS液冲洗;加入抗兔两步法检测试剂,37℃孵育2 h后PBS 液冲洗;DAB 显色、苏木素复染;分化、脱水、透明、封片。尼康倒置显微镜观察并采集图像,每组选3 张切片,每张切片随机挑选3 个100 倍视野进行拍照,胞质中出现棕黄色颗粒者为阳性细胞。采用Image-Pro Plus 6.0 软件进行分析。
7. Western blot 检测DRG 和SDH 的A1R 蛋白、睾丸和BST 脑区CD73 和A1R 蛋白含量的变化
以5%水合氯醛深麻醉后处死大鼠,迅速在冰上分离L4-5DRG 和对应脊髓节段、睾丸和BST 脑区,分别置于冻存管中液氮速冻。检测时加入组织裂解液和酶抑制剂,冰上匀浆,离心取上清;BCA 法测蛋白浓度;配平后加入SDS-PAGE 蛋白上样缓冲液(5×)100℃变性,冷却后离心-20℃保存;分别配置5%浓缩胶和10%分离胶(SDS-PAGE);加入marker 和样本,电泳至溴酚蓝达分离胶底部(75 V 45 min 和120 V 90 min);再将蛋白电转至PVDF膜上(恒流200 mA 1 h);5%脱脂奶粉封闭1 h;TBST 洗膜,加入兔抗鼠CD73 一抗(1:1 000 稀释)或兔抗鼠A1R 一抗(1:1 000 稀释),4℃孵育过夜;TBST 洗膜3 次;加入二抗(1:3 000)孵育2 h;TBST 洗膜3 次;膜上均匀涂抹化学发光底物,在凝胶成像系统中曝光扫描条带,Alpha 软件处理系统分析目标蛋白条带的相对灰度值。
8. 统计学分析
应用SPSS 13.0 软件进行统计分析,数据以均数±标准差(±SD)表示,用Levene 法检测方差是否齐性。行为学结果比较采用重复测量方差分析,两两比较用最小显著差法(LSD),校正系数Epsilon < 0.7时,选择Bonferroni 法进行两两比较;其他实验结果采用One-way ANOVA 方差分析,方差齐性时两两比较用LSD 法,方差不齐时用Dunnett's T3 法。P < 0.05 为差异有统计学意义。
结 果
1. 各组大鼠MWT 和TWL 的变化
造模前各组大鼠的MWT 和TWL 基础值之间均无显著性差异,造模后未见感染和自残现象。CCI 大鼠术侧爪内收、足外翻和跛行,Sham + VEH 组大鼠无此表现。CCI 术后有4 只大鼠行为学测定值的标准差大,予以剔除,每组7 只动物继续进行实验。
与Sham + VEH 组相比,其他3 组大鼠MWT在术后第7 天有明显下降(P < 0.01),第14 天分别降至最低,且这3 组间差异无统计学意义。分别给予药物或溶剂后,第21 天 PROG 组MWT 比CCI + VEH 组和DPCPX 组都显著回升(P < 0.01),而DPCPX 组与CCI + VEH 组间无明显差异。第28 天各组MWT维持相对稳定(见图1)。
术后第7 天,除Sham + VEH 组外其他3 组TWL 都显著降低(P < 0.01),第14 天降至更低,这3 组间差异无统计学意义。给药后,第21 天和第28 天时PROG 组TWL 比CCI + VEH 组和DPCPX组均显著升高(P < 0.01);DPCPX 组与CCI + VEH 组TWL 在第21 天和第28 天时差异无统计学意义(见图2)。
2. 血清睾酮含量的变化
经LC-MS/MS 检测,睾酮及内标睾酮-D3 的质谱图见图3,色谱图见图4。睾酮的标准曲线回归方程为Y = 0.0 008 784 x + 0.07369,R2为0.9978,线性范围100~10 000 pg·ml-1,最低定量限100 pg·ml-1。回收率在±15%以内,RSD 均小于10%,由绝对回收率和基质效应得出血清中内源性物质对睾酮和内标的测定没有影响,此检测方法准确、可靠。CCI + VEH 组比Sham + VEH 组的睾酮含量显著减少(P < 0.05)。与CCI + VEH 组相比,PROG 组和DPCPX 组睾酮含量都有回升(P < 0.05),但PROG组回升的更显著(P < 0.05,见图5)。
3. DRG 和SDH 的CD73 表达变化

图1 各组大鼠MWT 变化(n = 7, ±SD)*P < 0.01,与 Sham + VEH 组相比;#P < 0.05,与CCI + VEH 组相比;△P < 0.05,与DPCPX 组相比Fig. 1 Variations of MWT (n = 7, ±SD)*P < 0.01, compared with group Sham + VEH; #P < 0.05, compared with group CCI + VEH; △P < 0.05, compared with group DPCPX.
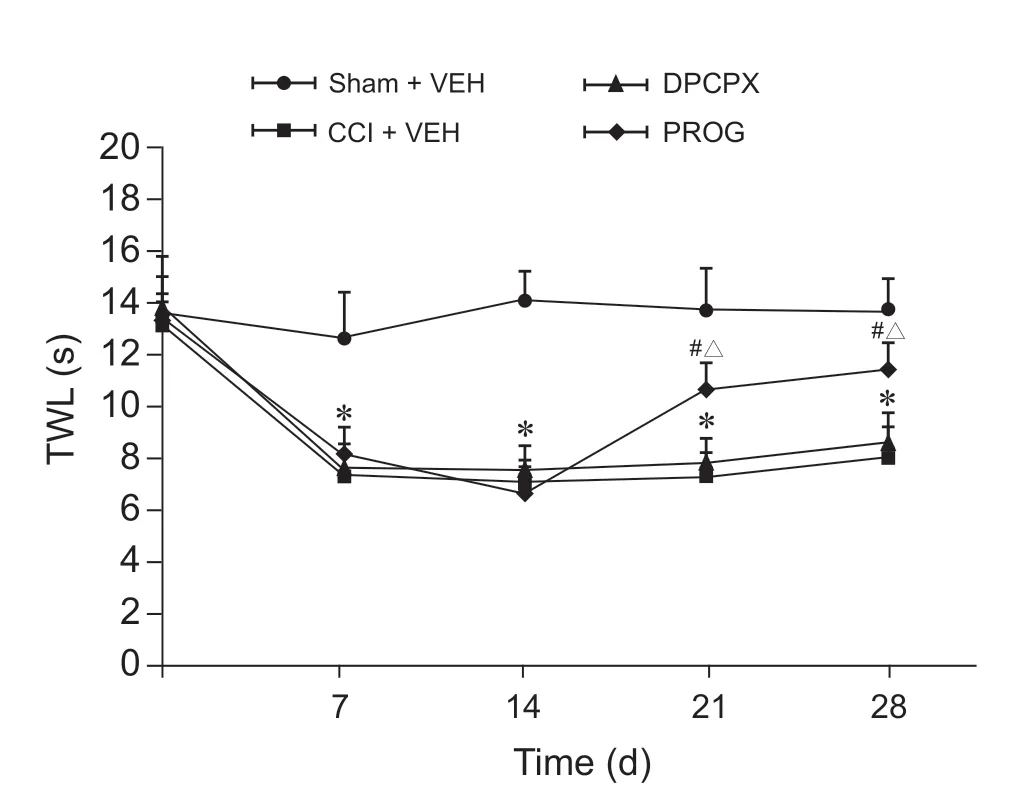
图2 各组大鼠TWL 变化 (n = 7, ±SD)*P < 0.01,与 Sham + VEH 组相比;#P < 0.05,与CCI + VEH 组相比;△P < 0.05,与DPCPX 组相比Fig. 2 Variations of TWL (n = 7, ±SD)*P < 0.01, compared with group Sham + VEH; #P < 0.01, compared with group CCI + VEH; △P < 0.05, compared with group DPCPX.
CD73 是促进腺苷生成的上游酶,高表达于DRG 和SDH 神经元上。CCI 模型大鼠坐骨神经结扎后第14 天开始连续给予孕酮或提前半小时注射A1R 拮抗剂,第28 天检测DRG(左列)和SDH(右列)的CD73 免疫组化染色结果(见图6)。SDH 与DRG 情况类似,PROG 组和DPCPX 组与CCI + VEH组相比,差异均有统计学意义,PROG 组也与DPCPX 组间有显著性差异。提示孕酮促进这两处组织CD73 的恢复,以便机体产生更多适量的腺苷发挥镇痛作用,但A1R 拮抗剂能减弱这种促进作用。

图3 睾酮和睾酮-D3 质谱图Fig. 3 Mass spectrum of testosterone and testosterone-D3
图4 睾酮和睾酮-D3 血清样品色谱图(A, D)分别为不含睾酮和睾酮-D3 的空白FBS 血清;(B, E)分别为含睾酮和睾酮-D3 的FBS 血清标准添加样品(线性中间浓度);(C, F)分别为含睾酮和睾酮-D3 的实测大鼠血清样品Fig. 4 Chromatogram of testosterone-D3 in serum(A, D) were blank FBS serums without testosterone or testosterone-D3, respectively; (B, E) were FBS serum spiked samples (Linear intermediate concentration) for testosterone and testosterone-D3 apart; (C, F) were measured serum samples of rats for testosterone and testosterone-D3 separately.
4. DRG 和SDH 的A1R 蛋白及睾丸和BST 脑区的CD73、A1R 蛋白变化
睾丸合成的睾酮引起的作用及BST 产生的痛觉相关厌恶情绪都与外周NP 的进展密切相关。CD73分布于全身各组织器官。腺苷A1R 高表达于DRG和SDH 神经元上,在睾丸主要表达于支持细胞,高密度表达于中枢神经系统。本研究在第28 天行为学测试后各组5 只大鼠取出DRG、SDH、睾丸和BST 脑区组织,提取总蛋白后检测CD73 或A1R 蛋白相对浓度。使用β-actin 为内参蛋白。免疫印记条带显示,睾丸和BST 脑区CD73 蛋白在PROG 组和DPCPX 组间无差异,但这两组的CD73 蛋白水平均显著高于CCI + VEH 组,提示孕酮治疗利于睾丸和BST 脑区的CD73 蛋白恢复,但拮抗A1R 未明显干扰此作用;坐骨神经结扎后CCI + VEH 组上述四种组织的A1R 蛋白比Sham + VEH 组均减少(P < 0.05);给予孕酮后,PROG 组这四种组织的A1R 蛋白表达均比CCI + VEH 组显著增多(P < 0.05);然而DPCPX 组这四种组织的A1R 蛋白均比PROG 组显著减少(P < 0.05,见图 7),说明拮抗A1R 影响孕酮治疗引起的A1R 蛋白水平恢复。

图5 各组大鼠血清睾酮含量 (n = 7, ±SD)*P < 0.01,与Sham + VEH 组相比;#P < 0.01,与CCI + VEH 组相比;△P < 0.01,与DPCPX 组相比Fig. 5 Testosterone levels in serum (n = 7, ±SD)*P < 0.01, compared with group Sham + VEH; #P < 0.01, compared with group CCI + VEH; △P < 0.01, compared with group DPCPX.
讨 论


图6 各组大鼠背根神经节和脊髓背角CD73 表达的免疫组化检测 (n = 3, ±SD) (200×, Scale bar = 200 μm)(A, E) Sham + VEH 组; (B, F) CCI + VEH 组;(C, G) DPCPX 组; (D, H) PROG 组;(I) 各组背根神经节和脊髓背角CD73 阳性细胞计数*P < 0.05,与Sham + VEH 组相比;#P < 0.05,与CCI + VEH 组相比;△P < 0.05,与DPCPX 组相比Fig. 6 Immunohistochemistry detection of expression of CD73 in DRG and the SDH (n = 3, ±SD) (200×, Scale bar = 200 μm)(A, E) Sham + VEH group; (B, F) CCI + VEH group; (C, G) DPCPX group; (D, H) PROG group; (I) positive cell counting for each group*P < 0.05, compared with group Sham + VEH; #P < 0.05, compared with group CCI + VEH; △P < 0.05, compared with group DPCPX.

图7 各组大鼠CD73 和A1R 蛋白表达反应条带和相对蛋白浓度比较 (n = 4, ±SD)(A-D)蛋白表达反应条带;(A) 背根神经节;(B) 脊髓背角;(C) 睾丸;(D) BST 脑区;(E) 睾丸和BST 脑区CD73蛋白相对浓度;(F) 四种组织A1R 蛋白相对浓度*P < 0.05,与Sham + VEH 组相比;#P < 0.05,与 CCI + VEH 组相比;△P < 0.05,与DPCPX 相比Fig. 7 The protein expression and relative concentration of CD73 and A1R (n = 4, ±SD)(A-D) The protein expression; (A) The protein expression in DRG; (B) the protein expression in SDH; (C) the protein expression in testis; (D) the protein expression in brain BST; (E) the relative concentration of CD73 in testis and brain BST; (F) the relative concentration of A1R in the four tissues*P < 0.05, compared with group Sham + VEH; #P < 0.05, compared with group CCI + VEH; △P < 0.05, compared with group DPCPX.
NP 引起机体的应激反应,影响生殖内分泌系统的功能。同时,生殖内分泌系统功能的改变,也会对NP 产生调节作用。病理情况下男性睾酮水平降低,更易产生疼痛和不愉快情绪。对发生NP 的糖尿病雄性大鼠给予睾酮代谢产物干预,可以改善痛阈,并通过调节突触前膜和突触后膜、谷氨酸释放以及多种免疫和转运蛋白等调节NP[13]。本研究中坐骨神经损伤使CCI + VEH 组血清睾酮水平显著降低,但给予孕酮治疗后有所回升,且可被A1R 拮抗剂抑制。这些说明既是雄性激素也是神经类固醇的睾酮参与了NP 的进展,具有镇痛作用的内源性腺苷与机体的疼痛和应激反应密不可分。腺苷是由CD73 催化三磷酸腺苷代谢产物5'-AMP 去磷酸化生成,这一过程能迅速减少局部组织内三磷酸腺苷的积聚,也直接影响腺苷功能的实现。鞘内注射重组CD73 可以改善小鼠的热痛和机械痛,但对A1R 基因敲除小鼠无效。Kan 等也发现A1R 敲除小鼠和正常小鼠相比,TWL 缩短,坐骨神经结扎后A1R 敲除小鼠比正常小鼠的热痛觉过敏症状更加明显。拮抗A1R 可以阻碍外源性腺苷缓解辣椒辣素对小鼠引起的NP[14]。这些都提示A1R 是腺苷发挥镇痛作用的重要受体。为了深入探索改善NP 的分子机制,本研究从调控腺苷生成的上游酶CD73 和腺苷下游A1R 为靶点进行检测。本研究也发现孕酮治疗后能使NP 大鼠睾丸组织降低的CD73 蛋白和A1R 蛋白都明显提高,与睾酮水平的变化相符,结合NP 的行为学改变,说明孕酮对睾丸腺苷信号的调节可能与NP 的改善有关。
神经元周围组织环境的改变干扰机体内环境的平衡。发生NP 时,合成神经类固醇的酶和活性神经类固醇都增多,参与了NP 的调节过程[15],这是机体的保护性反应,孕酮属于这类重要的类固醇。有研究发现,孕酮抑制实验性脊髓损伤和CCI 大鼠异常性疼痛[7],也可显著改善大鼠NP 痛觉过敏和异常性疼痛的行为学得分[11]。本研究结果显示,连续给予孕酮治疗7 天后,即手术后第21 天,PROG组的机械痛阈和热痛阈都比CCI + VEH 组显著性升高,NP 得以改善,研究结果与文献报道一致。研究报道,一定剂量范围内的孕酮治疗动物外周神经损伤,产生保护作用的同时不会导致明显的不良反应[10]。孕酮可作用于机体多种组织器官,又可以从多方面保护神经功能,故本研究使用孕酮作为NP的治疗药物。
早期Pençe 等发现孕酮能使腺苷脱氨酶水平降低,间接促使内源性腺苷水平升高,这提示孕酮影响腺苷的代谢。本研究从孕酮调节腺苷生成的角度进行探索。在生理和病理条件下,全身各组织都可以产生腺苷,即腺嘌呤核苷。腺苷是中枢神经系统重要的神经调节因子。神经源性疼痛的病人血液及脑脊液中腺苷的浓度低于只有神经系统损伤而无疼痛的病人。劳力型心绞痛的病人静脉注射低剂量腺苷可以减轻疼痛的症状,而对心率、血压以及心电图征象均无影响。腺苷也经常被用来治疗病人的术后疼痛,可以减少其他术后镇痛药的用量。安慰剂对照的双盲实验中,给NP 病人静脉或鞘内注射腺苷,都可减轻病人的痛觉过敏、异常性疼痛和/或自发性疼痛的症状,这种止痛作用可以持续数小时甚至数天。既然已有临床实验发现注射大剂量的腺苷或类似物对脊髓无神经毒性,不会使运动功能显著受损,那么如果可以通过改变相关组织和器官的内源性腺苷水平来调节NP,可能会使NP 的治疗更加安全有效,而本研究使用的孕酮就可以改变机体内源性腺苷水平。
NP 形成过程中,DRG 和SDH 神经元发挥复杂的调节作用,参与痛觉信息处理过程。CD73 和A1R高表达于这两处组织的神经元上。这些神经元上A1R 的激活,抑制炎症和神经损伤导致的NP。本研究给予大鼠孕酮治疗14 天后,PROG 组比CCI + VEH组DRG 和SDH 的CD73 阳性细胞明显增多,使机体产生更多适量的腺苷发挥镇痛作用,拮抗A1R 明显 干 扰 此 作 用。PROG 组DRG 和SDH 的A1R 蛋白都比对应的CCI + VEH 组显著增多,也显著高于DPCPX 组,证明孕酮促进A1R 蛋白恢复的作用可被A1R 拮抗剂抑制。结合行为学改变,提示孕酮促进NP 大鼠传入神经DRG 和初级传入神经中枢SDH 的CD73 和A1R 蛋白恢复,参与了NP 的改善过程。
男性生殖系统不是孤立的,与神经内分泌系统密切作用形成生殖内分泌系统,即下丘脑-垂体-睾丸轴,是最易受到应激影响的重要系统之一,对维持机体内环境的稳定有重要作用。BST 含有性激素受体,睾酮水平的变化也影响该脑区核团的功能。BST 位于伏隔核的后方,是连接边缘前脑与下丘脑室旁核HPA 轴效应神经元的重要脑区。生成促肾上腺皮质激素释放激素的神经元胞体位于BST 内,其部分神经纤维密集投射到下丘脑[16],影响生殖内分泌系统功能。疼痛引起腹侧与背侧BST 内的去甲肾上腺素和促皮质素释放因子的释放,激活BST II 类神经元,抑制从BST 投射到VTA 区的输出型GABA 能神经元,使VTA 区输入型GABA 能神经元的抑制作用增强及VTA 区多巴胺能神经元兴奋性减弱,引起与疼痛密切相关的厌恶情绪[5]。腹侧BST 的谷氨酸—一氧化氮信号被激活,引起诱导型超极化阳性神经元兴奋也是厌恶情绪产生的重要环节[17]。疼痛引起的与BST 脑区相关的厌恶情绪属于应激情绪,都不利于恢复机体内环境的平衡和疾病的康复,减弱这种厌恶不良情绪将有利于NP的恢复[18,19]。本研究结果显示孕酮对NP 大鼠BST脑区CD73 蛋白和A1R 蛋白有明显的修复作用,其中A1R 蛋白修复作用可被A1R 拮抗剂抑制,结合行为学改变,提示孕酮对该脑区腺苷信号的调节可能也参与了NP 改善的过程。这些与孕酮通过另一个脑区对NP 大鼠产生保护作用的研究结果相呼应[20]。本研究中PROG 组与DPCPX 组相比,睾丸和BST脑区CD73 蛋白改变不明显,可能用孕酮治疗NP 时,抑制这两个组织和器官的A1R,只影响腺苷信号下游受体作用,未影响到腺苷信号上游的调节因子。
综上所述,从机体整体水平调节与NP 相关的生殖内分泌系统靶器官睾丸和疼痛相关脑区BST 功能,更有利于NP 的改善。调节DRG 和SDH 以及生殖内分泌系统睾丸和BST 脑区中促进腺苷生成的上游酶CD73 或下游受体A1R 参与了孕酮治疗NP的过程。鉴于NP 调节机制复杂,更深入的调节机制以及与这些组织和器官中神经胶质细胞功能的调节、对腺苷其他亚型受体或其他类型受体和胞内信号的作用等,还需进行更多研究。本研究为今后探索治疗NP 的新方法提供了理论依据。
