降糖增效方对糖尿病大鼠肝脏胰岛素信号通路IRS1位点磷酸化的影响
2020-06-12许光远张晓明
许光远 张晓明

〔摘要〕 目的 通過观察降糖增效方对糖尿病大鼠肝脏胰岛素受体底物1(insulin receptor substrates 1,IRS1)磷酸化的影响来探讨该方发挥降糖增效作用的机制。方法 将40只6~8周龄雄性ZDF(fa/fa)大鼠随机分为模型组、二甲双胍组(0.134 g/kg)、降糖增效方组(0.64 g/kg)、联合组(降糖增效方0.64 g/kg+二甲双胍0.134 g/kg),另选ZDF(fa/+)大鼠10只为正常组,连续干预6周;实验结束检测体空腹血糖(fasting blood glucose,FBG)、血清胰岛素水平(fasting insulin,FINS)、胰岛素抵抗指数(homeostatic model assessment of insulin resistance,HOMA-IR)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、血肌酐(serum creatinine,Scr)、尿素氮(blood urea nitrogen,BUN)、口服葡萄糖耐量试验(oral glucose tolerance test,OGTT);蛋白免疫印迹法(Western bloting)检测IRS1丝氨酸磷酸化位点ser307、ser612、ser1101表达。结果 与模型组相比较,各治疗组大鼠FBG、FIns、HOMA-IR、OGTT 2 h血糖水平、AUC、SCr、BUN显著降低(P<0.05,P<0.01);肝组织p-IRS1 Ser307、p-IRS1 ser612、p-IRS1 ser1101蛋白表达显著降低(P<0.05,P<0.01);与二甲双胍、降糖增效方组比较,联合组大鼠FBG、FIns、HOMA-IR显著降低(P<0.05,P<0.01);OGTT2 h血糖水平以及AUC显著降低(P<0.05,P<0.01);肝组织p-IRS1 Ser307、p-IRS1 ser612、p-IRS1 Ser1101蛋白表达显著降低(P<0.05,P<0.01)。结论 降糖增效方降低糖尿病大鼠肝脏IRS1 ser307/612/1101位点磷酸化水平,这可能是其增加降糖疗效的机制。
〔Abstract〕 Objective To observe effects of Jiangtang Zengxiao Fang (JZF) on phosphorylation of insulin receptor substrates 1 (IRS1) in diabetic rats, and to investigate the mechanism of synergism of reducing blood glucose. Methods A total of 40 6-8 week male ZDF (fa/fa) rats were randomly divided into a model group, a metformin group (0.134 g/kg), a JZF group (0.64 g/kg), and a combination group (JZF 064 g/kg + metformin 0.134 g/kg). Another 10 ZDF (fa/+) rats were set as a normal group. The rats were continuously intervened for 6 weeks. Fasting blood glucose (FBG), fasting insulin (Fins), homeostasis model assessment-Insulin resistance (HOMA-IR), aspartate aminotransferase (AST), serum creatinine (Scr), blood urea nitrogen (BUN) and oral glucose tolerance test (OGTT) were detected after experiment. Western blot was used to detect the expression of ser307, ser612, ser1101 in phosphorylation of IRS1 in liver. Results Compared with the model group, FBG, Fins, HOMA-IR, Blood glucose level of 2 h in OGTT, AUC, AST, Scr and BUN in each group were decreased significantly (P<0.05, P<0.01). p-IRS1 ser307, p-IRS1 ser612, p-IRS1 ser1101 protein expression level in the liver tissue were decreased significantly (P<0.05, P<0.01). Compared with JZF group and metformin group, FBG, Fins and HOMA-IR of the combination group were decreased significantly (P<0.05, P<0.01). Blood glucose level and AUC were significantly decreased at 2 h in OGTT (P<0.05, P<0.01). p-IRS1 ser307, p-IRS1 ser612, p-IRS1 ser1101 protein expression level in the liver tissue were significantly decreased (P<0.05, P<0.01). Conclusion JZF can regulate p-IRS1 ser307, p-IRS1 ser612, p-IRS1 ser1101 expression in liver tissue of diabetic rats, which might be the mechanism of improving the efficacy of reducing blood glucose.
〔Keywords〕 Jiangtang Zengxiao Fang; diabetic model rats; metformin; insulin receptor substance; phosphorylation; insulin signaling pathway
根据国际糖尿病联盟(international diabetes federation,IDF)2017年统计,目前全球有糖尿病患者4.25亿,其中90%为2型糖尿病(type 2 diabetes mellitus,T2DM),预计到2045年,糖尿病患者可能达到6.29亿[1]。我国近30年来糖尿病患病率显著增加,2013年我国糖尿病及糖尿病前期最新流行病学数据显示,20岁以上成年人糖尿病患病率为10.9%,糖尿病人数已超1亿,而且,还有35.7%的糖尿病前期高危人群[2],糖尿病已成为非常严重的公共健康问题。
降糖增效方是在临床经验基础上结合现代药理研究组方而成的中药降糖复方,由黄芪、苦瓜、桑叶、玉竹、石斛、三七、神曲、肉桂组成,前期已获保健食品批准文号(国食健字G20130302)以及国家专利(专利号:ZL2007101060118)。前期实验表明本品对糖尿病大鼠具有降低血糖、改善胰岛素抵抗、保护β细胞、降低血脂作用[3];其主要成分如苦瓜总皂苷、桑叶总黄酮、桂皮醛、三七总皂苷等也有明确降糖、改善胰岛素抵抗作用[4-5]。为了进一步探索降糖增效方治疗2 型糖尿病的作用机制,本实验选用降糖增效方干预自发性糖尿病肥胖(zucker diabetes fatty, ZDF)大鼠,观察其降糖、改善胰岛素抵抗的作用,探讨其降糖增效作用的机制。
1 材料
1.1 实验动物
SPF级雄性自发性2型糖尿病模型ZDF(fa/fa)大鼠40只,6~7周龄,体质量(200±20) g,同周龄正常雄性ZDF(fa/+)大鼠10只,购自北京维通利华实验技术有限公司,许可证编号:SCXK(京)2012-0001。大鼠饲养于中国中医科学院中医基础理论研究所SPF级动物实验室(实验动物使用许可证:SYXK 京2010-0032),温度(23±2) ℃、湿度(55±10)%,12/12 h光照黑暗循环,自由摄食饮水。ZDF(fa/fa)大鼠饲料(蛋白质26.85%,脂肪16.71%,碳水化合物56.44%)喂养,ZDF(fa/+)大鼠普通饲料喂养。通过动物实验伦理审查(编号2016-006)。
1.2 药物与试剂
降糖增效方(10 g/袋,北京中医药大学东方医院颗粒药房,批号160708);盐酸二甲双胍片(0.5 g/片,中美上海施贵宝制药有限公司,批号20150109);血肌酐(serum creatinine,SCr)试剂盒(中生北控生物科技股份有限公司,批号20180602);血尿素氮(blood urea nitrogen,BUN)试剂盒(中生北控生物科技股份有限公司,批号20180304);天门冬氨酸氨基转移酶(aspartate transaminase,AST)试剂盒(中生北控生物科技股份有限公司,批号20180306);胰岛素(fasting insulin,FIns)试剂盒(北京华英生物技术研究所,批号20162400316);RIPA裂解缓冲液(批号20180404)、BCA蛋白定量试剂盒(均来自北京普利莱基因技术有限公司,批号20180114);磷酸化胰岛素受体底物蛋白1絲氨酸1101/612/307(phospho-insulin receptor substrate 1 Ser1101/Ser612/Ser307,p-IRS1 ser1101/ser612/ser307)、β-actin 抗体(CST公司,批号0005,0003,0005,0021);羊抗兔二抗(CST公司,批号0026);Block one/Block one-P(日本京都Nacalai Tesque 公司,批号分别L4E0085,L5G4440);ECL发光液(美国BIO-RAD公司,批号20170708)。
1.3 仪器
7160型全自动生化仪(日本日立公司);r-911型全自动放免计数仪(中国科技大学实业总公司);E9032型酶标仪(美国Promega公司);7500型PCR扩增仪(美国ABI 公司);Mini-PROTEAN型垂直电泳仪、转移槽、ChemiDocTM XRS+型凝胶成像系统(美国BIO-RAD公司)。
2 方法
2.1 分组与干预
检测适应性喂养后ZDF(fa/fa)大鼠尾静脉血糖,不同次随机血糖≥11.1 mmol/L为成模标准[6],按血糖随机分层分为:模型组、二甲双胍组(0.134 g/kg)、降糖增效方组(0.64 g/kg)、联合组(二甲双胍0.134 g/kg+降糖增效方0.64 g/kg),10只/组;10只雄性ZDF(fa/+)大鼠为正常组;按体表面积法折算大鼠给药剂量[7],正常组、模型组给等容量生理盐水,1次/日,连续6周。
2.2 标本采集
干预6周后,各组小鼠未出现死亡,禁食过夜后,麻醉后腹主动脉取血,离心抽取血清冻存;剖取肝脏,-80 ℃冻存待用。
2.3 生化指标检测
取大鼠血清,全自动生化仪检测空腹血糖(fasting blood glucose,FBG)、BUN、SCr、AST;全自动放免计数仪检测FIns,计算胰岛素抵抗指数(homeostaticmodel assessment of insulin resistance,HOMA-IR)。
2.4 口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)实验第6周,大鼠禁食12 h,葡萄糖2 g/kg灌胃,尾静脉取血,分别检测0、30、60、120 min血糖(blood glucose,BG)并计算曲线下面积(AUC)。
2.5 Western Blot检测P-IRS1 ser 307、612、1101蛋白表达 每组取6只大鼠肝组织,RIPA裂解提取总蛋白,高温蛋白变性,检测蛋白浓度;12% SDS-PAGE 凝胶电泳100 V 1.5 h,半干法转膜后TBS溶液洗10 min;Blocking one/Blocking one-P封闭30 min,一抗(1∶1 000稀释)4 ℃孵育过夜;洗膜,二抗(1∶10 000)室温1 h。洗膜后ECL发光液避光孵育2 min,凝胶成像系统显影,Image J 7.0软件进行图像分析,以目的蛋白/内参蛋白灰度值计算蛋白表达水平。
2.6 统计学方法
采用SPSS 19.0软件处理数据,数据用“x±s”表示,多组间比较采用单因素方差分析(One-Way ANOVA)方法;两组间比较,满足方差齐性时用 LSD 检验,不满足方差齐性时用非参数检验;P<0.05表示差异有统计学意义,P<0.01表示差异有显著统计学意义。
3 结果
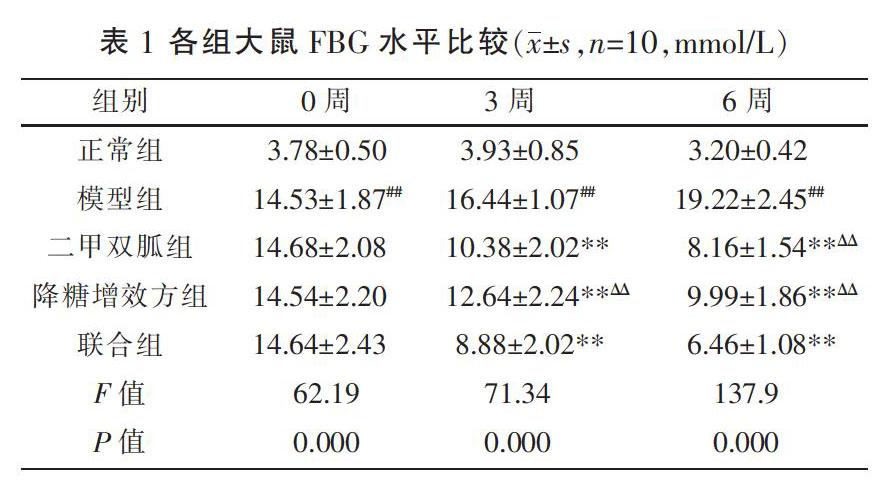
3.1 各组大鼠FBG比较
与正常组比较,模型组大鼠FBG水平显著升高(P<0.01);与模型组比较,各治疗组大鼠FBG显著降低(P<0.05,P<0.01)。联合组大鼠FBG较二甲双胍组、降糖增效方组显著降低(P<0.05,P<0.01)。见表1。
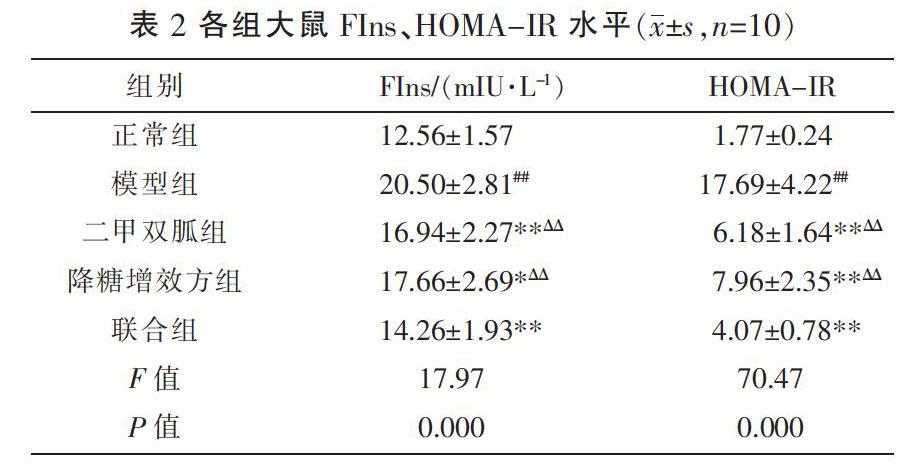
3.2 各组大鼠FIns、HOMA-IR比较
实验6周后,与正常组比较,模型组大鼠FIns、HOMA-IR水平显著升高(P<0.01);与模型组比较,各治疗组大鼠FIns、HOMA-IR显著降低(P<0.05,P<0.01)。联合组大鼠FIns、HOMA-IR较二甲双胍组、降糖增效方组显著降低(P<0.01),说明联合用药在改善大鼠胰岛素抵抗方面效果优于单独用药。见表2。
3.3 各组大鼠OGTT比较
实验6周后,与正常组比较,模型组大鼠0、30、60、120 min血糖及AUC显著升高(P<0.01),且血糖最高峰值延后;与模型组比较,各治疗组大鼠0、60、120 min血糖及AUC显著降低(P<0.05,P<0.01);二甲双胍组大鼠0、120 min血糖及AUC结果显著高于联合组(P<0.05,P<0.01),降糖增效方组0、30、60、120 min血糖及AUC结果显著高于联合组(P<0.05,P<0.01)。见表3。
3.4 各组大鼠肝肾功能比较
实验6周后,与正常组比较,模型组大鼠血清AST无差异(P>0.05),SCr、BUN显著增高(P<0.01);与模型组比较,二甲双胍组、降糖增效方组、联合组大鼠血清AST无差异(P>0.05),SCr、BUN降低(P<0.05,P<0.01)。见表4。
3.5 各组大鼠肝脏p-IRS1 Ser 307、p-IRS1 Ser 612、p-IRS1 Ser 1101蛋白表达比较
与正常组比较,模型组大鼠p-IRS1 Ser 307/612/1101表达水平显著升高(P<0.01);与模型组比较,各治疗组大鼠p-IRS1 Ser 307/612/1101显著降低(P<0.05,P<0.01);联合组大鼠p-IRS1 Ser 307/612/1101表達水平较二甲双胍组、降糖增效方组显著降低(P<0.01)。见表5。
4 讨论
胰岛素抵抗(insulin resistance,IR)是糖尿病发病的主要机制之一,常伴随着机体高血糖、高胰岛素血症、高脂血症等发生,同时也是糖尿病血管、神经系统并发症发生的原因之一[8]。实验研究发现,改善糖尿病大鼠胰岛素抵抗,能够降低大鼠血糖、血脂水平,甚至炎症、氧化应激等状态[9-10]。中医药在治疗糖尿病方面积累了丰富的经验,能够联合西药,发挥协同作用来增强疗效,减缓不良反应。中药降糖增效方是由苦瓜、桑叶、玉竹、三七、肉桂等药物组成,本方以苦瓜为君药清虚热,桑叶、玉竹为臣药,助苦瓜清虚热,同时补阴津;三七行血,佐助行散药力,少量肉桂反佐以防清热太过、寒凉伤及脾胃。方中药物配伍得当,益气与滋阴清热并重、补泻同用、寒热并治,做到滋补而不壅滞、清热而寒凉,清热滋阴益气。前期研究发现,本方能够作用于糖尿病大鼠骨骼肌胰岛素信号传导通路的胰岛素受体、蛋白激酶B、葡萄糖转运蛋白4等靶点,具有降糖、降脂、改善胰岛素抵抗的作用[3]。此外,二甲双胍作为2型糖尿病的一线用药[11],单独应用往往不能有效控制血糖水平,且易出现胃肠道不良反应及高乳酸血症等[12]。在本研究发现,降糖增效方能够改善ZDF大鼠FBG、FIns、HOMA-IR,发挥降糖、改善IR的作用,与二甲双胍联合应用降糖效果更佳。
胰岛素受体底物1(insulin receptor substance 1,IRS1)是胰岛素信号通路连接细胞内外的信号蛋白,其活化水平影响胰岛素生理效应的产生[13]。研究发现,IRS1不同位点的磷酸化受蛋白激酶影响从而正性或负性调控胰岛素信号传导[14],如丝氨酸位点 Ser 307、Ser 612、Ser 1101活化抑制信号传导,酪氨酸位点Tyr 989活化促进信号传导。正常情况下胰岛素与受体结合前,IRS1以丝氨酸磷酸化为主,关闭向下游传导信号通路;当胰岛素结合细胞表面受体后,IRS1大多数酪氨酸位点磷酸化,竞争性抑制丝氨酸位点磷酸化发生,同时启动下游信号通路发挥生理效应[15];IR发生的时候,由于长期高胰岛素血症、炎症、氧化、高糖等状态存在,导致胰岛素与受体结合后,IRS1酪氨酸位点磷酸化减弱,丝氨酸磷酸化作用增强,抑制了胰岛素信号传导进一步加重IR、高糖状态[16-17]。本研究结果发现,降糖增效方能够显著降低大鼠肝脏IRS1 Ser 307、Ser 612、Ser 1101位点的磷酸化,其与二甲双胍联合应用效果显著优于单独药物治疗组。
综上所述,降糖增效方能够降糖、改善IR,其联合二甲双胍效果更优,二者联合应用增加降糖疗效,优于两药单独应用;联合用药能够更显著抑制IRS1丝氨酸磷酸化,因此,可以推断出联合用药发挥降糖增效作用的原因可能是抑制IRS1丝氨酸磷酸化,从而加快胰岛素信号传导实现的。但中西药联合应用改善IR的相关报道较少,仍需进一步探讨降糖增效方及中西药联合应用的作用机制。
参考文献
[1] CHO N H, SHAW J E, KARURANGA S, et al. IDF Diabetes Atlas: Global estimates of diabetes prevalence for 2017 and projections for 2045[J]. Diabetes Research and Clinical Practice, 2018,138(2):271-281.
[2] OGURTSOVA K, DA ROCHA FEMANDES J D, HUANG Y, et al. IDF Diabetes Atlas: Global estimates for the prevalence of diabetes for 2015 and 2040[J]. Diabetes Research and Clinical Practice, 2017,128(1):40-50.
[3] 許光远,孙 文,宋紫临,等.和于泰辅助降糖片联合二甲双胍对糖尿病大鼠骨骼肌胰岛素抵抗的影响[J].中国中医药信息杂志,2017,24(11):39-43.
[4] 张立雯,季 涛,宿树兰,等.桑叶黄酮类和生物碱类成分在正常和糖尿病大鼠体内的药代动力学研究[J].中国中药杂志,2017,42(21):4218-4225.
[5] 黄链莎,刘铜华,孙 文,等.桂皮醛对糖尿病小鼠血糖水平的影响及机制[J].中国实验方剂学杂志,2018,24(10):95-100.
[6] 吴莉娟,孙 文,吴丽丽,等.积雪草醇提物对2型糖尿病ZDF大鼠肝脏胰岛素抵抗的影响[J].中国实验方剂学杂志,2017,23(10):104-110.
[7] 吴莉娟,孙 文,吴丽丽,等.糖耐康对T2DM大鼠ZDF肠道菌群结构的影响[J].中国实验方剂学杂志,2017,23(8):98-104.
[8] 许光远,孙 文,郭 璇,等.青钱柳多糖对H4IIE肝细胞胰岛素信号传递的影响[J].世界科学技术-中医药现代化,2016,18(7):1144-1148.
[9] 张红岩,刘赞朝,何素彦.2型糖尿病肥胖患者血清C反应蛋白、白细胞介素-6与胰岛素抵抗关系研究[J].现代中西医结合杂志,2018,27(4):427-429.
[10] 李 洵,王东生,姚 叶.葛根交泰丸对2型糖尿病大鼠血清炎症因子的影响[J].湖南中医药大学学报,2018,38(6):624-628.
[11] 母义明,纪立农,宁 光,等.二甲双胍临床应用专家共识(2016年版)[J].中国糖尿病杂志,2016,24(10):871-884.
[12] 梁玉清,韩 莉,梁紫恩,等.健脾化痰类中药联合降糖西药治疗超重/肥胖2型糖尿病的Meta分析[J].湖南中医药大学学报,2018,38(9):1043-1048.
[13] PENG J, HE L. IRS posttranslational modifications in regulating insulin signaling[J]. Journal of Molecular Endocrinology, 2018,60(1):R1-R8.
[14] ECKSTEIN S S, WEIGERT C, LEHMANN R. Divergent roles of IRS (insulin receptor substrate) 1 and 2 in liver and skeletal muscle[J]. Current Medicinal Chemistry, 2017,24(17):1827-1852.
[15] KUBOTA T, KUBOTA N, KADOWAKI T. Imbalanced insulin actions in obesity and type 2 diabetes: key mouse models of insulin signaling pathway[J]. Cell Metabolism, 2017,25(4):797-810.
[16] XIAOHAN S, XIAOCHUAN X, YINGXIAN J, et al. Associations of insulin receptor and insulin receptor substrates genetic polymorphisms with polycystic ovary syndrome: A systematic review and meta-analysis[J]. Journal of Obstetrics and Gynaecology Research, 2016,42(7):844-54.
[17] PAGE M M, SCHUSTER E F, MUDALIAR M, et al. Common and unique transcriptional responses to dietary restriction and loss of insulin receptor substrate 1 (IRS1) in mice[J]. Aging, 2018,10(5):1027-1052.
