免疫检查点阻断剂治疗血液肿瘤的研究进展
2020-06-10马蓉艳李莉娟刘敏杰李婷张连生
马蓉艳,李莉娟,刘敏杰,李婷,张连生
(兰州大学第二医院血液科,兰州 730030)
免疫检查点是免疫细胞上的抑制性受体,主要包括程序性细胞死亡受体1(programmed cell death receptor 1,PD-1)及其配体1(programmed cell death-ligand 1,PD-L1)和细胞毒性T淋巴细胞相关抗原-4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4),其在正常免疫微环境中作为免疫细胞过度活化的“刹车”防止自身组织损害;而在肿瘤微环境中表达明显上调,与其配体结合介导免疫抑制通路异常活化,阻止有效抗肿瘤免疫效应,促使肿瘤细胞增殖和疾病进展。阻断该通路的免疫检查点阻断剂(immune checkpoint blockade,ICB)已为众多肿瘤患者带来希望,并与嵌合抗原受体T细胞(chimeric antigen receptor-T cell,CAR-T细胞)、双特异性抗体和疫苗并列成为当前肿瘤治疗的四大新兴方式。近年来,已被食品药品管理局(Food and Drug Administration,FDA)先后批准用于黑色素瘤、非鳞状肺癌、肾癌等实体肿瘤的治疗[1-3]。2018年James和Honjo分别因CTLA-4和PD-1获得诺贝尔生理学/医学奖[4]。但相关研究在血液肿瘤中较滞后,首例报道是在2015年,PD-1抑制剂Nivolumab治疗复发/难治经典型霍奇金淋巴瘤(relapse/refractory classical Hodgkin′s lymphoma,R/RcHL),使总反应率高达87%[5]。事实上,目前绝大多数血液肿瘤仍无法治愈,经一线化疗或移植后复发/难治患者治疗选择受限,许多PD-1/PD-L1、CTLA-4阻断剂被研发,以单药或联合治疗方式投入临床使用,初步结果良好,成为血液肿瘤患者的新选择。现就PD-1/PD-L1和CTLA-4阻断剂治疗血液肿瘤的研究进展进行综述。
1 ICB
PD-1和CTLA-4为免疫抑制性受体,主要表达于活化T细胞上。PD-1的配体主要包括PD-L1和PD-L2,CTLA-4与共刺激分子CD28有高度的同源性,两者竞争结合共有配体CD80和CD86,它们表达在抗原呈递细胞和多种肿瘤细胞上。血液肿瘤发生发展常伴检查点表达失调,与配体结合后,抑制T细胞增殖活化,导致T细胞功能抑制、免疫耗竭及凋亡,是造成大多数肿瘤免疫逃逸的重要原因[6],使用ICB阻断检查点受体与配体的结合,从而将T细胞从“耗竭”状态逆转为“活化”状态以杀死肿瘤细胞[7]。PD-L1的表达较PD-L2更为普遍,故目前主要针对PD-L1研究。目前,已用于血液肿瘤临床研究的PD-1阻断剂主要包括Nivolumab、Pembrolizumab和Pidilizumab,PD-L1阻断剂主要包括Atezolizumab、Durvalumab和Avelumab。CTLA-4阻断剂的应用研究尚不及PD-1阻断剂广泛,主要包括Ipilimumab和Tremelimumab。
2 ICB治疗淋巴瘤
2.1单药ICB治疗淋巴瘤
2.1.1霍奇金淋巴瘤 迄今,ICB治疗血液肿瘤取得的最重要成就为PD-1阻断剂治疗R/RcHL,其临床疗效显著且不良反应少[4,8-9]。尤其在本妥昔单抗(一种抗CD30抗体药物偶联物)或自体干细胞移植后复发患者中疗效较为显著,总反应率为65%~87%,因此Nivolumab和Pembrolizumab于2016和2017年先后被FDA批准用于自体干细胞移植和本妥昔单抗治疗后复发或进展为经典型霍奇金淋巴瘤(classical Hodgkin′s lymphoma,cHL)的治疗,有望达到治愈疾病的目的[10]。近年来,一种新型PD-1阻断剂Sintilimab在cHL中也显示出其高效性。这项Ⅱ期临床研究共纳入92例R/RcHL患者,治疗结束后,总反应率为80.4%,其中完全缓解(complete response,CR)率为34%,6个月无进展生存(progression free survival,PFS)率为77.6%[11]。目前,ICB在cHL中疗效显著的原因并未完全阐明,可能与R-S细胞中染色体9p24.1的扩增[12]和常伴EB病毒感染使肿瘤细胞过表达PD-L1和PD-L2[13]有关。
2.1.2非霍奇金淋巴瘤(non-Hodgkin′s lymphomas,NHL)
2.1.2.1B细胞NHL PD-1阻断剂在复发/难治NHL中的疗效存在较大差异,在弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)和滤泡淋巴瘤(follicular lymphoma,FL)中的疗效欠理想,仅使一小部分患者反应,且反应持续时间短;而在原发纵隔大B细胞淋巴瘤(primary mediastinal large B-cell lymphoma,PMBCL)、原发中枢神经系统淋巴瘤、原发睾丸淋巴瘤中疗效良好,可能与染色体异常有关,后者有较高比例9p24.1扩增,增强了ICB治疗的敏感性[14]。研究显示,单药Pembrolizumab治疗FL,18例患者仅有2例反应;与此相似,Nivolumab单药治疗自体干细胞移植失败DLBCL,反应率仅为10%;在不适合移植的DLBCL中,反应率仅为3%,且检测出9p24.1扩增仅在3%的患者中出现[15]。在慢性淋巴细胞白血病/小淋巴细胞淋巴瘤中,16例患者无一例反应,然而在发生Richter转化慢性淋巴细胞白血病患者中,近40%的患者从中获益[16]。在相对少见的NHL中,如复发/难治PMBCL,既往基于蒽环类的化疗总反应率为0~25%,Zinzani等[17]开展的一项纳入18例患者Ⅰb期的临床研究显示,经Pembrolizumab治疗后,总反应率为41%,35%的患者达疾病稳定,虽然61%的患者发生药物相关不良事件,但大多为1~2级。基于其良好的临床疗效和安全性,2018年Pembrolizumab也被FDA批准用于难治PMBCL的治疗。在Nivolumab治疗原发中枢神经系统淋巴瘤和原发睾丸淋巴瘤的 Ⅰ 期研究中,Nivolumab展现出良好活性,纳入的5例患者均有临床和影像学反应,3例患者PFS期至少为13个月[18],值得进一步大样本临床试验进行探索。
2.1.2.2T细胞NHL 在T细胞NHL中,自然杀伤(natural killer,NK)/T细胞淋巴瘤的发生与EB病毒感染密切相关。与cHL相同,在EB病毒阳性的NK/T细胞淋巴瘤中,PD-L1水平明显升高,且肿瘤细胞和血清可溶性PD-L1的高表达是Ⅰ~Ⅱ期NK/T细胞淋巴瘤患者的独立不良预后指标[19]。靶向阻断PD-1/PD-L1通路的PD-1阻断剂治疗复发/难治NK/T细胞淋巴瘤展现出良好的治疗前景。Kwong等[20]报道,Pembrolizumab在7例先前经门冬酰胺酶治疗失败的患者中,经过7个周期的治疗,总反应率为100%,5例CR,2例部分缓解,表明PD-1阻断剂治疗的高度敏感性。而另外一项涉及7例复发/难治NK细胞淋巴瘤患者的临床试验显示,经Pembrolizumab治疗后,仅4例患者反应,2例CR,1例部分缓解[21]。小剂量Nivolumab的治疗也展现出良好的治疗结局[22]。
有数据表明,PD-1、PD-L1/PD-L2通路在防止免疫介导的皮肤T细胞淋巴瘤肿瘤清除中起重要作用[23]。在Checkmate-039研究中,共包括81例复发/难治血液肿瘤患者,其中23例T系NHL(13例蕈样肉芽肿,5例外周T细胞淋巴瘤,5例其他T细胞NHL)。经Nivolumab治疗后22例患者发生了3/4级不良事件,最常见的为肺炎。在蕈样肉芽肿患者中,客观反应率为15%,中位PFS期为10周;而外周T细胞淋巴瘤中,客观反应率为40%,中位PFS期为14周;其他T细胞NHL无一例反应[24]。目前,ICB能否成为治疗皮肤T细胞淋巴瘤的新策略尚无定论,需等待一些正在进行中的临床试验结果,如Pembrolizumab联合γ干扰素,Pembrolizumab与Romidepsin,Pembrolizumab与地西他滨和Pralatrexate,Nivolumab与Brentuximab Vedotin及Nivolumab与Ipilimumab等[25]。
2.2ICB与放疗联合治疗淋巴瘤 虽然PD-1阻断剂治疗R/RcHL疗效显著,但CR率大多不足20%,中位PFS期短,放疗作为淋巴瘤重要治疗方式之一,直接杀死恶性淋巴瘤细胞,释放免疫激活趋化因子和细胞因子,激活树突状细胞进行抗原呈递,并诱导效应细胞(如细胞毒性T淋巴细胞和NK细胞)激活和增殖。ICB可进一步提高这些效应细胞的功效,从而优化局部抗淋巴瘤的效力。两种治疗方式的组合可以高度协同,且可使用比当前放疗方案中更低照射剂量,可能改变低CR率现状[26-27]。Qin等[28]对3例R/RcHL患者进行Nivolumab联合局部放疗(30 Gy),结果显示3例患者均获得CR且PFS期明显延长。但此研究病例数较少,其结果尚需更多大样本研究加以证实。目前,德国霍奇金研究组的一项包括100例cHL患者的Ⅱ期临床试验正在计划开展中,期待有好的治疗结局[29]。
2.3ICB与其他治疗方式联合治疗淋巴瘤 在淋巴瘤中,为实现更有效的ICB治疗,常采用多种方法联合治疗,主要包括PD-1阻断剂与CTLA-4阻断剂的联合、PD-1阻断剂与分子靶向抗体联合。在早期的临床实践中,Nivolumab联合Ipilimumab治疗复发/难治霍奇金淋巴瘤、B细胞淋巴瘤、T细胞淋巴瘤及多发性骨髓瘤(multiple myeloma,MM)表现为耐受良好,但相较单药Nivolumab,反应率并未改善[30]。PD-1阻断剂与其他免疫药物,如利妥昔单抗(抗CD20单抗)联用时,疗效也并未明显增加[31]。在与小分子抑制剂联合方面,Nivolumab联合依鲁替尼已在各种淋巴瘤亚型中进行试验,但两者的联合几乎没有增加疗效,除了在Richter转化慢性淋巴细胞白血病/小淋巴细胞淋巴瘤外,其反应率在大多数淋巴瘤中与单药依鲁替尼或Nivolumab治疗相似[16]。
此外,有研究者将PD-1阻断剂与淋巴瘤一线化疗方案联合,如与多柔比星、长春碱、达卡巴嗪组成的方案联合治疗初治晚期cHL[32],初步结果显示反应率高,但这种联合方式尚在临床初期阶段,是否真正优于标准一线化疗尚需后期试验进一步证实。
3 ICB治疗急性髓系白血病
近几年,已有许多ICB治疗急性髓系白血病(acute myeloid leukemia,AML)和骨髓增生异常综合征(myelodysplastic syndrome,MDS)的临床试验得到开展,部分试验结果尚未公布(表1)。但已有数据表明,单药PD-1/PD-L1和CTLA-4阻断剂临床疗效有限,特别是肿瘤负荷过重时,单药治疗可能不足以达到有效的治疗效果[33]。故多采用联合治疗,主要包括与去甲基化药物(hypomethylating agents,HMAs)、标准的一线细胞毒性化疗及分子靶向双抗联合。
3.1PD-1阻断剂与HAMs联合治疗AML 阿扎胞苷、地西他滨作为HAMs的代表药物,已投入AML和MDS的临床治疗。它们与ICB联合治疗的基础为PD-1的表达与其启动子CpG位点DNA的甲基化状态呈负相关,HAMs使启动子低甲基化,从而上调活化T细胞上的PD-1、PD-L1和较小程度的CTLA-4的表达,抑制免疫应答[34],这可能是一部分患者对阿扎胞苷耐受的缘由[33]。阻断PD-1/PD-L1通路可能预防或克服耐药,提高HMAs临床治疗效果。Daver等[35]开展的一项Ⅱ期研究中,共纳入70例复发/难治AML患者(中位年龄72岁),经阿扎胞苷75 mg/m2第1~7天,Nivolumab 3 mg/kg第1~14天治疗,总反应率为33%,包括CR/不全血细胞恢复的CR 15例(22%),部分缓解1例,血液学改善7例。虽然有16例(23%)患者发生2~4级免疫相关不良事件,但88%的患者经糖皮质激素处理后不良反应得到控制。研究发现,与HAMs单药治疗复发/难治AML相比,Nivolumab联合HMAs治疗具有更高的总反应率和更长的总生存期及PFS期[35],这无疑是AML治疗史上的一个重大突破。
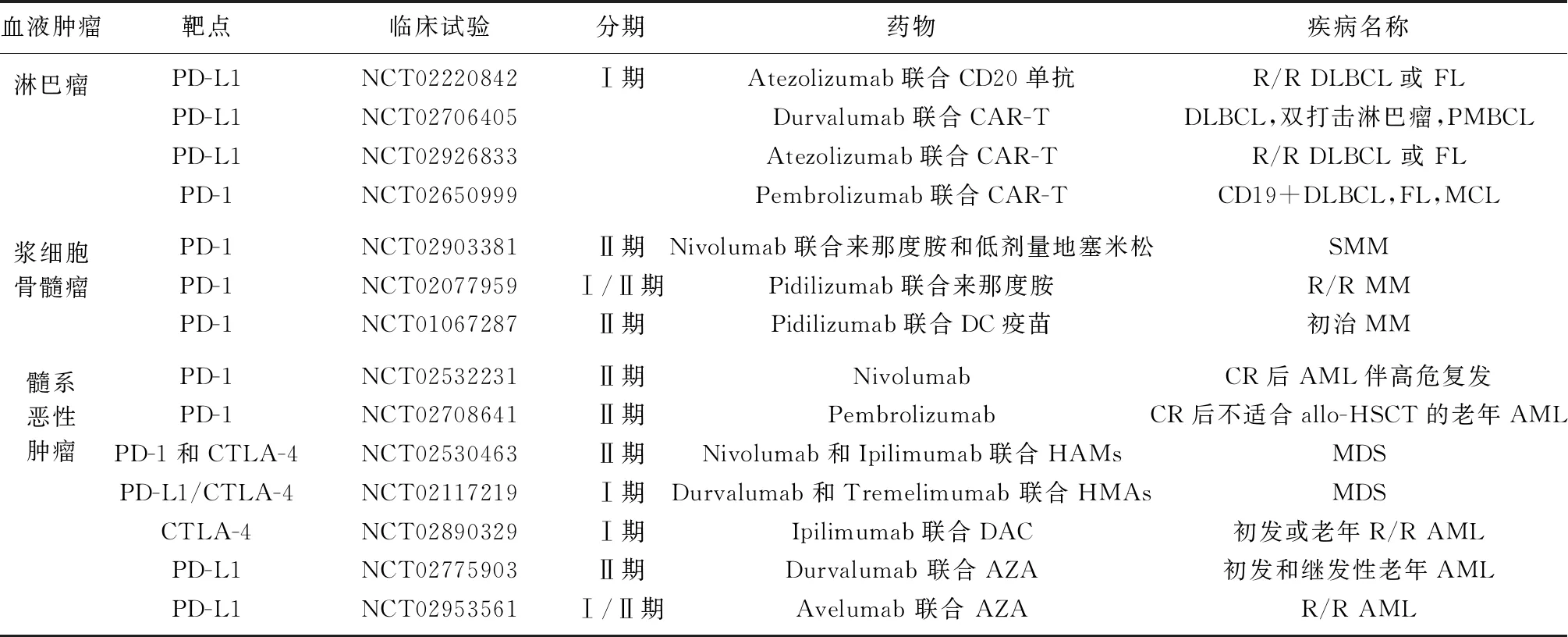
表1 ICB治疗血液肿瘤的临床试验
PD-1:程序性细胞死亡受体1;PD-L1:程序性细胞死亡配体1;CTLA-4:细胞毒性T淋巴细胞相关抗原-4;CAR-T:嵌合抗原受体T细胞;DC:树突状细胞;HAMs:去甲基化药物;DAC:地西他滨;AZA:阿扎胞苷;R/R DLBCL:复发/难治弥漫大B细胞淋巴瘤;FL:滤泡淋巴瘤;PMBCL:原发纵隔大B细胞淋巴瘤;MCL:套细胞淋巴瘤;SMM:冒烟型多发性骨髓瘤;R/R MM:复发/难治多发性骨髓瘤;MM:多发性骨髓瘤;CR:完全缓解;AML:急性髓系白血病;allo-HSCT:异基因造血干细胞移植;MDS:骨髓增生异常综合征;R/R AML:复发/难治急性髓系白血病
3.2ICB与细胞毒性化疗药物联合治疗AML 小鼠模型中,注射阿糖胞苷可诱导CD80和CD86的表达,并减少白血病细胞PD-L1的表达,从而使肿瘤细胞更易受细胞毒性T淋巴细胞介导的杀伤[36]。经细胞毒性药物化疗后,伴随细胞新生抗原(包括潜在的新抗原)的释放可能增强细胞毒性T淋巴细胞抗肿瘤功效,阻断抑制性抗原的ICB联合阿糖胞苷可能提高抗肿瘤效能。一项Nivolumab联合IA方案(伊达比星联合阿糖胞苷)治疗AML的Ⅱ期临床试验,共纳入42例AML和2例高危MDS患者,中位年龄54岁,初治患者占73%,治疗相关AML占7%,19例高危患者[37]。经联合治疗后,对44例患者进行评估,总反应率为77%,CR率为63%和不全血细胞恢复的CR率为14%,中位无复发生存期18.5个月,总生存期为18.54个月,相较单一IA方案(13.4个月)延长,6例患者发生药物相关不良事件,但大多数可逆转,表明ICB与细胞毒性化疗药物联合抗肿瘤具有巨大潜力[36]。
3.3ICB与特异性双抗联合治疗AML 无论是CD33/CD3(AMG-330)双抗还是CD123/CD3双抗在AML的治疗中均仅使一小部分患者获益,这与AML细胞上PD-L1的表达密切相关,Krupka等[38]研究发现,向体外培养物中添加AMG-330时,原代AML细胞上PD-L1有效上调,驱动了T细胞无能和耗竭,将抗PD-L1/PD-1单抗与CD33/CD3 双抗联合时,表现为T细胞增殖活化和γ干扰素产生,表明ICB联合双抗的治疗策略可能潜在地克服对任一单药耐药,从而优化免疫介导的肿瘤杀伤。期待相关的临床试验早日得到开展,取得良好结果。
4 ICB治疗MM
ICB中CTLA-4阻断剂治疗MM的临床试验尚缺乏,PD-1阻断剂单药治疗MM的效果并不突出[24],故联合治疗成为研究趋势。免疫调节剂是治疗MM的基石,研究发现,第二代免疫调节剂来那度胺可下调MM浆细胞上PD-L1和T细胞上PD-1的表达水平,还可增强ICB诱导抗骨髓瘤的毒性效应[39],故MM中免疫调节剂成为与ICB联合治疗的首选。早期Nivolumab和Pembrolizumab联合来那度胺治疗MM展现出一定的抗肿瘤疗效,但随着研究的深入,高病死率及严重不良事件发生的现象逐渐显现。2017年,FDA对将近30项Pembrolizumab联合来那度胺或泊马度胺临床试验进行调研,发现这种联合治疗明显增加了患者病死率,对患者的伤害远大于益处[40],随后一些相关的Ⅲ期临床试验(KEYNOTE-023、KEYNOTE-183、KEYNOTE-185)被停止。ICB在MM中疗效欠佳的原因可能为:①MM本身抑制性免疫微环境;②MM中免疫沉默而不是免疫耗竭使T细胞功能受损;③发挥抗MM的克隆性T细胞低水平表达PD-1[41-42]。但病死率的增加和不良事件的发生是否与PD-1阻断剂相关目前并未达成共识。因此,PD-1阻断剂治疗MM仍具可行性,合适的联合治疗方案选择可能逆转这种不良结局。
与分子靶向药物联合时,PD-1阻断剂治疗MM效果提高。首先,在MM小鼠模型中,Bezman等[43]证实了抗CD2 亚基 1(也称SLAMF7 蛋白)单抗Elotuzumab联合抗PD-1单抗促进了肿瘤浸润NK细胞和CD8+T细胞的活性,增加了肿瘤微环境中细胞因子和趋化因子释放,提高了骨髓瘤小鼠的抗肿瘤效力。随后有研究者证实相较单药治疗MM,PD-1阻断剂联合抗CD38单抗疗效更显著[44]。
在与放疗联合方面,由于放疗直接杀伤肿瘤细胞的特性,机体通过反应性进行免疫重建,阻断PD-1/PD-L1等免疫抑制途径,实现更优的免疫重建及杀伤,从而进一步提高抗肿瘤疗效,这种潜在的协同作用,使放疗成为与ICB联合治疗较优的备选方案。MM小鼠模型中,放疗后联用PD-L1抑制剂可使近66%的小鼠存活,而对照组(仅放疗)无一例存活[45]。在有关Nivolumab单药治疗复发难治血液肿瘤Ⅰb期的临床研究中,包括27例MM患者,最终有63%疾病稳定,持续的中位时间为11.4周,其中1例患者由于MM肋骨损害在接受Nivolumab以前进行局部放疗,后达CR,持续近14个月[24]。
5 异基因造血干细胞移植前后ICB治疗血液肿瘤
5.1ICB作为异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,allo-HSCT)后挽救治疗血液肿瘤 有研究表明,ICB可能重新激活allo-HSCT后复发患者耗竭供者T细胞抗肿瘤效能[46],从而增强移植物抗肿瘤效应,然而也可能介导移植物抗宿主病(graft-versus-host disease,GVHD)的发生。两项多中心研究表明,经allo-HSCT后复发的cHL患者,使用Nivolumab后,总反应率达77%~95%,但GVHD发生率为30%~55%,其中因GVHD死亡者高达8例(26%)[47-48]。这种治疗方式的高效性和高毒性值得进一步探索,尤其是对哪些人群可能从中真正获益,可能与移植后ICB给药时机、给药剂量及疾病类型相关。在一项Ⅰ/Ⅰb期的临床研究中,28例allo-HSCT后复发血液肿瘤患者(包括12例AML,7例HL,4例NHL,2例MDS,1例MM,1例骨髓增殖性肿瘤,1例ALL)使用Ipilimumab,从移植到给Ipilimumab的中位时间为675 d,以3 mg/kg单次静脉输注,结果并未观察到明显的不良反应和严重的GVHD,但无一例反应;在后续的试验中加用Ipilimumab为10 mg/kg,共22例患者,7例反应,5例 CR(包括4例髓外复发AML和1例MDS转化的AML),2例部分缓解(1例HL,1例MM)[46]。然而,在该剂量下观察到明显药物毒性,包括6例严重的免疫相关不良事件,其中1例死亡,4例因严重GVHD考虑退出试验。虽然低剂量Ipilimumab安全性较高,但并未使患者获得临床反应,增加剂量后使髓外复发AML患者特别获益[46]。相对而言,PD-1阻断剂在allo-HSCT后复发AML中疗效有限,不论用药剂量和时机均表现为更早发生的GVHD和严重的免疫相关不良事件[7]。这表明临床能否获益还与ICB的类型相关。
5.2ICB作为allo-HSCT前诱导或桥接治疗血液肿瘤 在PD-1阻断剂作为allo-SCT 前的诱导或桥接治疗方面,一项国际回顾性研究结果显示,39例患者(HL 31例,NHL 8例)在allo-HSCT之前进行PD-1阻断剂治疗(中位间隔时间62 d),1年的总生存率和PFS率为89%和76%,并观察到PD-1+T细胞数量减少,复发率较预期低[49]。虽然总GVHD发生率与不联用PD-1阻断剂相似,但严重GVHD的发生率更高,其中3例是致死性的。另外一项较小研究报道将Nivolumab作为alloSCT前桥接治疗(中位间隔时间44 d) 9例HL患者,结果显示最终8例存活,7例达CR,1例疾病稳定,但所有患者均发生GVHD[50]。
上述研究表明,ICB在allo-HSCT前后具有高效性,虽然重新激活的同种异体反应性T细胞导致GVHD发生风险增大,但在HL中allo-HSCT前后使用Nivolumab是可行的。目前缺乏前瞻性研究数据,在 allo-HSCT前或后ICB使用时机问题尚未解决,且进一步的研究识别allo-HSCT移植前后ICB使用的最佳剂量和哪些患病群体可能从中受益十分必要。
6 ICB与CAR-T细胞联合治疗血液肿瘤
CAR-T细胞是目前肿瘤治疗领域的研究热点之一,CD19特异性CAR-T细胞(CAR-T 19细胞)更是被FDA批准用于治疗B细胞血液肿瘤,研究发现,输注CAR-T 19细胞后的患者,CD4+/CD8+CAR-T细胞上PD-1的表达增加,可能诱使CAR-T细胞功能降低或耗竭,而降低了CAR-T细胞治疗效果[51]。另一方面,CAR-T细胞受肿瘤抑制性免疫微环境影响,而ICB恰好靶向机体的免疫系统,小鼠模型中,PD-1阻断剂联合CAR-T细胞治疗在改善免疫抑制微环境的同时,还可逆转PD-1介导的CAR-T细胞耗竭,促进CAR-T细胞的存活、加速PD-L1+肿瘤细胞的凋亡[52]。Rafiq等[53]设计了一种可以分泌抗PD-1单抗scFv的CAR-T细胞,在小鼠模型中展现出较CAR-T细胞联合PD-1阻断剂治疗时更好的效果,表明PD-1阻断剂具有有效提高CAR-T细胞抗肿瘤效能的潜力。临床试验中,一项前瞻性研究显示,11例 DLBCL和1例FL经CAR-T 19细胞治疗后复发或进展患者,经Pembrolizumab 200 mg每3周给药一次,直至疾病进展或治疗受限药物毒性的发生,最终有27%的反应率,安全性较好,且进一步证实CAR-T细胞在PD-1阻断后扩增[54]。CAR-T细胞联合ICB极有可能造成T细胞过度增殖活化,而引发强大的细胞因子释放风暴及神经毒性反应,临床需密切关注和评估,及时予以相应处理。此外,有关CD19特异性CAR-T细胞联合PD-1/PD-L1阻断剂治疗复发/难治DLBCL、FL、PMBCL等恶性淋巴瘤的临床试验正在开展,期待取得良好的治疗效果。
7 小 结
免疫活化过程中免疫检查点“刹车”“过刹”致免疫活性过度受抑,一方面参与了绝大多数血液肿瘤发生与进展,另一方面使肿瘤常规治疗疗效降低、耐药,ICB“松开”免疫系统的“刹车”,恢复机体杀伤肿瘤的免疫效能。临床研究中,ICB主要治疗复发/难治血液肿瘤,单药治疗cHL和一些NHL疗效突出,与遗传学异常和EB病毒感染相关;联合治疗方面,与HMAs、放疗和一些分子靶向药物联合时疗效较优,与肿瘤一线治疗联合的初步研究也表明可提高疗效,充分说明ICB在临床应用上的巨大潜力。但这些研究大多尚在临床初期阶段,有些试验例数少,并不能确定患者是否真正获益,此外,在allo-HSCT前后使用ICB尽管高效但不良反应发生率高,但对于其机制应进行深入探讨,以便在不同的血液肿瘤中识别出最优治疗选择。
