安徽地区猪繁殖与呼吸综合征病毒临床感染与流行毒株的监测与分析
2020-06-08祝闰琦崔雪娇何长生魏建忠孙裴李郁
祝闰琦,崔雪娇,何长生,魏建忠,孙裴,李郁*
(1. 安徽农业大学动物科技学院,安徽 合肥 230036;2. 安徽省动物疫病预防与控制中心,安徽 合肥 230091)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS),是由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)引起的以成年猪繁殖障碍、早产、流产、死产和产木乃伊胎,仔猪发生呼吸系统疾病和大量死亡为特征的一种急性、高度传染性疾病。自1987年以来至今,除瑞士、芬兰及澳大利亚等少数地区未见报道外,PRRS已在世界范围内广泛流行,成为严重危害全球养猪业的重要疫病之一。
中国哈兽研郭宝清于1996年从流产猪的胎儿中分离到PRRSV,首次证实了PRRS在中国的存在。2006年初夏,我国出现和流行高致病性PRRSV (highly pathogenic PRRSV, HP-PRRSV),发病猪以高热、高发病率和高死亡率以及妊娠母猪严重的繁殖障碍为特征,此次疫情给养猪业造成了巨大经济损失。2012年报道的GM2和QYYZ是弱毒疫苗株与野毒株重组的新型毒株[1]。2014年,国内多个实验室相继报道了一类与美国NADC30毒株高度同源的毒株,该类毒株在Nsp2基因存在131个氨基酸的不连续缺失,并且极易与国内流行的其他亚群毒株发生重组,统称为PRRSV NADC30-like[2-3]。2016年,1-7-4分支PRRSV在美国首次报道,近年已开始在我国流行。2017年,在辽宁省检测出2株1-7-4分支PRRSV,在我国PRRSV基因分群中属于1个新亚群,该类毒株致病性差异较大,引起的临床症状也不尽相同[4]。
本研究旨在了解和掌握安徽地区猪群中PRRSV的感染现状,以及临床感染的流行毒株,从而为安徽地区PRRS的流行病学研究积累有效材料,为安徽地区PRRS的有效防控提供科学依据。
1 材料与方法
1.1 样品来源
共收集样品416例,均来自于2017年8月—2018年12月安徽地区16个地市的养猪场(户)。其中病(死)猪组织混样299例、血清71例、精液29例、唾液17例。病(死)猪组织混样采集肺脏、肝脏、肾脏、脾脏、腹股沟淋巴结以及肠系膜淋巴结。
1.2 主要试剂及试剂盒
TIANScript M-MLV(200 U/μL)、TIANScriptTaqDNA聚合酶(5 mol/μL)、dNTP、5×First-Strand Buffer、DNA Marker-DL2000、2×TaqPCR Master Mix均购自于天根生物有限公司;PRRSV通用型实时荧光RT-PCR检测试剂盒、PRRSV(NADC30-like)实时荧光RT-PCR检测试剂盒、PRRSV美洲型经典株和高致病性变异株双重实时荧光RT-PCR检测试剂盒、PRRSV美洲株实时荧光RT-PCR检测试剂盒均购自于北京世纪元亨动物防疫技术有限公司;核酸提取试剂盒购自于天隆科技有限公司。
1.3 引物设计与合成
根据GenBank中登录的基因序列(登录号:EF635006),利用软件Primer 6.0设计PRRSV ORF5基因和Nsp2部分基因的特异性引物,见表1。引物均由南京金斯瑞生物科技有限公司合成。
表1 PRRSV ORF5基因和Nsp2部分基因扩增用引物
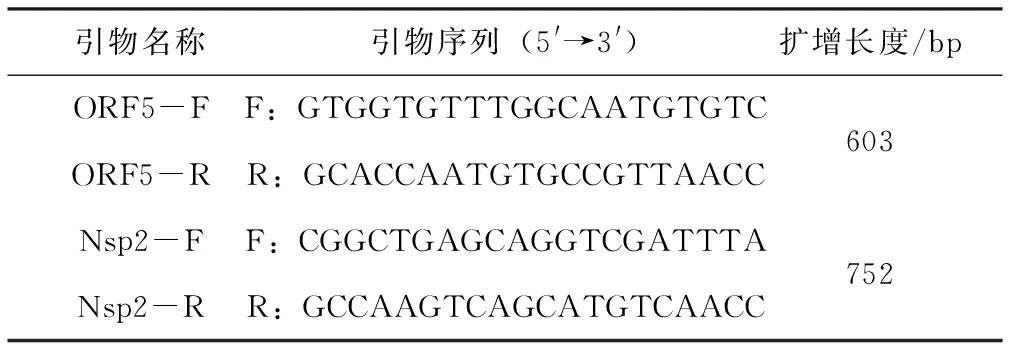
引物名称引物序列(5'→3')扩增长度/bpORF5-FF:GTGGTGTTTGGCAATGTGTC ORF5-RR:GCACCAATGTGCCGTTAACC 603Nsp2-FF:CGGCTGAGCAGGTCGATTTANsp2-RR:GCCAAGTCAGCATGTCAACC752
1.4 样品处理
病料组织样品:将无菌采集的各病料组织(肺脏、肝脏、肾脏、脾脏、淋巴结等)分别称取约1 g,剪碎混匀后取0.05 g于研磨管中,加入1 mL PBS放置研磨仪中研磨至匀浆,转入1.5 mL灭菌离心管中,8 000 r/min离心2 min,取上清液100 μL于新的1.5 mL灭菌离心管中。
全血样品:待血凝后将全血转入1.5 mL灭菌离心管中,8 000 r/min离心2 min,取血清100 μL于新的1.5 mL灭菌离心管中。
唾液、精液样品:将唾液、精液等充分混匀后,取100 μL于1.5 mL灭菌离心管中。
阳性对照样品:无菌采集PRRSV鉴定为阳性的各病料组织(肺脏、肝脏、肾脏、脾脏、淋巴结等),处理方法同1.2.1。
阴性对照样品:无菌采集PRRSV鉴定为阴性的各病料组织(肺脏、肝脏、肾脏、脾脏、淋巴结等),处理方法同1.2.1。
1.5 病毒RNA提取
按照天隆科技有限公司核酸提取试剂盒说明书进行。
1.6 PRRSV检测
按照PRRSV通用型实时荧光RT-PCR检测试剂盒说明书进行。
1.7 PRRSV毒株类型检测
按照PRRSV美洲型经典株和HP-PRRSV双重实时荧光RT-PCR检测试剂盒、PRRSV(NADC30-like)实时荧光RT-PCR检测试剂盒、PRRSV美洲型毒株实时荧光RT-PCR检测试剂盒说明书进行。
1.8 PRRSV测序鉴定
对未能通过试剂盒检测毒株类型的PRRSV阳性样品,采用RT-PCR对其ORF5基因和Nsp2部分基因进行序列扩增、测序、比对分析鉴定。
1.8.1 反转录合成cDNA
反转录体系:dNTP 3 μL、下游引物 1 μL、RNA模板 10 μL、MLV 1 μL、Stand Buffer 5 μL。反应条件:70 ℃水浴5 min,0 ℃冰水混合物中冰浴2 min,42 ℃水浴50 min。
1.8.2 聚合酶链式反应
1.8.2.1 PRRSV ORF5基因序列扩增
PCR反应体系:cDNA模板2 μL、2×TaqPCR Master Mix 12.5 μL、ddH2O 8.5 μL、上下游引物各1.0 μL。反应条件为:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸50 s,35个循环,72 ℃延伸10 min。PCR 扩增产物经1%琼脂糖凝胶电泳检测。
1.8.2.2 PRRSV Nsp2部分基因序列扩增
PCR反应体系:cDNA模板2 μL、2×TaqPCR Master Mix 12.5 μL、ddH2O 8.5 μL、上下游引物各1.0 μL。反应条件为:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸50 s,35个循环,72 ℃延伸10 min。PCR 扩增产物经1%琼脂糖凝胶电泳检测。
1.8.3 序列比对分析
将PCR产物送至安徽通用生物系统有限公司进行测序,所得的序列拼接结果与GenBank上的国内外PRRSV参考毒株进行序列比对及同源性分析,以鉴定毒株类型。
2 结果与分析
2.1 样品检测
2.1.1 同类型样品的检测
在416例被检样品中,检测出PRRSV的样品有223例,总阳性检出率为53.6%(223/416)。不同类型样品中PRRSV阳性检出率分别为病料组织混样56.8%(170/299)、血清43.7%(31/71)、精液41.3%(12/29)、唾液58.8%(10/17)。其中病料组织混样与唾液之间差异不明显,血清与精液之间差异不明显,病料组织、唾液与血清、精液之间差异均明显。病料组织和唾液更适合用于PRRSV的检测。
2.1.2 不同地区样品的检测
416例被检样品源自安徽阜阳、滁州、宿州、黄山、六安、亳州、合肥、淮南、安庆、芜湖、巢湖、池州、淮北、宿松、宣城、蚌埠等16个地市,PRRSV阳性检出率分别为77.0%(47/61)、72.2%(26/36)、66.7%(4/6)、58.3%(7/12)、56.1%(27/48)、52.4%(11/21)、50.9%(57/112)、50.0%(6/12)、47.1%(8/17)、38.5%(5/13)、37.5%(3/8)、33.3%(2/6)、33.3%(4/12)、33.3%(9/27)、30.0%(3/10)、26.7%(4/15)。表明安徽多个地区均存在PRRSV不同程度的感染。
2.1.3 不同季度样品的检测
PRRSV阳性检出率在第1季度(1—3月)为72.3%(60/83)、第2季度(4—6月)64.5%(60/93)、第3季度(7—9月)55.6%(45/81)、第4季度(10—12月)36.5%(56/159)。4个季度之间差异性不明显,未呈现流行的季节性。
2.1.4 不同阶段样品的检测
PRRSV阳性检出率在保育猪中为69.0%(164/238),育肥猪46.3%(19/41),死胎和弱仔29.2%(40/137)。3个阶段之间差异性均不明显,PRRSV可以感染各年龄段的猪。
2.1.5 不同临床症状样品的检测
源自繁殖障碍症状的样品PRRSV阳性检出率为29.2%(40/137),呼吸道症状的样品为65.6%(183/279)。两者之间差异明显。
2.2 PRRSV毒株类型检测
2.2.1 PRRSV毒株检测
在223例检测出PRRSV的样品中,美洲型经典毒株占比19.7%(44/223),HP-PRRSV占比44.8%(100/223),PRRSV NADC30-like 占比13.0%(29/223),美洲型毒株占比22.4%(50/223)。4种类型毒株之间差异明显,显示HP-PRRSV为优势流行毒株。ORF5基因、Nsp2部分基因扩增结果见图1、图2。
M. DNA Marker DL2000;1. PRRSV阳性对照;2. PRRSV阴性对照;4~8. 被检样品
图1 PRRSV ORF5基因PCR鉴定结果
2.2.2 不同类型样品PRRSV毒株类型检测
4种类型毒株阳性检出率在病料组织混样中分别为68.2%(30/44)、72.0%(72/100)、58.6%(17/29)、66.0%(33/50),血清样品分别为22.7%(10/44)、20.0%(20/100)、41.4%(12/29)、20.0%(10/50),精液样品分别为0、3.0%(3/100)、0、10.0%(5/50),唾液样品分别为9.0%(4/44)、5.0%(5/100)、0、4.0%(2/50)。不同样品中4种类型毒株之间的占比差异明显。
M. DNA Marker DL2000;1. PRRSV阳性对照;2. PRRSV阴性对照;3~4. 被检样品
图2 PRRSV Nsp2部分基因PCR鉴定结果
2.2.3 不同地区PRRSV毒株类型检测
安徽16个地市检测的PRRSV毒株类型不完全一致(表2),其中安庆、亳州、宿州、芜湖以美洲型经典毒株为主,淮南、合肥、滁州、淮北以HP-PRRSV为主,池州、蚌埠、宿松、阜阳以PRRSV NADC30-like为主,黄山、六安、巢湖、宣城以美洲型毒株为主。
表2 不同地区PRRSV毒株类型检测结果
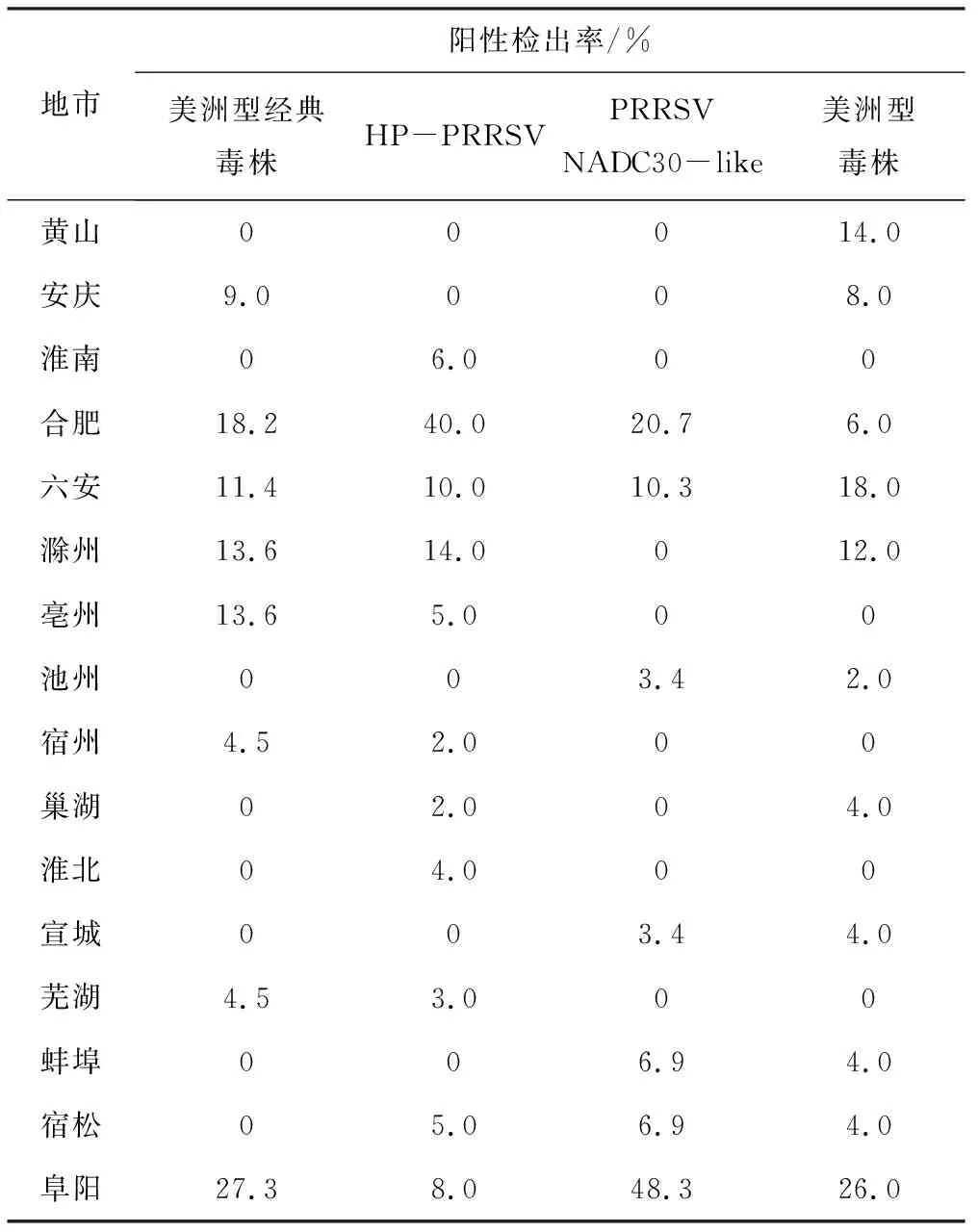
地市阳性检出率/%美洲型经典毒株HP-PRRSVPRRSVNADC30-like美洲型毒株黄山00014.0安庆9.0008.0淮南06.000合肥18.240.020.76.0六安11.410.010.318.0滁州13.614.0012.0亳州13.65.000池州003.42.0宿州4.52.000巢湖02.004.0淮北04.000宣城003.44.0芜湖4.53.000蚌埠006.94.0宿松05.06.94.0阜阳27.38.048.326.0
2.2.4 不同季度PRRSV毒株类型检测
4种类型毒株在不同季度的检出情况见表3,相互之间差异均不明显。
表3 不同季度PRRSV毒株类型检测结果
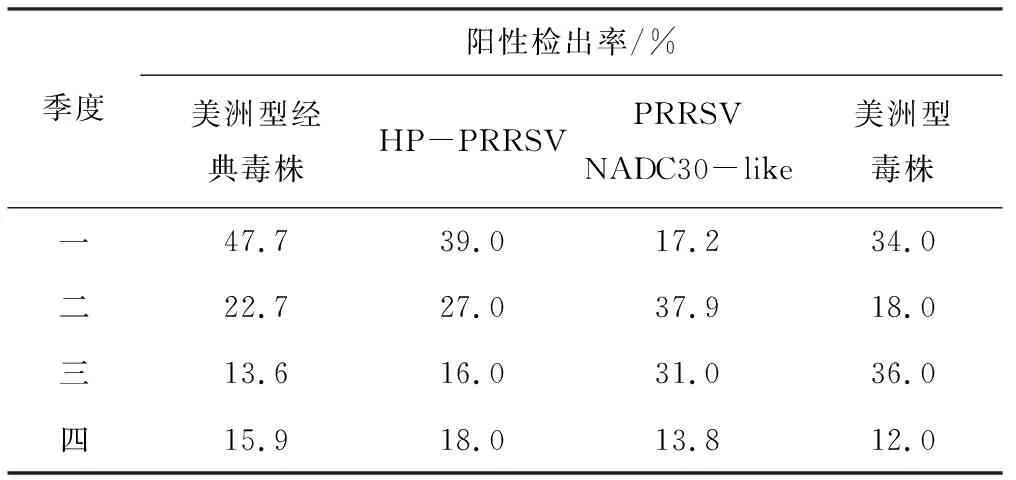
季度阳性检出率/%美洲型经典毒株HP-PRRSV PRRSVNADC30-like美洲型毒株一47.739.017.234.0二22.727.037.918.0三13.616.031.036.0四15.918.013.812.0
2.2.5 不同生长阶段PRRSV毒株类型检测
由表4可见,4种类型毒株阳性检出率在死胎和弱仔、保育猪和育肥猪(除HP-PRRSV和美洲型毒株)阶段相互之间差异均明显。死胎和弱仔及保育猪多见HP-PRRSV,育肥猪多见美洲型经典毒株。
表4 不同阶段PRRSV毒株类型检测结果
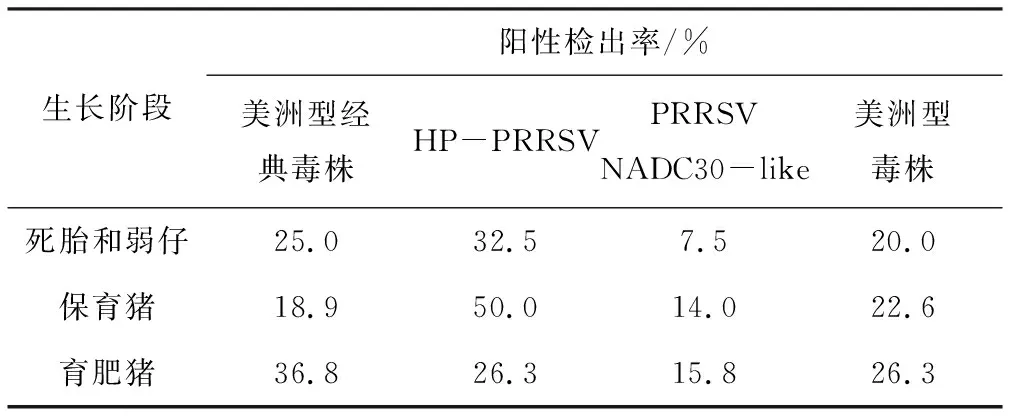
生长阶段阳性检出率/%美洲型经典毒株HP-PRRSV PRRSVNADC30-like美洲型毒株死胎和弱仔25.032.57.520.0保育猪18.950.014.022.6育肥猪36.826.315.826.3
2.2.6 不同临床症状PRRSV毒株类型检测
由表5可见,临诊为繁殖障碍性疾病的样品,4种毒株类型阳性检出率差异明显,以HP-PRRSV多见。临诊为呼吸系统疾病的样品,4种毒株类型阳性检出率差异性均不明显,多种类型毒株并存。
表5 不同临床症状PRRSV毒株类型检测结果

临床症状阳性检出率/%美洲型经典毒株HP-PRRSV PRRSVNADC30-like美洲型毒株繁殖障碍症状25.032.57.535.0呼吸道症状20.847.514.223.0
3 讨论
PRRS于1987年首先在美国发生,随后几年之内在北美洲和欧洲大陆均有该病发生的报道,现己蔓延至许多亚太地区及国家,目前PRRS已呈世界性分布。根据临床和血清学调查,PRRS在我国广泛存在,而且近年来流行呈上升态势。2008—2011年浙江猪群PRRSV阳性检出率为51.17%[5]。2013—2014年四川部分地区猪群PRRSV阳性检出率为50.7%[6]。2014—2015年河南猪群PRRSV阳性检出率为23.2%[7]。2014—2016年江西猪群PRRSV阳性检出率为52.7%[8]。2014—2016年天津猪群PRRSV阳性检出率为26.26%[9]。2016—2017年我国华北4省市PRRSV检测猪群的阳性率为44.3%[10]。本研究针对2017—2018年安徽临床样品PRRSV感染情况的调查,结果显示猪群中PRRSV阳性检出率为53.6%。不同省份或地区,PRRSV在猪群中的感染程度存在差异,在排除被检样品的数量、类型、来源等影响因素,可以看出安徽同浙江、四川、江西等地的情况相似,均处于PRRSV感染较严重的状态。安徽是养猪大省、全国10个生猪主产省之一,而且安徽处于我国的中部地区,从地理和养殖规模上来看,安徽的情况比较复杂,由于养殖量大以及生猪交易流动性大,因而会导致安徽猪群中PRRSV较高的阳性检出率。PRRSV在安徽流行广泛,不呈现区域性分布,也无季节性流行特点,各阶段的猪均可感染发病,呼吸道症状在临床表现上多见,病料组织和唾液更适合用于PRRSV的检测样品。因此,防控PRRS的最佳策略应是全方位、全面性、全时段的实践,包括从生物安全、疫苗免疫、继发感染控制、监测等措施。
本研究对临床被检样品中PRRSV毒株类型的检测结果显示:检出率最高的毒株为HP-PRRSV(44.8%),目前为安徽的优势流行毒株。2014—2015年河南猪群中HP-PRRSV阳性检出率为37.9%,PRRSV NADC30-like为50%[7]。2014—2016年天津猪群中HP-PRRSV阳性检出率为69.23%,美洲型经典毒株为4.81%,PRRSV NADC30-like为25.96%[9]。2014—2017年山东猪群中HP-PRRSV仍然普遍存在,PRRSV NADC30-like逐渐成为优势流行毒株[11]。2016—2017年我国华北4省市HP-PRRSV阳性检出率为47.1%,PRRSV NADC30-like为52.8%[10]。结合国内其他省市的报道,表明目前临床上PRRSV流行毒株仍以HP-PRRSV为主,但存在其他类型的毒株,并且在PRRSV不同类型毒株中,PRRSV NADC30-like流行趋势逐渐增强,我国多个地区开始以PRRSV NADC30-like为临床优势流行毒株,目前尚没有针对该毒株的疫苗,这也是导致PRRSV NADC30-like的流行逐渐呈现上升趋势的主要原因。
