布氏杆菌S2弱毒疫苗株的S2JY3基因生物信息学分析及原核表达
2020-06-08苏倩白丽艳孙柯林洋呼和巴特尔王文龙
苏倩,白丽艳,孙柯,林洋,呼和巴特尔,王文龙
(内蒙古农业大学兽医学院/农业农村部动物疾病临床诊疗技术重点实验室,内蒙古 呼和浩特 010018)
布氏杆菌(Brucella)是一种细胞内寄生革兰阴性球杆菌[1]。布氏杆菌属包括新发现的海洋哺乳动物种在内,有7个种,21个生物型[2]。布氏杆菌易感染牛、羊、猪、犬等动物,而骆驼、鹿等动物也可感染,可通过接触感染动物、食用未经加工的乳制品或其他被污染的动物产品以及实验室接触传播给人类,是一种全球范围内重大的人畜共患病,能引起人和多种动物的急性和慢性感染,被感染的人和动物表现为流产及不孕不育等症状[3]。该病的传播和流行既给畜牧业带来巨大经济损失,也给人的生命安全带来了极大威胁。目前布氏杆菌S2疫苗是我国应用最多的疫苗[4]。S2疫苗具有较低的残留毒力、较低的生产成本和相对容易的口服免疫,并且通过口服不会引起母畜的流产[5]。因此,自1971年以来,它在我国广泛应用于奶牛、山羊、绵羊和猪的免疫接种,在布氏杆菌病的防控过程中发挥了重要的作用[6]。但在使用的过程中,也出现了新的问题,如常用的诊断方法,无法区分疫苗免疫和自然感染动物,使得我国普遍采用的检疫淘汰和免疫结合的防治措施无法有效实施,不能在免疫羊群中彻底将患病动物检出,达到净化畜群的目的。为此,本研究在实验室前期工作的基础上[7-8],筛选出S2JY3基因,并运用NCBI中BLAST对S2JY3基因进行比对,发现S2JY3基因为布氏杆菌S2弱毒疫苗特有基因,对其进行生物信息学分析、克隆测序、原核表达和免疫原性验证,试验结果可为布氏杆菌病自然感染和疫苗接种免疫的鉴别诊断提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株与载体
布氏杆菌S2弱毒疫苗购自金宇保灵生物药品有限公司;大肠杆菌DH5α、BL21(DE3)感受态细胞购自北京全式金生物技术有限公司;克隆载体pMD19-T Simple Vector购自大连宝生物有限公司;表达载体pET30a(+)本实验室保存。
1.1.2 主要试剂
DNA提取试剂盒、质粒小提试剂盒和DNA凝胶回收试剂盒购自AXYGEN公司;DNA Marker购自北京全式金生物技术有限公司;限制性内切酶EcoR Ⅰ、XhoⅠ和SDS-PAGE凝胶制备试剂盒均购自北京索莱宝公司;T4 DNA连接酶和蛋白质Marker购自大连宝生物公司;驴抗绵羊IgG-HRP购自北京依托生物有限公司;试验所用血清由内蒙古农业大学兽医学院实验室采集保存。
1.2 方法
1.2.1 目的基因的扩增
将布氏杆菌S2弱毒疫苗(水浴锅中85 ℃灭活1 h),按照Axygen公司DNA提取试剂盒操作步骤进行基因组DNA提取。参照布氏杆菌S2弱毒疫苗全基因组测序数据中S2JY3基因序列设计引物,并分别在引物中引入酶切位点,上、下游引物序列见表1(划线处为EcoR Ⅰ、XhoⅠ酶切位点),由北京华大基因有限公司合成。目的基因PCR扩增反应体系为25 μL:DNA模板1 μL,上、下游引物各1 μL,Mix 12.5 μL,ddH2O 9.5 μL。PCR反应条件:94 ℃预变性5 min;94 ℃ 45 s,59 ℃ 30 s,72 ℃ 90 s,35个循环;72 ℃延伸10 min。将PCR产物用1.0%琼脂糖凝胶电泳进行检测。
表1 S2JY3基因引物设计
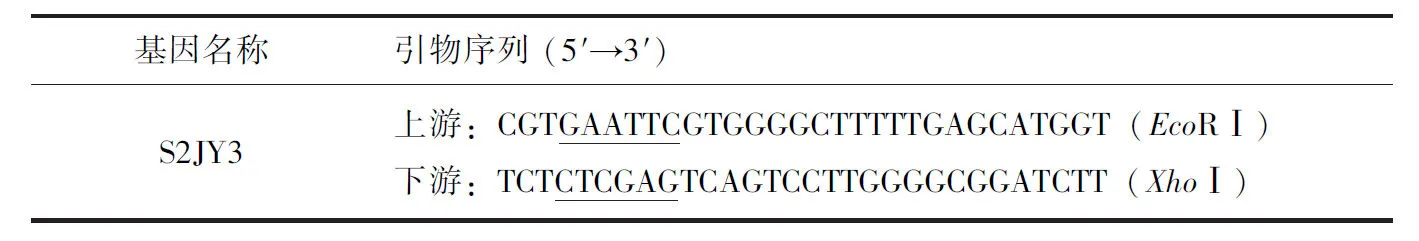
1.2.2 pET30a-S2JY3的构建
S2JY3基因PCR产物进行胶回收,在3′端添加“A-尾”后,连接克隆载体pMD19-T,转化到大肠杆菌DH5α感受态细胞中,将测序正确的重组克隆菌和pET30a(+)空载体的菌株提取质粒后,分别用限制酶EcoR Ⅰ、XhoⅠ进行双酶切,回收产物。将回收的目的基因DNA片段与表达载体pET30a(+)进行连接,连接产物转化到大肠杆菌BL21(DE3)感受态细胞中,180 r/min培养2 h后,将重组菌涂布于含卡那霉素(Kan)的固体LB培养基上,37 ℃培养过夜。待菌落生长后,以接种针挑取单个菌落,接种到含Kan的液体LB培养基里,37 ℃,180 r/min培养12 h,取菌液进行PCR鉴定、双酶切鉴定后,选取阳性菌株送华大基因有限公司进行双向测序。
1.2.3 重组表达菌诱导表达及Western blot检测
用异丙基硫代半乳糖苷(IPTG)对重组表达菌BL21(pET30a-S2JY3)进行诱导表达,收集菌体,用PBS 洗涤3次,加入溶菌酶至终浓度为1 mg/mL,室温静置1~2 h,经-20 ℃反复冻融3次之后超声波破碎菌体。分别收集上清和沉淀,用SDS-PAGE检测重组蛋白表达形式后,进行重组蛋白纯化。分别以鼠抗His-tag IgG、S2疫苗免疫羊血清、布氏杆菌自然感染羊血清为一抗,羊抗鼠IgG-HRP、驴抗绵羊IgG-HRP为二抗对重组蛋白进行Western blot检测。
1.2.4 S2JY3基因生物信息学分析
使用DNAStar将S2JY3基因翻译成氨基酸序列,应用在线软件ExPASy-Prot Param分析S2JY3基因编码产物的氨基酸序列组成及理化性质;ProtScale软件分析该蛋白的氨基酸残基的亲疏水性; TMHMM软件进行跨膜区结构预测;SignaIP 4.1在线软件进行信号肽分析[9];SOPMA在线软件分析蛋白质的二级结构;SWISS-MODEL预测基因编码蛋白的三级结构[10-11];DNAStar中的Protean软件预测细胞抗原表位等。
2 结果与分析
2.1 目的基因的PCR扩增
PCR扩增后,产物电泳结果显示(图1),扩增出大小约1 257 bp的条带,与S2JY3基因预期大小一致。
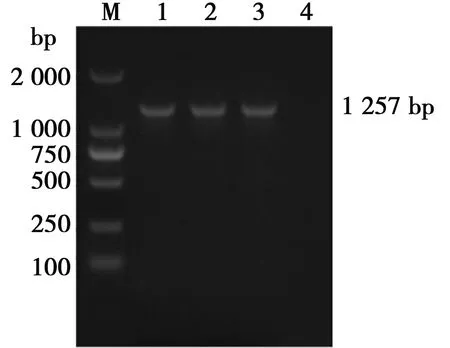
M.DL2000 DNA Marker;1~3. S2JY3基因PCR产物;4. 空白对照
图1 S2JY3基因PCR产物扩增结果
2.2 pET30a(+)-S2JY3重组质粒的鉴定
对重组克隆菌进行质粒双酶切鉴定,结果见图2,基因片段大小与预期相符。阳性菌株测序结果与基因组测序数据中S2JY3基因序列进行比对,两者序列完全一致。

M1. DL2000 DNA Marker;1~3. 重组克隆质粒的双酶切产物;M2. DL500 DNA Marker
图2 S2JY3基因重组克隆质粒双酶切鉴定结果
2.3 重组表达菌Western blot检测
重组表达菌BL21(pET30a-S2JY3)由IPTG诱导表达,经SDS-PAGE检测后,分别以鼠抗His-tag IgG、S2疫苗免疫羊血清、布氏杆菌自然感染羊血清为一抗,对重组蛋白进行Western blot检测,结果见图3,重组蛋白与鼠抗His-tag IgG、S2疫苗免疫羊血清均发生了结合反应,而与布氏杆菌自然感染羊血清未发生反应。

M.蛋白Marker;1. His-tag抗体检测;2. S2疫苗免疫血清检测;3. 自然感染血清检测
图3 重组蛋白Western blot检测
2.4 S2JY3基因编码产物的生物信息学分析
2.4.1 S2JY3蛋白理化性质分析
将S2JY3基因序列用DNAStar中EditSeq软件翻译为氨基酸序列后,经ExPASy-Prot Param分析发现S2JY3基因编码蛋白含有418个氨基酸,大小为43 kDa,分子式为C2138H3423N619O613S15,原子总数是6 808个,相对分子质量为48 088.38,理论PI值为9.73。该蛋白由20种氨基酸组成,其中精氨酸(Arg)(R)含量最高为9.8%,半胱氨酸(Cys)(C)含量最低为0.5%;带负电荷残基天冬氨酸和谷氨酸(Asp+Glu) 53个,带正电荷残基精氨酸和赖氨酸(Arg+Lys) 72个;当N端的1个氨基酸为缬氨酸(Val)时,S2JY3蛋白在体外哺乳动物网状红细胞中的半衰期为100 h,在酵母体内的半衰期大于20 h,在大肠埃希菌体内的半衰期大于10 h。蛋白质不稳定系数为36.31,表明是稳定蛋白;脂肪系数为79.88;总平均亲水性为-0.577,为亲水性蛋白。
2.4.2 S2JY3蛋白亲疏水性分析
用ProtScale在线软件对S2JY3蛋白进行亲疏水性进行分析,结果见图4,S2JY3蛋白是亲水性蛋白,其亲水性在249位点有最大值2.056,在280、281位点均有最小值-3.111,与ExPASy-Prot Param结果一致。

图4 S2JY3蛋白亲疏水性分析
2.4.3 S2JY3蛋白跨膜区和信号肽预测
用TMHMM预测跨膜区,S2JY3基因编码蛋白无跨膜区,全部在膜外,见图5。经SignalP软件预测该蛋白的信号肽,见图6,通过分析发现S2JY3编码产物不存在信号肽。
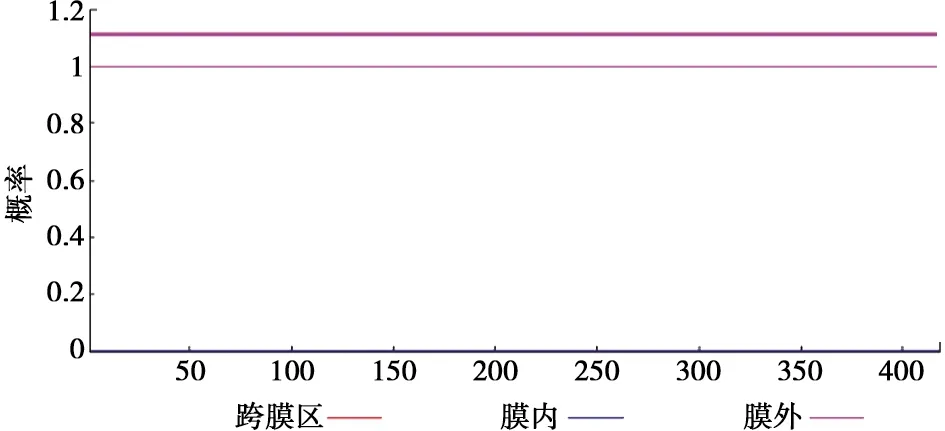
图5 S2JY3基因编码产物跨膜结构预测
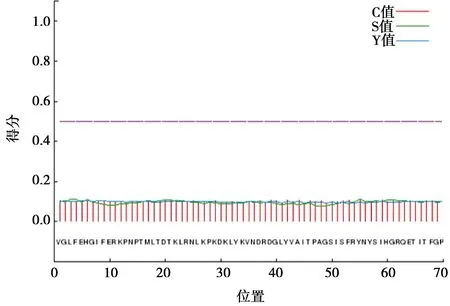
图6 S2JY3基因编码产物信号肽预测
2.4.4 S2JY3蛋白二级结构预测
应用SOPMA程序预测S2JY3基因编码蛋白的二级结构,S2JY3基因编码蛋白总长度为418个氨基酸,其中参与α螺旋形成的氨基酸有248个,占59.33%;参与形成延伸链的氨基酸有32个,占7.66%;参与形成β转角的氨基酸有23个,占5.50%;参与形成无规则卷曲的氨基酸有115个,占27.51%。
2.4.5 蛋白三级结构预测
S2JY3基因编码蛋白的三级结构,由α螺旋、β转角、延伸链和无规则卷曲组合形成复杂的三级结构。
2.4.6 蛋白抗原表位预测
抗原表位由DNAStar中的Protean软件预测可知该蛋白约有15个潜在B细胞抗原表位位点,分别在8~41、54~73、79~93、95~114、126~154、157~165、167~176、191~225、232~245、253~263、275~287、305~322、337~357、364~398、404~419位氨基酸残基附近。有21个潜在T细胞抗原表位位点,分别在2~5、7~10、20~22、31~34、110~141、152~158、161~170、189~212、226~240、242~246、257~260、266~269、271~273、293~306、326~332、336~339、343~348、353~358、369~373、382~387、396~412位氨基酸残基附近。
3 讨论
布氏杆菌病在全球范围内流行,近几年,我国的布氏杆菌病疫情有上升的趋势[12]。众所周知,布氏杆菌为胞内寄生菌,协助其进入细胞并感染细胞依靠的毒力因子有很多种,例如Sidhu-Muoz等[13]提到的5种必需的毒力因子:virB操纵子(virB)编码的Ⅳ型分泌系统(type Ⅳ secretion systems, T4SS)、环状β-葡聚糖、双组分调节系统(BvrS/BvrR)、脂多糖(lipopolysaccharide, LPS)以及病原相关分子模式(PAMPs)。这些毒力因子有助于巨噬细胞中病原体的存活和复制,布氏杆菌的细胞内转运和识别宿主防御的能力等[14]。布氏杆菌为了适应生存环境,逐渐的进化出一系列机制,如抑制细胞凋亡和通过其microRNA影响免疫应答等调节方式来逃避宿主早期的先天性和适应性免疫应答[15]。因此,该病主要以预防和控制为基础,疫苗的免疫接种在综合防治措施中发挥着重要作用。但现有的疫苗均有一定的缺陷,常用的诊断方法无法鉴别出疫苗免疫和自然感染,对种群净化方面带来一定的难度,亟需深入研究布氏杆菌病的发病机制、检测方法和防控措施等。
本试验以布氏杆菌S2弱毒疫苗特有的S2JY3基因为研究对象,成功构建重组表达蛋白rS2JY3,并进行Western blot鉴定,结果rS2JY3与布氏杆菌S2疫苗免疫绵羊血清发生特异性结合反应,与自然感染绵羊血清无反应,表明rS2JY3具有良好的抗原性和特异性。
在短短十多年时间里,生物信息学在信息技术和分子生物学理论的基础上迅速发展,成为用来处理和理解生命系统中不断增加的数据量的日常工具[16-17]。生物信息学技术在蛋白质、DNA、RNA及其复合物的三维结构等领域应用广泛,其预测结果有效的减少了试验的盲目性[18]。本试验利用其技术,对重组蛋白rS2JY3进行预测,该蛋白大小为43 kDa,理论PI值为9.73,由20种氨基酸组成,其中Arg(R)含量最高为9.8%,Cys(C)含量最低为0.5%;蛋白质不稳定系数为36.31,表明是稳定蛋白;脂肪系数为79.88;总平均亲水性为-0.577,为亲水性蛋白。重组蛋白rS2JY3全部位于膜外,不存在信号肽。二级结构结果显示参与α螺旋形成的氨基酸有248个,占59.33%;参与形成延伸链的氨基酸有32个,占7.66%;参与形成β转角的氨基酸有23个,占5.50%;参与形成无规则卷曲的氨基酸有115个,占27.51%。
综上,本试验成功构建原核表达蛋白rS2JY3,生物信息学分析表明该蛋白具有较多的B细胞抗原表位和T细胞抗原表位,易于被识别和促发免疫反应。研究结果为S2JY3蛋白的免疫学特性研究、S2疫苗的深入研究中提供有效理论基础,同时也为布氏杆菌病疫苗免疫和自然感染鉴定方法的建立提供可靠的依据。
