藏绵羊胎盘肽的抗氧化能力及结构表征
2020-06-06任海伟石菊芬王曼琪范文广李志忠
任海伟 - 石菊芬 - 王曼琪 - 范文广 - 李志忠 -
(兰州理工大学生命科学与工程学院,甘肃 兰州 730050)
生物体的正常代谢和外部刺激(包括吸烟、空气污染物和工业化学品)都会导致体内产生大量的不稳定自由基,这些自由基易与体内生物大分子如蛋白质、不饱和脂肪酸和核酸等发生反应,引起氧化损伤细胞或组织,甚至导致基因突变[1]。
人工合成的抗氧化剂(如BHA、BHT)抗氧化效果虽好,但对人体有潜在毒副作用,寻找天然安全的生物抗氧化剂已成为国内外研究的热点。抗氧化肽是一种具有抗氧化能力、生物安全性高的肽类物质,能抑制或阻止底物被氧化,是生物抗氧化剂的良好来源。动物源活性肽营养价值丰富,与人体营养结构吻合性好;进入人体后会选择性作用于相应器官,靶向效应好,更益于吸收;合理的氨基酸组成使其抗氧化能力优于植物源肽[2]。研究表明,山羊胎盘喂食幼犬后能增强血清总抗氧化能力、血清谷胱甘肽过氧化物酶活性和超氧化物歧化酶活性[3];山羊或小尾羊胎盘肽具有良好的DPPH自由基、超氧阴离子自由基、羟基自由基清除能力,抗氧化活性较好[4]。张丙云等[5]曾对复合酶法制备藏系绵羊胎盘肽的工艺条件进行了优化,但有关藏系绵羊胎盘肽的抗氧化能力研究还未见报道。
常见的体外抗氧化化学分析方法主要有脂质氧化降解、自由基清除和螯合金属离子等,根据作用机理可分为基于单电子转移(Fe3+和Cu2+还原能力、DPPH自由基和ABTS自由基清除能力)和氢原子转移(超氧阴离子自由基和羟基自由基清除能力、金属离子螯合能力)两种[6]。试验拟以藏绵羊胎盘肽为研究对象,通过6种不同的体外化学评价体系探讨其抗氧化能力,利用傅里叶变换红外光谱(FTIR)、扫描电镜(SEM)、X-射线衍射(XRD)和圆二色光谱(CD)等方法表征其结构变化,并结合肽的氨基酸组成、相对分子质量分布剖析藏绵羊胎盘肽的抗氧化能力成因,为藏绵羊胎盘资源的高值化利用提供依据。
1 材料与方法
1.1 材料与试剂
藏绵羊胎盘:蛋白质含量87.50%,兰州名德药业有限公司;
木瓜蛋白酶(酶活力8×105U/g)和中性蛋白酶(酶活力6×104U/g):北京索莱宝科技有限公司;
总抗氧化能力(T-AOC)测试盒、Cupric ion reducing antioxidant capacity(CUPRAC)试剂盒:南京建成生物工程研究所;
1,1-二苯基-2-三硝基苯肼(DPPH)、氯化硝基四氮唑蓝(NBT)、二丁基羟基甲苯(BHT)、1,10-邻二氮杂菲及菲洛嗪:美国 Sigma公司;
牛血清白蛋白:上海伯奥生物科技有限公司;
其余试剂均为分析纯。
1.2 仪器与设备
高剪切分散乳化机:FA25型,上海弗卢克流体机械制造有限公司;
酶标仪:SpectraMax i3x型,美谷分子仪器(上海)有限公司;
冷冻干燥机:SCIENTZ-18N型,宁波新芝生物科技股份有限公司;
圆二色光谱仪:JASCO-200C型,日本岛津公司;
扫描电子显微镜:JSM-5600LV型,日本电子光学公司;
傅里叶变换红外光谱仪:Nexus 670型,美国 Nicolet公司;
高效液相色谱仪:Waters 1525型,美国Waters公司。
1.3 方法
1.3.1 羊胎盘肽粉的制备 取一定量洁净的羊胎盘原料剪碎,与蒸馏水以1∶5 (g/mL)比例混匀配成匀浆液,经超声波预处理(功率438 W,时间16.5 min,温度25.5 ℃)后,以8 000 U/g加酶量加入复合蛋白酶(木瓜蛋白酶∶中性蛋白酶=3∶7),50 ℃、pH 7.0下水解4.9 h,离心,浓缩,冷冻干燥,得羊胎盘肽粉(简称肽粉)[7]。
1.3.2 多肽含量测定 准确称取100 mg肽粉配制成浓度为10 mg/mL的粗肽液,量取2.5 mL粗肽液,加入2.5 mL 10%三氯乙酸溶液混匀静置10 min,5 000 r/min离心10 min,取1 mL上清液置于10 mL比色管中,加入4 mL双缩脲试剂混匀,37 ℃恒温显色30 min,测定540 nm处吸光度值,对照品标准曲线y=0.054 8x-0.019 9(R2=0.992)。
1.3.3 相对分子质量分布分析 采用高效液相色谱仪测量相对分子质量分布,分析柱为TSKgel 2000 SWXL300 mm×7.8 mm;流动相为乙腈/水/三氟乙酸(40/60/0.1,体积比),流速0.5 mL/min,检测波长220 nm[7]。
1.3.4 氨基酸组成分析 精确称取1.00 g肽粉置于水解管中,加入5%三氯乙酸溶液溶解并静置沉淀2~3 h,双层滤纸过滤,取1 mL滤液离心,观察无沉淀或无明显分层后上机测定氨基酸组成[7]。
1.3.5 抗氧化能力测定
(1) DPPH自由基清除能力:参考Xing等[8]的方法略作修改,将2 mL不同浓度肽液(2.0,4.0,6.0,8.0,10.0 mg/mL)与1 mL蒸馏水、3 mL含0.1 mmol/L DPPH的无水乙醇溶液混匀,25 ℃避光反应30 min,4 000 r/min离心20 min,测定517 nm处的吸光度值;以无水乙醇代替DPPH溶液作样品对照,蒸馏水代替肽液作空白对照,BHT作阳性对照,DPPH自由基清除率按式(1)计算。
(1)
式中:
c——DPPH自由基清除率,%;
As——样品组吸光度值;
Ax——样品对照组吸光度值;
Ac——空白对照组吸光度值。
(2) 超氧阴离子自由基清除能力:参考Najafian等[9]的方法略作修改,将0.75 mL氮蓝四唑(300 μmol/L)溶解于3 mL Tris-HCl缓冲液(100 mmol/L,pH 7.4)中,再加入0.75 mL还原型辅酶I (936 μmol/L)、0.3 mL不同浓度肽液(5.0,10.0,15.0,20.0,25.0 mg/mL)和0.75 mL吩嗪硫酸甲酯(120 μmol/L),室温反应5 min,用96孔板测定560 nm处吸光度值,以蒸馏水作空白对照,BHT作阳性对照,超氧阴离子自由基清除率按式(2)计算。
(2)
式中:
d——超氧阴离子自由基清除率,%;
A0——样品组吸光度值;
A1——空白对照组吸光度值。
(3) 羟基自由基清除能力:参考Xing等[8]的方法略作修改,依次将40 μL 2 mmol/L硫酸亚铁溶液、40 μL 2 mmol/L 1,10-邻二氮杂菲溶液和80 μL不同浓度肽液(2.0,4.0,6.0,8.0,10.0 mg/mL)混合,加入40 μL0.03%双氧水,37 ℃恒温反应60 min,用96孔板测定536 nm处吸光度值,以无抗氧化剂为阴性对照,无双氧水为空白对照,BHT作阳性对照,羟基自由基清除率按式(3)计算。
(3)
式中:
e——羟基自由基清除率,%;
As——样品组吸光度值;
Ab——空白对照组吸光度值;
An——阴性对照组吸光度值。
(4) 金属离子(Fe2+)螯合能力:参考Zhang等[10]的方法略作修改,取0.5 mL不同浓度肽液(5.0,10.0,15.0,20.0,25.0 mg/mL)与1.6 mL蒸馏水和0.05 mL 2 mmol/L二氯化铁混匀,静置30 s,加入0.1 mL 5 mmol/L菲洛嗪室温反应10 min,测定562 nm处吸光度值。以等体积蒸馏水代替肽液作空白对照,BHT作阳性对照,金属离子螯合率按式(4)计算。
(4)
式中:
f——金属离子螯合率,%;
A0——空白对照组吸光度值;
A1——样品组吸光度值。
(5) 铁离子(Fe3+)还原能力:参考Wu等[11]的方法略作修改,取1 mL不同浓度肽液(5.0,10.0,15.0,20.0,25.0 mg/mL),依次加入2.5 mL 0.2 mol/L磷酸缓冲液(pH 6.6)和2.5 mL 1%铁氰化钾溶液,混匀,50 ℃水浴20 min,迅速冷却并加入2.5 mL 10%三氯乙酸溶液,振荡混匀,3 000 r/min离心10 min。取上清液1 mL,加入0.2 mL 0.1%三氯化铁溶液,混匀,加入1 mL去离子水摇匀,50 ℃恒温水浴10 min,以蒸馏水调零并在700 nm下进行比色分析。以BHT作阳性对照,吸光度值越大说明抗氧化性能力越强。
(6) 铜离子(Cu2+)还原能力:参照CUPRAC试剂盒说明书进行测定。
1.3.6 结构表征分析
(1) 扫描电镜(SEM):分别称取适量羊胎盘原料、肽粉样品置于导电胶上,固定后喷金,采用电子束对样品进行微观形貌拍摄,探针电压30 kV,电流50 pA,电子束加速电压5 kV。
(2) 傅里叶变换红外光谱(FTIR):将羊胎盘原料、肽粉样品与适量溴化钾混合置于玛瑙研钵中,研磨数分钟并用压片机压成透明小块;然后在分辨率4 cm-1、扫描范围4 000~400 cm-1条件下进行FTIR谱图采集。以溴化钾作空白背景,进行结果校正。
(3) X射线衍射(XRD):将羊胎盘原料、肽粉样品置于显微镜载玻片上,然后滴加一定量无水乙醇制成样品试片,放入X射线衍射仪中。测试条件为扫描范围(2θ)5°~80°,扫描速度2°/min,Cu-Kα射线为靶材,步长0.02,电压40 kV,电流100 mA。
(4) 圆二色谱(CD):将羊胎盘原料、肽粉样品分别溶解于去离子水中,置10 mm光径样品池,扫描波长300~190 nm,扫描速度100 nm/min,响应时间1 s。
1.3.7 数据处理 所有试验均进行3次重复,采用SPSS软件进行显著性差异分析,采用Origin6.1软件作图。
2 结果与分析
2.1 羊胎盘肽的相对分子量分布
由图1可知,羊胎盘肽的分子质量分布主要集中在1 000 Da以下,比例达89.04%;其中,分子量为500~1 000 Da的寡肽占14.05%,分子量<500 Da的小肽占74.99%,而1 000~2 000,2 000~3 000,3 000~5 000,>5 000 Da的多肽分别为5.98%,2.00%,1.56%,1.43%。说明制备的羊胎盘肽主要以<1 000 Da的寡肽为主。

图1 羊胎盘肽的相对分子质量分布
Figure 1 Distribution of relative molecular weight of placental peptide from tibetan sheep
2.2 羊胎盘肽的氨基酸组成
由表1可知,羊胎盘肽中Glu含量最高,羊胎盘肽中必需氨基酸 (EAA)含量丰富,组成合理,占总氨基酸(TAA)含量的34.54%,营养价值较高。据文献[12]报道,Ala、Met、Pro、Cys、Leu、Gly和Val对清除自由基有较好效果,上述氨基酸含量占总氨基酸含量的40.99%,此外,芳香族氨基酸Trp、Tyr和Phe可供氢,能减慢或终止自由基链式反应,有可能成为抗氧化肽的活性位点。
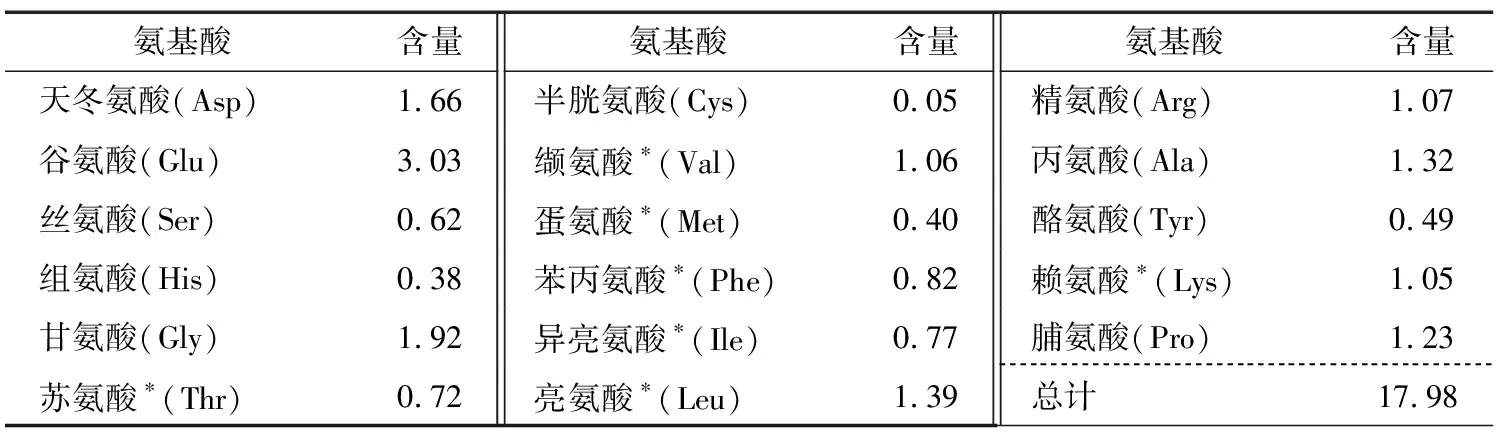
表1 羊胎盘肽粉的氨基酸组成†Table 1 Amino acid composition of peptide from tibetan sheep placenta mg/mL
† *为必需氨基酸。
2.3 羊胎盘肽的抗氧化能力
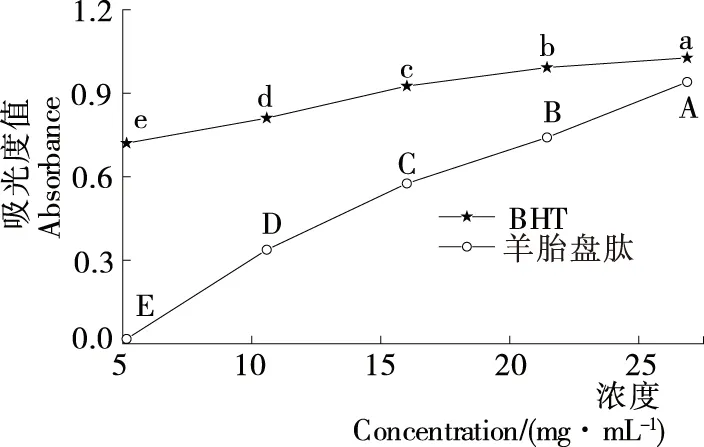
2.3.1 DPPH自由基清除能力 由图2可知,羊胎盘肽的DPPH自由基清除率随肽浓度的增加而提高,存在一定的剂量效应关系,与涂宗财等[13]得出的结果一致。当肽浓度为2~6 mg/mL时,DPPH自由基清除率的增速最快;当肽浓度为6 mg/mL时,清除率达85.70%;当肽浓度为6~10 mg/mL时,DPPH自由基清除率为85.70%~87.50%,差异不显著(P>0.05),与小尾羊胎盘肽的清除能力接近[4]。羊胎盘肽的DPPH自由基清除能力与BHT基本相当,其IC50值分别为2.83,2.28 mg/mL,二者抗氧化能力明显高于何小庆等[14]的结果。综上,羊胎盘肽具有良好的DPPH自由基清除能力,可能是因为羊胎盘酶解过程中释放出更多疏水性氨基酸侧链,作为氢供体与DPPH自由基反应,从而淬灭自由基,呈现出较强的抗氧化能力[15]。
2.3.2 超氧阴离子自由基清除能力 由图3可知,羊胎盘肽对超氧阴离子自由基的清除能力随浓度的升高而快速增加,呈良好线性量效关系,当肽浓度为25 mg/mL时,超氧阴离子自由基清除率达75.51%;当BHT浓度为10 mg/mL 时,超氧阴离子自由基清除率已高达92.43%。
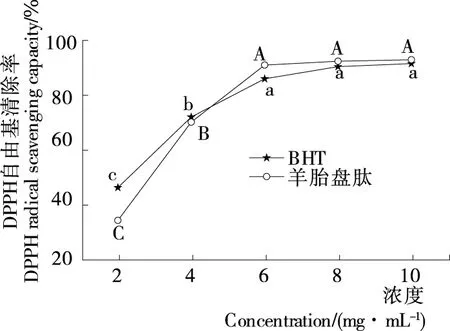
大写或小写字母不同表示差异显著(P<0.05)图2 DPPH自由基的清除能力Figure 2 Scavenging capacity of DPPH radical
羊胎盘肽和BHT的IC50值分别为15.17,6.89 mg/mL,前者约为后者2.2倍;与BHT相比,羊胎盘肽清除超氧阴离子自由基的能力相对较弱。

大写或小写字母不同表示差异显著(P<0.05)图3 超氧阴离子自由基的清除能力Figure 3 Scavenging capacity of radical
2.3.3 羟基自由基清除能力 由图4可知,羊胎盘肽和BHT对羟基自由基清除率的变化趋势基本相同。当肽浓度为2~6 mg/mL时,羊胎盘肽对羟基自由基清除率与浓度呈正相关;当肽浓度>10 mg/mL时,羟基自由基清除率达84.46%,明显高于小尾羊胎盘肽的清除能力(46.88%)[4]。羊胎盘肽和BHT的IC50值分别为0.94,2.62 mg/mL,前者清除羟基自由基能力强于BHT,也明显优于羊肝抗氧化肽(IC50值为17.01 mg/mL)[16]。这可能是因为羊胎盘肽中含有离子化的氨基或羧基等供氢体,能提供质子还原具有氧化性的自由基,从而终止自由基连锁反应,达到清除或抑制目的。
2.3.4 金属离子(Fe2+)螯合能力 由图5可知,羊胎盘肽对Fe2+螯合率随肽浓度的增加而快速增强,呈明显量效关系;BHT对Fe2+螯合率也表现出相同趋势,二者IC50值分别为18.19,15.33 mg/mL。与鱼肌原纤维蛋白对Fe2+螯合率(IC50值为42.98 mg/mL)相比[9],羊胎盘肽表现出优良的Fe2+螯合能力,主要是因为羊胎盘经酶水解后的游离组氨酸含量增加,而组氨酸中咪唑基的氨基可与Fe2+螯合,从而减少游离Fe2+浓度。此外,具有螯合金属离子能力的活性短肽链逐渐暴露也是具有良好螯合能力的原因之一[10]。
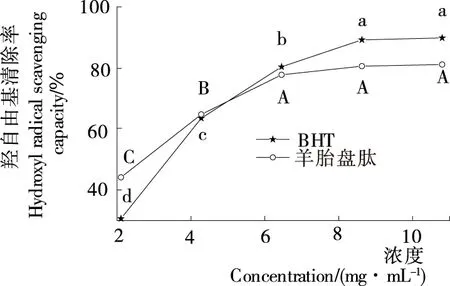
大写或小写字母不同表示差异显著(P<0.05)图4 羟自由基的清除能力Figure 4 Scavenging capacity ofhydroxyl radical
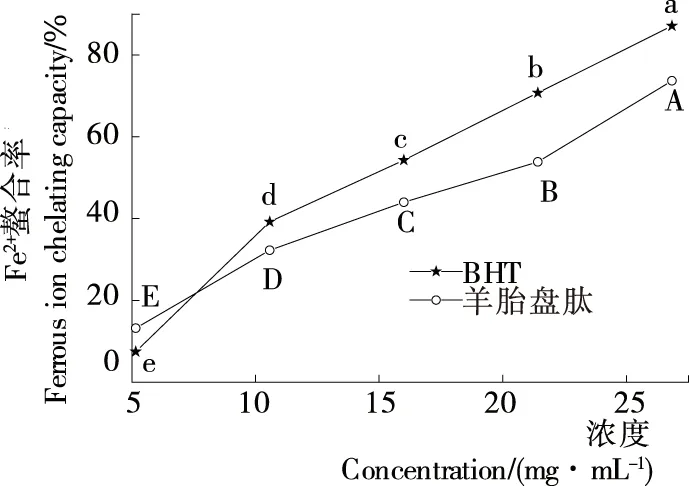
大写或小写字母不同表示差异显著(P<0.05)图5 金属离子螯合能力Figure 5 The Ferrous iron-chelation capacity
2.3.5 铁离子(Fe3+)还原能力 由图6可知,羊胎盘肽和BHT在700 nm处的吸光度值随其浓度的提高而增强,但IC50值相差明显,分别为14.32,0.04 mg/mL;与BHT相比,羊胎盘肽的还原力表现一般。Zhou等[16]发现鲍足肌抗氧化肽的Fe3+还原力IC50值为15 mg/mL,与羊胎盘肽能力相似。
2.3.6 铜离子(Cu2+)还原能力 由图7可知,当肽浓度为2~10 mg/mL时,羊胎盘肽对Cu2+还原能力随肽浓度的增加而显著升高,IC50值为8.91 mg/mL;相同浓度下羊胎盘肽的还原能力始终低于BHT(IC50值为1.91 mg/mL)。一般认为某物质的IC50值低于10 mg/mL时具有较好的抗氧化性,表明羊胎盘肽具有较强的Cu2+还原力和抗氧化能力,但仍弱于BHT。
2.4 结构表征分析
2.4.1 傅里叶变换红外光谱 由图8可知,羊胎盘在3 430 cm-1处吸收峰属于酰胺A带,是由游离态O—H伸缩振动引起的;2 930 cm-1处吸收峰为C—H伸缩振动;1 650 cm-1处吸收峰归属于酰胺I带,是由C—O伸缩振动所引起。研究[17]表明,1 650~1 660 cm-1为α-螺旋,1 600~1 640 cm-1为β-折叠,说明羊胎盘中的蛋白质结构主要为致密的α-螺旋。羊胎盘在1 540 cm-1处吸收峰为酰胺Ⅱ带特征范围,主要由N—H键弯曲振动引起;1 240 cm-1处吸收峰证明了蛋白质结构的完整性[22];1 410~1 100 cm-1处吸收峰主要由极性C—O键伸缩振动引起。
大写或小写字母不同表示差异显著(P<0.05)图6 铁离子还原力Figure 6 Reduction capacity of Ferric iron

大写或小写字母不同表示差异显著(P<0.05)图7 铜离子还原力Figure 7 Reducing capacity of cupric ion
当蛋白酶解为肽后,特征吸收峰出现了小幅移动,3 430 cm-1处吸收峰由尖锐变得平缓且发生红移,可能是由于游离态O—H伸缩振动与氢键缔合,致使O—H键长增大,并向低波数位移,活泼羟基变少。2 930 cm-1处吸收峰变弱表明蛋白质分子内和分子间的氢键断裂变弱;1 650 cm-1处吸收峰发生变化可能是酰胺I带(C═O伸缩振动)的β折叠,酰胺I带特征峰由多肽骨架的C═O伸缩振动在特定的氢键环境下引起的,其对二级结构变化十分敏感,是描述蛋白质二级结构的最主要峰,吸收峰发生红移且峰型变宽,说明超声辅助酶解导致蛋白质的二级结构发生变化,致密有序的α-螺旋结构被破坏,β-折叠结构增多,同时也表明酶解羰基增加,蛋白质裂解产生了更多小分子肽;1 540 cm-1处吸收峰消失说明酶解作用使部分肽键断裂,大分子蛋白裂解为肽;1 410 cm-1处羰基对称伸缩振动吸收峰变尖锐表明酶解后—COOH含量增加。总之,二者红外光谱图基本相同,表明酶解在一定程度上改变了峰的位置、强度和面积,但并没有出现新的功能团,即酶解改变了蛋白各种构象所占的比例,二级结构发生了不同程度的变化,与温慧芳等[18]的研究结果一致。

图8 羊胎盘和羊胎盘肽的红外光谱图Figure 8 FTIR of sheep placenta and sheep placenta peptide
2.4.2 扫描电镜 由图9可知,羊胎盘原料酶解前后的微观结构差异明显。羊胎盘原料呈连续凹凸不平、不规则的大孔海绵状结构,且有少数片状结构存在。酶解后,羊胎盘的完整结构被破坏,表面不规则凹陷明显消失,变成大量紧密聚集的小球状颗粒,不规则碎片减少。这可能是酶解过程使蛋白质分子间的氢键和范德华力被超声波的空化作用产生的局部微射流及震荡波所产生的剪切力所破坏,蛋白质结构被破坏,粒径减小,蛋白质表面暴露出更多的疏水性基团,进而提高酶解产物的抗氧化能力。
2.4.3 X-射线衍射 由图10可知,羊胎盘在20°左右有较强吸收峰,而羊胎盘肽在18°,22°,31°左右有强吸收峰,且吸收峰变尖锐,说明酶解反应使大分子蛋白在降解过程中发生重排和聚集,形成了更多稳定的小分子肽结晶体。含有高比例的疏水性氨基酸残基比亲水性较强的蛋白质一般更为稳定,说明经酶解后疏水性氨基酸含量提高,抗氧化活性增强[19]。
2.4.4 圆二色谱 由表2可知,羊胎盘酶解后的α-螺旋结构(紧密且没有空腔的稳定结构)含量降低,β-折叠及无规则卷曲含量显著升高,β-转角含量增加不明显,导致蛋白质分子表面疏水性变大,与红外光谱结论一致。这可能是超声辅助酶解可以破坏蛋白质间氢键和肽键进而使蛋白质结构发生改变,羊胎盘蛋白的空间结构展开,蛋白质分子内无序结构含量相对较高,β-折叠和无规卷曲增加,使得隐藏在内部的疏水性位点更多地显露出来,从而发挥特定的功能作用,这也是羊胎盘肽表现出一定抗氧化能力的原因之一。

图9 羊胎盘和羊胎盘肽的电镜扫描图
Figure 9 SEM photograph of sheep placenta and sheep placenta peptide (5 000×)
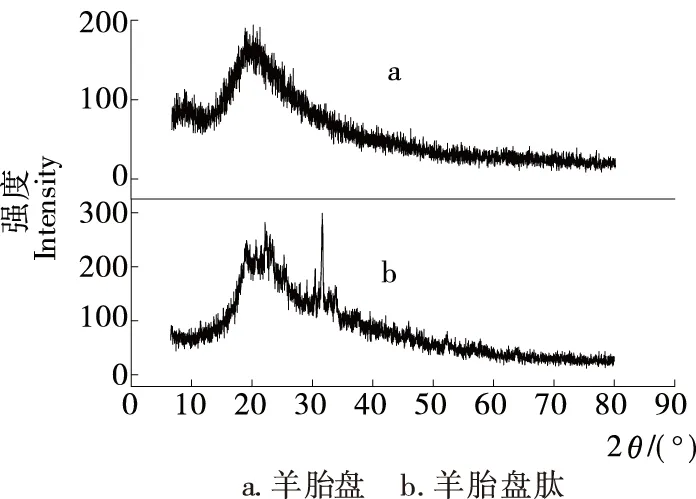
图10 羊胎盘和羊胎盘肽的X射线衍射图
Figure 10 XRD diagrams of sheep placenta and sheep placenta peptide
表2 羊胎盘及羊胎盘肽的二级结构

Table 2 Secondary structure of sheep placenta the and sheep placenta peptide %
由图11可知,羊胎盘及胎盘肽在192 nm处均有一正峰α-螺旋特征峰,216 nm附近有一个负峰β-折叠特征峰,为典型的蛋白质圆二色光谱图。
2.5 不同动物源肽的抗氧化能力比较
由表3可知,藏绵羊胎盘肽清除羟自由基能力稍弱于鲍鱼水解肽、卵白蛋白低聚肽和山羊胎盘肽,但明显强于其他动物源肽,可能与其分子量分布、分子中活泼氢原子数量及其位置有关[9]。研究[20]表明,分子量<1 000 Da抗氧化肽的羟自由基清除能力要优于>1 000 Da的肽片段。试验中羊胎盘肽分子量<1 000 Da的肽约占90%,同时小分子肽片段还能产生离子化氨基和羧基,易提供电子或氢原子干扰氧化,进而终止自由基介质导的链式反应[21]。

图11 羊胎盘和羊胎盘肽的圆二色谱图
Figure 11 CD spectrum of sheep placenta and sheep placenta peptide
表3 不同动物来源肽的抗氧化能力比较†Table 3 Antioxidant capacity comparison of different animal-derived antioxidative peptides
† “—”表示文献中无报道数据。
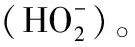
3 结论
藏绵羊胎盘肽具有良好的自由基清除能力,而还原能力和金属离子螯合能力相对较弱,且存在一定剂量依赖性。羊胎盘蛋白质在酶解过程中微观形态结构、结晶性能、蛋白分子构象和α螺旋、β折叠等空间结构的积极变化有助于小分子寡肽的抗氧化能力释放。后续仍需通过凝胶色谱、反相高效液相色谱等方法分离筛选高活性的抗氧化肽片段,并从氨基酸序列解析等角度进一步明确藏绵羊胎盘肽的抗氧化能力构效关系。
