全雌吉富罗非鱼家系选育及其生长性能分析
2020-06-04杨慧赞文露婷林勇杜雪松王瑞马华威曾兰胡庭俊
杨慧赞 文露婷 林勇 杜雪松 王瑞 马华威 曾兰 胡庭俊

摘要:【目的】建立XX型全雌吉富羅非鱼家系,为今后进行全雄吉富罗非鱼规模化制种提供优质母本,进而为罗非鱼性别控制及育种研究提供基础材料。【方法】通过给仔鱼连续15 d投喂60 mg/kg的甲基睾丸酮(MT)诱导获得表型全雄吉富罗非鱼,经测交筛选获得伪雄吉富罗非鱼(♂:XX),与常规雌性吉富罗非鱼(♀:XX)交配繁育全雌罗非鱼家系,经过3个世代选育获得全雌和伪雄吉富罗非鱼。根据吉富罗非鱼生殖孔外观结构差异进行性别鉴定;测量150日龄时各吉富罗非鱼家系的体长和体重,并计算罗非鱼肥满度。【结果】MT诱导吉富罗非鱼的雄性率达100.0%;吉富罗非鱼选育家系F1~F3代的平均雌性率分别为80.3%、92.4%和99.9%,分别获得5、5和6个全雌家系,其中F3代仅有1个非全雌家系(雌性率为99.4%)。吉富罗非鱼选育家系F1~F3代150日龄雄性罗非鱼的平均体重分别为815.4、857.9和930.1 g,较对照组提高8.73%、14.62%和21.31%,其中F2和F3代的体重显著高于对照组(P<0.05,下同);3个世代雄性罗非鱼平均体长分别为25.63、25.48和26.22 cm,较对照组提高3.51%、2.87%和4.42%,F3代的体长显著高于对照组。吉富罗非鱼选育家系F1~F3代150日龄雌性罗非鱼的平均体重分别为733.9、745.0和789.8 g,较对照组显著提高12.13%、16.48%和24.99%;平均体长分别为24.57、24.35和24.79 cm,较对照组提高3.93%、3.13%和4.07%,其中F1代的体长显著高于对照组。经过3个世代选育,吉富罗非鱼的生长性能得到大幅提升,F3代吉富罗非鱼选育家系的平均体重提高22.97%,保种家系的平均体重提高28.62%,且肥满度也得到明显提高。【结论】通过MT诱导处理可批量生产伪雄吉富罗非鱼,实现全雌吉富罗非鱼的规模化制种,经过3个世代选育,获得的伪雄和全雌吉富罗非鱼生长性能显著提高,更适于吉富罗非鱼育种及性别相关研究。
关键词: 吉富罗非鱼;MT诱导;全雌;伪雄;家系选育
Abstract:【Objective】XX type of all-female GIFT tilapias families were established to provide high quality female parent for large-scale production of all-male GIFT tilapias in the future, and then provide basic materials for sex control and breeding research of tilapias. 【Method】The larvae of GIFT tilapias were continuously fed 60mg/kg methyl testosterone(MT) for 15 d. When they grown into sexual maturity, the phenotype of all-male GIFT tilapias were induced, neomales with the XX genotype(♂:XX) were obtained by test cross, and then crossed with normal females with the XX genotype(♀:XX), yielded progeny all-females and neomales families of GIFT tilapias after three generations of selective breeding. According to the differences of the appearance and structure of the reproductive pores of tilapia, the body length and weight of each tilapia family at 150 days old were measured, and the condition factor of tilapias were calculated. 【Result】The rate of male GIFT tilapias induced by MT was 100.0%. The selection percentages of female GIFT tilapias breeding families from F1 to F3 generations were 80.3%, 92.4% and 99.9%, respectively, five, five and six all-female families were obtained, of which F3 had only one non-all-female family (rate of female was 99.4%).The average body weights of male GIFT tilapias breeding familiesof F1-F3 generations fed for 150 d were 815.4, 857.9 and 930.1 g, respectively, which were 8.73%, 14.62% and 21.31% higher than that of the control group. And those of F2 and F3 generations were significantly higher than that of the control group(P<0.05, the same below). The average body lengths of male GIFT tilapias were 25.63, 25.48 and 26.22 cm , respectively, which were 3.51%, 2.87% and 4.42% higher than that of the control group, and that of F3 generation was significantly higher than control. The average body weight of female GIFT tilapias breeding families of F1-F3 generationsfed for 150 d were 733.9, 745.0 and 789.8 g, respectively, which were 12.13%, 16.48% and 24.99% significantly higher than that of the control group. The average body lengths of female GIFT tilapias were 24.57, 24.35 and 24.79 cm, which were 3.93%, 3.13% and 4.07% higher than that of the control group, that of F1 generation was significantly higher than control. Breeding of three generations improved growth traits of GIFTA tilapia, F3 generationbreeding family increased the average weight by 22.97%, the average weight of breeding conservation family increased by 28.62%, and condition factor also improved greatly. 【Conclusion】Large-scale neomales can be obtained through MT induction, and all-female GIFT tilapias breeding in large-scale can be achieved. After three genera-tions of breeding, the growth performance of neomales and all-female GIFT tilapias is significantly improved, which is more sui-table for tilapias breeding and sex regulation researches.
0 引言
【研究意义】罗非鱼隶属于鲈形目(Perciformes)鲡鱼科(Cichlidae)罗非鱼属(Oreochromis),俗名非洲鲫鱼,原产于热带亚热带,因其具有繁殖力强、生长速度快、抗病力强等优点已成为当今世界上最重要的淡水养殖品种之一(陈胜军等,2007)。吉富品系尼罗罗非鱼(Gifford strain Nile tilapia,GIFT)简称吉富罗非鱼,是我国罗非鱼养殖的主导品系(刘峰等,2006),目前已在全国20多个省(市,区)推广养殖。我国是全球最大的罗非鱼生产国和出口国,罗非鱼产业对促进我国农业产业结构调整及农民增收具有重要意义。随着罗非鱼养殖规模的不断扩大,充足优质种苗持续供应是促进罗非鱼产业健康快速发展的基础保障。吉富罗非鱼种苗的数量与质量主要由母本(雌性尼罗罗非鱼)决定,但在罗非鱼种苗生产中母本单批产卵量较少,实际繁育时亲本配对的雌雄比例为3∶1左右,对母本需求量较大。因此,建立一个性状优良且遗传稳定的全雌家系对生产优质全雄吉富罗非鱼种苗具有重要意义。【前人研究进展】在实际生产中,由于雄性罗非鱼较雌性生长快,因此培育全雄罗非鱼苗进行单性养殖对提高罗非鱼产量及其经济效益具有重要意义。目前,罗非鱼全雄育种的方法主要有种间杂交、温度诱导、雄核发育和激素诱导等(谭德阶,2018;喻杰和杨弘,2020)。尼罗罗非鱼与奥利亚罗非鱼的杂交组合奥尼罗非鱼是种间杂交获得的全雄子代,具有明显的杂交优势,但其生长速度不及吉富罗非鱼母本,且在规模化生产实践中奥尼罗非鱼的雄性率通常只有95%左右。此外,除了有观点认为罗非鱼的常染色体参与性别决定(范兆廷,2014)外,环境因子也会影响罗非鱼性别,在罗非鱼受精卵孵化的温度敏感期(孵化后10~24 d),通过提高或降低水体环境温度可显著提高其雄性率,其中尼罗罗非鱼高温处理的雄性率在95%以上(Abucay et al.,1999;朱佳杰等,2012)。由于诱导尼罗罗非鱼雄性化需较高水温,因而不利于在规模化苗种繁育中推广应用。在雄性异配型(XX-XY型)鱼类中,利用雄核发育技术可一步获得YY超雄鱼,国内已有成功诱导大鳞副泥鳅(Paramisgurnus dabryanus)(赵振山等,1998,2000)和斑马鱼(Barchydanio rerio)(杨景峰等,2005)雄核发育的研究报道。雄核发育技术的难点在于获得遗传失活卵子,由于卵子体积较大,精子失活所采用的物理化学方法对其失活效果不佳,导致卵子遗传失活率很难达100%,而无法满足商业化应用的要求。在尼罗罗非鱼性别分化早期,通过投喂外源激素可显著诱导其性逆转。投喂雌激素雌二醇(E2)可制备出性染色体为XY的伪雌尼罗罗非鱼,再繁育出YY型超雄罗非鱼,进而实现全雄尼罗罗非鱼的规模化制种,且该技术已在生产实践中得到推广应用(杨永铨等,2012,2013)。连续投喂约含60 mg/kg 17α-甲基睾丸酮(17α-MT)的饲料28 d可直接获得全雄尼罗罗非鱼群体(Barry et al.,2007)。MT作为水产种苗培育和性别控制的特效药,适宜的浓度能促进罗非鱼生长,实现雄性化,但浓度过高会导致畸形而引起死亡(邹琴等,2010)。关于MT在罗非鱼体内消除规律的研究表明,在罗非鱼发育早期投喂MT,至其上市时已达食品质量安全要求,食用对人体健康安全无害(Green and Teichert-Coddington,2000;祝璟琳等,2012)。【本研究切入点】由于尼罗罗非鱼的性别决定染色体类型为XY型,即雌性为同配性别XX型,雄性为异配性别XY型。因此,将XX型雌性罗非鱼性逆转为XX型伪雄罗非鱼是建立全雌吉富罗非鱼家系的关键。【拟解决的关键问题】设计全雌吉富罗非鱼配套家系的生产技术路线,通过投喂适宜浓度的MT将XX型雌性吉富罗非鱼性逆转为XX型伪雄吉富罗非鱼,然后以XX型伪雄吉富罗非鱼与正常XX型雌性吉富罗非鱼进行繁殖即可批量生产XX型雌性吉富罗非鱼,建立XX型全雌吉富罗非鱼家系,为今后进行全雄吉富罗非鱼规模化制种提供优质母本,进而为罗非鱼性别控制及其育种研究提供基础材料。
1 材料与方法
1. 1 试验材料
吉富罗非鱼亲本由国家级广西南宁罗非鱼良种场人工养殖提供。MT(纯度≥96%)购自宁波第二激素厂。基础饲料为通威股份有限公司生产的罗非鱼膨化配合饲料,其饲料成分:粗蛋白≥30.00%,粗纤维≤10.00%,粗灰分≤16.00%,钙0.30%~3.00%,粗脂肪≥3.00%,总磷0.30%~3.00%,氯化钠0.20%~1.00%,赖氨酸≥1.10%,蛋氨酸≥0.45%,水分≤14.00%。
1. 2 试验方法
1. 2. 1 吉富罗非鱼亲鱼来源及种苗孵化 挑选性腺成熟、发育良好、生殖细胞均匀且活力强的吉富罗非鱼亲本,雌鱼体重在400 g/尾以上,雄鱼体重在600 g/尾以上,将罗非鱼亲本按雌雄比1∶1放入1.5 m×1.5 m×1.5 m網箱进行配对。每天定时投喂罗非鱼饲料3次,日投喂量在鱼体重的2%以下,养殖水温25~30 ℃,每隔7 d仔细检查雌鱼口中的含卵情况,取出含卵雌鱼口中的受精卵,清水漂洗后进行体外人工孵化。
1. 2. 2 家系建立及种苗培育 同一网箱各对吉富罗非鱼亲本所生产的受精卵为同一家系,将同一家系的罗非鱼受精卵置于24 h持续流水、水温25~30 ℃的水箱中进行孵化,待仔鱼出膜48 h后各家系随机选600尾鱼苗,随机分为处理组和对照组,每组300尾,置于6.0 m×1.0 m×1.0 m的水泥池中继续养殖,水体为曝气后的地下水,水温25~30 ℃。
1. 2. 3 饲料制备与饲养管理 参考El-Greisy和El-Gamal(2012)的方法:将MT先用98%酒精助溶,后溶于水制成水溶液,与鳗鱼饲料按3∶5的体积质量比混匀制成直径0.2~0.5 cm的颗粒状饵料,药物浓度以每千克鳗鱼饲料中的MT含量计,处理组为60 mg/kg MT,对照组为0 mg/kg MT。鱼苗开口即投喂MT处理饲料,日投饵量约为鱼体总重的8%,连续投喂15 d后改投喂普通饲料继续饲养15 d。种苗培育至20 g/尾左右,分家系进行鳍条标记,放入0.17 ha的鱼塘进行成鱼养殖,日投饵量为鱼体重的3%~5%,养殖周期120 d,水温25~32 ℃。统计处理组和对照组家系种苗的雌雄比例。
1. 2. 4 全雌家系选育 以MT诱导获得的表型全雄吉富罗非鱼为父本,与性状优良的普通雌性罗非鱼母本进行配对繁育获得子代家系,统计各子代家系的雌雄比例,从而推断该家系父本的性染色体型,测交筛选得到的功能性雄鱼即伪雄罗非鱼(性染色体为XX型)。利用伪雄罗非鱼为父本与普通雌性吉富罗非鱼母本繁殖即可获得后代均为XX型全雌罗非鱼,实现全雌吉富罗非鱼的规模化制种。从中选取部分全雌种苗以相同方式投喂MT即可获得伪雄吉富罗非鱼,实现伪雄吉富罗非鱼批量生产(图1)。
1. 2. 5 性别鉴定方法 根据吉富罗非鱼生殖孔外观结构差异进行性别鉴定(SC/T 1105-2007):雌性罗非鱼腹部有3个近临的开孔[肛门、生殖孔(排卵孔)和泌尿孔],且生殖孔位于肛门和泌尿孔之间,呈微红色。雄性罗非鱼仅有2个近临的开孔(肛门和泄殖孔),泄殖孔一个圆形的突起上,顶端仅为一个圆点。
1. 2. 6 生长性能测定 对试验开始前1 d和150日龄的各吉富罗非鱼家系进行体长和体重测量,称重前12 h停止投饵,称重时以干毛巾吸干体表水分,体重精确到0.1 g,体长精确到0.01 cm。根据体重和体长计算罗非鱼肥满度,肥满度(CF,%)=体重/体长3×100。
1. 3 统计分析
试验数据采用Excel 2010和SPSS 17.0进行统计分析,并以Duncan?s新复极差法进行组间差异显著性分析。
2 结果与分析
2. 1 MT诱导吉富罗非鱼的雄性率
人工孵化吉富罗非鱼鱼苗开口立即投喂含60 mg/kg MT的鳗鱼饲料,MT诱导15 d后改投普通饲料,再常规培育至其性成熟,结果统计发现生理表型为雄性的罗非鱼比例为100.0%。
2. 2 诱导雄鱼繁育获得子代的性别比例
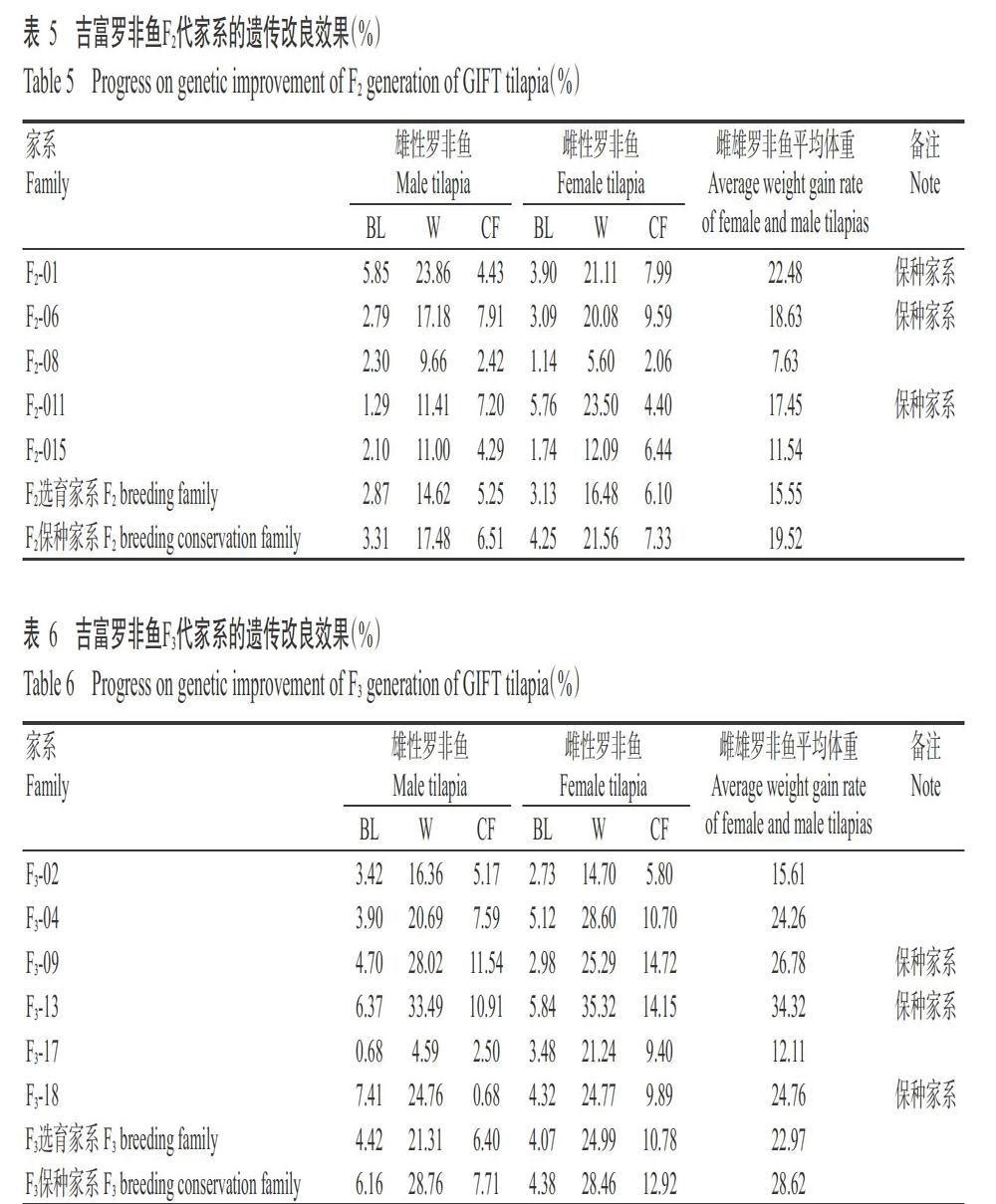
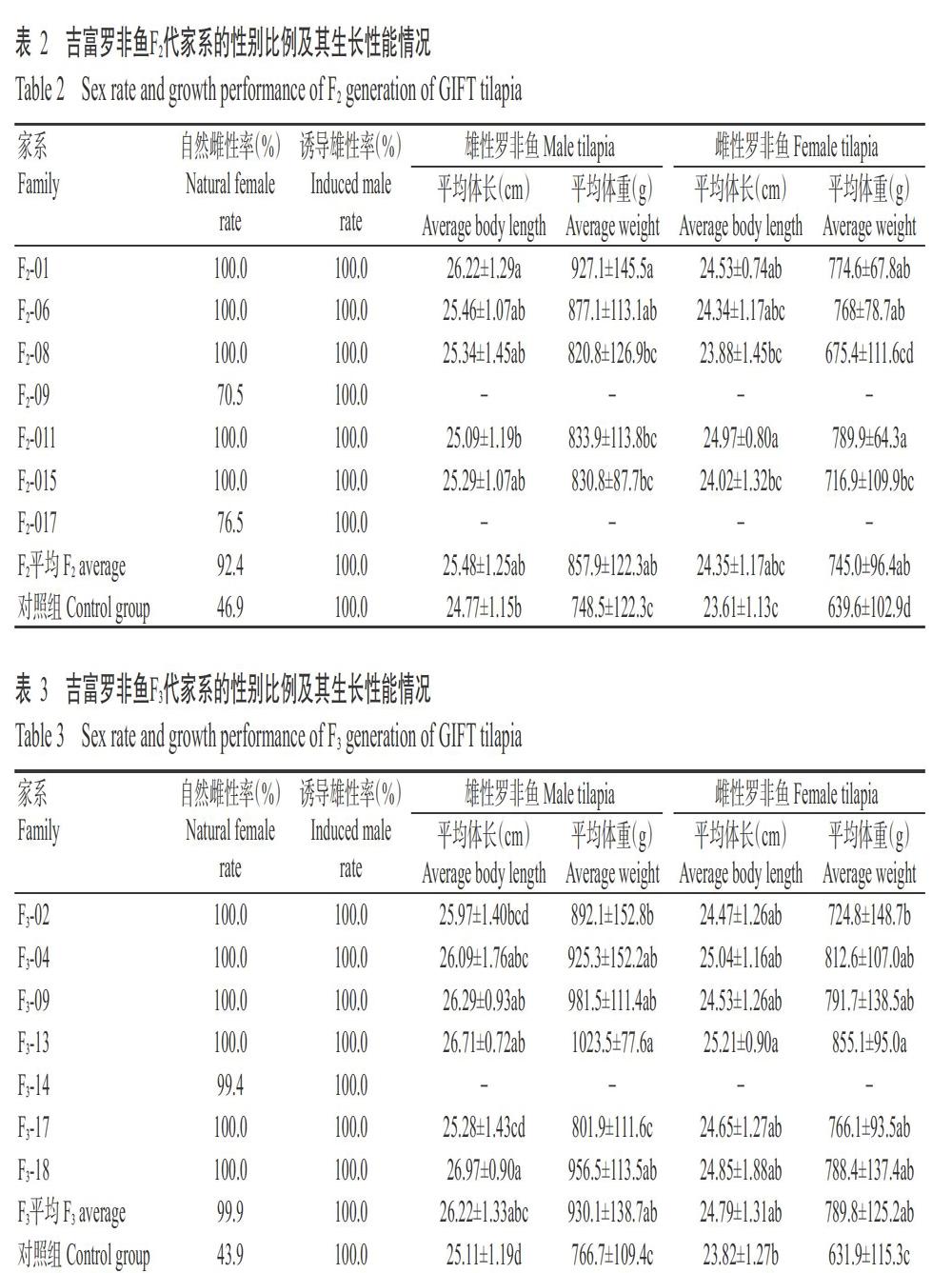
以MT处理完全性逆转的全雄吉富罗非鱼(表型为雄性,基因型XX或XY)与XX型雌性吉富罗非鱼配对繁育,人工孵化获得的吉富罗非鱼仔鱼培育至性成熟,配组家系20个,繁育获得F1代家系9个(表1),自然培育平均雌性率为80.3%(对照组为52.4%),其中5个家系的雌性率为100.0%,1个家系的雌性率为78.2%,其余3个家系的雌性率接近50.0%。选留雌性率为100.0%家系继续培育并进行生长性能评价,筛选3个生长性能优良家系中的优秀个体建立F1代核心种群。以F1代核心种群的伪雄吉富罗非鱼为父本,与F1代核心种群雌鱼配组家系18个,繁育获得F2代家系7个(表2),自然培育平均雌性率为92.4%(对照组为46.9%),其中5个家系的雌性率为100.0%,另外2个家系的雌性率分別为70.5%和76.5%。选留雌性率为100.0%家系继续培育并进行生长性能评价,筛选3个生长性能优良家系的优秀个体建立F2代核心种群。以F2代核心种群的雄性罗非鱼为父本,与F2代核心种群雌性罗非鱼配组家系18个,繁育获得F3代家系7个(表3),自然培育平均雌性率为99.9%(对照组为43.9%),其中6个家系的雌性率为100.0%,另外1个家系的雌性率为99.4%。选留雌性率为100.0%家系继续培育并进行生长性能评价,筛选3个生长性能优良家系的优秀个体建立F3代家系群体。
2. 3 吉富罗非鱼选育家系F1~F3代的生长性能评价
吉富罗非鱼选育家系F1~F3代及对照组的生长性能指标见表1~表3。在MT诱导获得的所有吉富罗非鱼家系中,雄性罗非鱼的生长速度均比雌性罗非鱼快,F1~F3代雄性罗非鱼的平均体重分别较雌性罗非鱼重11.11%、15.15%和17.76%,平均体长分别较雌性罗非鱼长4.31%、4.64%和5.77%。F1~F3代雄性罗非鱼的平均体重分别为815.4、857.9和930.1 g,其中,F1代雄性罗非鱼的体重与对照组无显著差异(P>0.05,下同),F2和F3代雄性罗非鱼的体重显著高于对照组(P<0.05,下同);F1~F3代雌性罗非鱼的平均体重分别为733.9、745.0和789.8 g,均显著高于对照组;F1~F3代雄性罗非鱼的平均体长分别为25.63、25.48和26.22 cm,其中F3代雄性罗非鱼的体长显著高于对照组,其他世代与对照组无显著差异;F1~F3代雌性罗非鱼的平均体长分别为24.57、24.35和24.79 cm,仅F1代雌性罗非鱼的体长显著高于对照组;3个世代的对照组为相同亲本、不同年份繁殖的子代,3个对照组吉富罗非鱼的生长性能差异不显著。
2. 4 吉富罗非鱼选育家系F1~F3代遗传改良效果及选育情况
由表4~表6可知,吉富罗非鱼选育家系F1~F3代雄性罗非鱼的平均体重较对照组分别提高8.73%、14.62%和21.31%,平均体长分别提高3.51%、2.87%和4.42%,肥满度表现为F1代较对照组降低2.07%,F2和F3代较对照组分别提高5.25%和6.40%;F1~F3代雌性罗非鱼的平均体重较对照组分别提高12.13%、16.48%和24.99%,平均体长分别提高3.93%、3.13%和4.07%,肥满度表现为F1代较对照组降低0.12%,F2和F3代较对照组分别提高6.10%和10.78%。综上所述,吉富罗非鱼选育家系F1~F3代的体重和肥满度逐年上升,但F2代的体长较F1代有所下降。
本研究以150日龄吉富罗非鱼家系的平均体重为选择性状进行选育,每个世代筛选3个平均体重最重的家系作为该世代保种家系。吉富罗非鱼F1~F3代保种家系的平均体重较对照组分别提高14.33%、19.52%和28.61%,其中,雄性罗非鱼的体重分别提高14.14%、17.48%和28.76%,雌性罗非鱼的体重分别提高14.53%、21.56%和28.46%;吉富罗非鱼F1~F3保种家系雄性罗非鱼的体长较对照组分别提高4.75%、3.31%和6.16%,雌性罗非鱼的体长分别提高4.09%、4.25%和4.38%。经过3个世代的选育,吉富罗非鱼的生长性能得到大幅提升,F3代吉富罗非鱼选育家系的平均体重提高22.97%,保种家系的平均体重提高28.62%,且肥满度也得到明显提高。吉富罗非鱼F3代最优秀保种家系(F3-13)的平均体重较对照组提高34.32%,雌雄罗非鱼的体重较对照组分别提高33.49%和35.32%,体长分别提高6.37%和5.84%,肥满度分别提高10.91%和14.15%。
3 讨论
罗非鱼性成熟早且繁殖周期短,雌雄混养常导致种群过度繁殖、养殖密度过大及个体过小等不良后果,严重影响罗非鱼的产量和质量。雄性罗非鱼的生长速度较雌性罗非鱼快40%~50%,因此,进行罗非鱼单性养殖既可有效防止其繁殖过度,又能充分发挥雄鱼的生长优势,提高产量及经济效益(楊景峰和徐桂珠,2003)。本研究以MT(60 mg/kg)投喂诱导吉富罗非鱼转性,可获得100.0%的表型雄性罗非鱼。经MT诱导获得的雄性罗非鱼其生长速度平均增幅为(14.95±6.95)%,快于未经诱导的雌性罗非鱼,与钱晖和杨文(1993)、李家乐等(1997)的研究结果相似,体现出罗非鱼属生长性状的性别二态性。
罗非鱼性别决定的基础是染色体遗传型,其遗传模式十分复杂,不同种的染色体型也不同(邹芝英等,2009),除了常染色体参与其性别决定外,环境因素也发挥一定作用(Baroiller and DCotta,2001)。本研究中,吉富罗非鱼选育家系F1代自然养殖群体的平均雌性率为80.3%,其中5个家系的雌性率为100.0%,其余4个家系的雌性率为44.8%~78.2%,进一步证实吉富罗非鱼性染色体为雄性异质型(XX-XY)的理论。但吉富罗非鱼选育家系F2代出现2个自然养殖的非全雌家系,其雌性率分别为70.5%和76.5%,与罗非鱼常染色体基因参与性别决定的理论相吻合,罗非鱼常染色体有一对等位基因(AA或aa)与性染色体共同影响其性别决定。当罗非鱼的性别决定有关性染色体与常染色体位点间的作用超过某一阈值时,个体发育为雄性,低于这一阈值则发育为雌性。吉富罗非鱼选育家系F3代的自然雌性率高达99.9%,7个家系中仅有1个家系出现1尾雄鱼,其原因可能是变异、环境因素或混杂,而由遗传因素导致的概率极低。可见,通过本研究设计的全雌吉富罗非鱼选育技术路线可获得吉富罗非鱼全雌和伪雄家系,虽然在规模化繁育过程中可能会出现非全雌家系,但依然具有较高的雌性率。
水产动物选择育种是在育种材料内出现的自然变异类型中,经比较鉴定后优胜劣汰,积累并稳定优良性状的基因型,形成新品种(范兆廷,2014)。至今,国内外已有许多水产动物选育成功的案例,包括挪威大西洋鲑(Grjederm,1979)、兴国红鲤(薛耀怀,1988)、吉富罗非鱼(Eknath et al.,1993)、浦江1号团头鲂(李思发,2001)、黄海一号中国对虾(李朝霞等,2006)、新吉富罗非鱼(李思发和蔡完其,2008)及彭泽鲫(楼允东,2009)等。水产动物选育多以高产为目标,Brzeski和Doyle(1995)提出就鱼类而言,体长每代获得2.0%的选择响应即相当于体重4.4%的选择响应;Gjedrem(2000)研究认为对鱼类进行6代生长速度选育,每代选择响应可达15.0%。本研究结果表明,经过3个世代选育后吉富罗非鱼雌雄鱼的体长选择响应分别为4.07%和4.42%(年均1.36%和1.47%),体重选择响应分别为24.99%和21.31%(年均8.33%和7.10%)。影响选择效果的主要因素包括性状变异程度、遗传力和选择强度等,因此,选用不同选育技术对不同群体进行选育获得的效果存在明显差异。孟加拉水产研究所(BFRI)对吉富罗非鱼进行4个世代选育,其生长速度较基础群体快27.3%,F1~F4代的选择响应分别为5.0%、2.9%、12.5%和6.9%(Hussain,2004)。Khaw等(2008)对马来西亚吉富品系罗非鱼的9个选育世代进行研究,结果表明平均每代获得7.1%的选择响应。颉晓勇等(2009)选育的罗非鱼经偏差校正后发现,F8代的生长较F7代快11.25%,F7代的生长较F6代快4.42%。Ponzoni等(2011)对吉富罗非鱼8个选育世代群体的生长表型、遗传参数及获得的选择响应进行研究,发现F8代与基础群体相比获得了52.5%的选择响应,平均每代获得6.56%的选择响应。唐首杰等(2013)通过对新吉富罗非鱼选育后期F13~F15代的生长性能进行比较,发现经过15个世代的人工选育仍可获得平均每代7.10%的选择响应。与上述研究结果相比,本研究取得良好的选择响应,获得了全雌和全伪雄家系,同时证实进行罗非鱼早期生长性能选择可通过提高选择强度以获得更好的选择响应,进而提高遗传改良效率。
4 结论
通过MT诱导处理可批量生产伪雄吉富罗非鱼而实现全雌吉富罗非鱼的规模化制种,经过3个世代选育,获得的伪雄和全雌吉富罗非鱼生长性能显著提高,更适于吉富罗非鱼育种及性别调控研究。
参考文献:
陈胜军,李来好,杨贤庆,岑剑伟,吴燕燕,刁石强. 2007. 我国罗非鱼产业现状分析及提高罗非鱼出口竞争力的措施[J]. 南方水产,3(1):75-80. [Chen S J,Li L H,Yang X Q,Cen J W,Wu Y Y,Diao S Q. 2007. Present situation of tilapia industry and measures of improving export competition power[J]. South China Fisheries Science,3(1):75-80.]
范兆廷. 2014. 水产动物育种学[M]. 北京:中国农业出版社:176. [Fan Z T. 2014. Aquatic animal breeding[M]. Beijing:China Agriculture Press:176.]
李家乐,李思发,韩风进. 1997. 甲基睾丸酮诱导吉富品系尼罗非鲫雄性化的研究[J]. 水产学报,21(S):107-110. [Li J L,Li S F,Han F J. 1997. Sex-reverse of gift strain of Oreochromis niloticus by methyltesterone[J]. Journal of Fisheries of China,21(S):107-110.]
李思发,蔡完其. 2008. 全国水产原良种审定委员会审定品种——“新吉富”罗非鱼品种特点和养成技术要点[J]. 科学养鱼,(5):21-22. [Li S F,Cai W Q. 2008. Varieties approved by National Aquatic Original Varieties Examination and Approval Committee—“New GIFT”tilapia varieties characteristics and key points of cultivation technology[J]. Scientific Fish Farming,(5):21-22.]
李思发. 2001. 鱼类良种介绍 团头鲂浦江1号[J]. 中国水产,(11):52. [Li S F. 2001. Introduction of improved fish variety No.1 Yuanpu River,Tuantou[J]. China Fisheries,(11):52.]
李朝霞,李健,王清印,何玉英,刘萍. 2006. 中国对虾“黄海1号”选育群体与野生群体的形态特征比较[J]. 中国水产科学,13(3):384-388. [Li Z X,Li J,Wang Q Y,He Y Y,Liu P. 2006. The comparison of morphological characte-ristics in selected new variety “Huanghai No.1” and the wild population of shrimp Fenneropenaeus chinensis[J]. Journal of Fishery Sciences of China,13(3):384-388.]
劉峰,谢新民,郑艳红. 2006. 罗非鱼优良品系——吉富罗非鱼的育成始末[J]. 水产科技情报,33(1):8-10. [Liu F,Xie X M,Zheng Y H. 2006. Fine strain of tilapia—The beginning and end of breeding of Gifford tilapia[J]. Fishe-ries Science & Technology Information,33(1):8-10.]
楼允东. 2009. 鱼类育种学[M]. 北京:中国农业出版社:29-36. [Lou Y D. 2009. Fish breeding[M]. Beijing:China Agriculture Press:29-36.]
钱晖,杨文. 1993. 激素诱导罗非鱼雄性化的试验研究[J]. 淡水渔业,23(4):41-42. [Qian H,Yang W. 1993. Experimental study on hormone-induced masculinization of tilapia[J]. Freshwater Fisheries,23(4):41-42.]
谭德阶. 2018. 罗非鱼近缘种杂交系的建立及其性别连锁分子标记的筛选[D]. 重庆:西南大学. [Tan D J. 2018. Establishment of hybrid strains in closely related tilapias and screening of sex-linked markers[D]. Chongqing:Southwest University.]
唐首杰,何安元,李思发,蔡完其,赵金良,王成辉. 2013. “新吉富”罗非鱼选育后期世代F13-F15的生长性能比较研究[J]. 上海海洋大学学报,22(1):1-6. [Tang S J,He A Y,Li S F,Cai W Q,Zhao J L,Wang C H. 2013. Comparison of growth performance among the late selected gene-rations of F13-F15 of NEW GIFT strain of Nile tilapia (Oreochromis niloticus)[J]. Journal of Shanghai Ocean University,22(1):1-6.]
颉晓勇,钟金香,李思发,蔡完其,张汉华,叶卫,陈辉崇. 2009. 吉富品系尼罗罗非鱼选育系F6、F7和F8当年鱼生长对比研究[J]. 南方水产,5(1):48-53. [Xie X Y,Zhong J X,Li S F,Cai W Q,Zhang H H,Ye W,Chen H C. 2009. Comparison of growth performance of F6,F7 and F8 of GIFT strain Oreochromis niloticus[J]. South China Fisheries Science,5(1):48-53.]
薛耀怀. 1988. 选育前后兴国红鲤的生长对比试验[J]. 淡水渔业,(6):26-27. [Xue Y H. 1988. Comparison of growth of Xingguo red carp(Cyprinus Carpiovar) before and after breeding[J]. Freshwater Fisheries,(6):26-27.]
杨景峰,曹颖霞,杨智慧,刘伟成. 2005. 斑马鱼雄核发育技术研究[J]. 水产科学,24(2):18-21. [Yang J F,Cao Y X,Yang Z H,Liu W C. 2005. Androgenesis in zebrafish (Danio rerio)[J]. Fisheries Science,24(2):18-21.]
杨景峰,徐桂珠. 2003. 罗非鱼全雄控制技术研究进展[J]. 内蒙古民族大学学报(自然科学版),18(4):318-322. [Yang J F,Xu G Z. 2003. Advance on control technique of monosex male tilapia[J]. Journal of Inner Mongolia University for Nationalities(Natural Sciences),18(4):318-322.]
杨永铨,张海明,陈远生. 2012. WY♀-YY♂型罗非鱼新品种选育和生物学研究[J]. 淡水渔业,42(5):73-74. [Yang Y Q,Zhang H M,Chen Y S. 2012. The type of WY♀-YY♂ tilapia breeding and biological study of the new variety[J]. Freshwater Fisheries,42(5):73-74.]
杨永铨,张海明,陈远生,陈国华. 2013. 尼罗罗非鱼新品种“鹭雄1号”的制种研究[J]. 淡水渔业,43(2):92-95. [Yang Y Q,Zhang H M,Chen Y S,Chen G H. 2013. Study on the breeding of Oreochromis niloticus new variety “Lu-xiong 1”[J]. Freshwater Fisheries,43(2):92-95.]
喻杰,杨弘. 2020. 鱼类性别决定的遗传基础及性别控制技术在水产养殖中的应用[J]. 大连海洋大学学报,35(2):161-168. [Yu J,Yang H. 2020. Genetic basis of sex determination and application of sex control in fish:A review[J]. Journal of Dalian Ocean University,35(2):161-168.]
赵振山,吴青江. 1998. 人工诱导大鳞副泥鳅雄核发育二倍体克隆鱼的产生[J]. 遗传学报,25(5):416-421. [Zhao Z S,Wu Q J. 1998. Artificial induced the production of androgenetic diploid clones in Paramisgurnus dabryanus[J]. Acta Genetica Sinica,25(5):416-421.]
赵振山,吴青江,刘辉宇,高贵琴. 2000. 大鳞副泥鳅雄核单倍体的早期发育[J]. 动物学报,46(3):353-356. [Zhao Z S,Wu Q J,Liu H Y,Gao G Q. 2000. Observation on the early development of angrogenetic haploid in Paramisgurnus dabryanus[J]. Acta Zoologica Sinica,46(3):353-356.]
朱佳杰,李莉萍,甘西,唐瞻楊,谢尔登,林勇,陈忠,黄姻,罗永巨. 2012. 温度诱导对吉富罗非鱼雄性率的影响[J]. 安徽农业科学,40(2):830-831. [Zhu J J,Li L P,Gan X,Tang Z Y,Xie E D,Lin Y,Chen Z,Huang Y,Luo Y J. 2012. Effect of temperature induction on male rate of genetically improved farmed tilapia[J]. Journal of Anhui Agricultural Sciences,40(2):830-831.]
祝璟琳,邹芝英,杨弘,李大宇,肖炜,卫程亮. 2012. 甲基睾丸酮在尼罗罗非鱼(Oreochromis niloticus)肌肉中的代谢和消除规律研究[J]. 海洋与湖沼,43(5):1016-1022. [Zhu J L,Zou Z Y,Yang H,Li D Y,Xiao W,Wei C L. 2012. The metabolism and elimination of 17α-methyltestoste-rone in muscle of Nile tilapia Oreochromis niloticus[J]. Oceanologia et Limnologia Sinica,43(5):1016-1022.]
邹琴,陈培基,李刘冬,林伟强,陈挺,杨金兰,赵东豪,黎智广. 2010. 甲基睾丸酮在罗非鱼苗种体内的消解规律[J]. 水生生物学报,34(2):250-255. [Zou Q,Chen P J,Li L D,Lin W Q,Chen T,Yang J L,Zhao D H,Li Z G. 2010. Dissipation of 17α-methyltestosterone fed to Nile tilapia Oreochromis niloticus(L.) fry[J]. Acta Hydrobiologica Sinica,34(2):250-255.]
邹芝英,杨弘,李大宇. 2009. 罗非鱼性别决定和分化机制的研究进展[J]. 中国水产科学,16(1):139-145. [Zou Z Y,Yang H,Li D Y. 2009. Advances in sex determination and differentiation mechanisms of tilapia[J]. Journal of Fishery Sciences of China,16(1):139-145.]
Abucay J S,Mair G C,Skibinski D O F,Beardmore J A. 1999. Environmental sex-determination:The effect of temperature and salinity on sex ratio in Oreochromis niloticus L.[J]. Aquculture,173(1-4):219-234.
Baroiller J F,DCotta H. 2001. Environment and sex determination in farmed fish[J]. Comparative Biochemistry and Physiology. Toxicology & Pharmacology,130(4):399-409.
Barry T P,Marwah A,Marwah P. 2007. Stability of 17α-methyltestosterone in fish feed[J]. Aquaculture,271(1-4):523-529.
Brzeski V J,Doyle R W. 1995. A test of an on-farm selection procedure for tilapia growth in Indonesia[J]. Aquaculture,137(1-4):219-230.
Eknath A E,Tayamen M M,Palada-de Vera M S,Danting J C,Reyes R A,DIonisib E E,Capili J B,Bolivar H L,Abella T A,Circa A V,Bentsen H B,Gjerde B,Gjedrem T,Pullin R S V. 1993. Genetic improvement of farmed tilapias:The growth performance of eight strains of Oreochromis niloticus tested in different farm environments[J]. Aquaculture,111(1-4):171-188.
El-Greisy Z A,El-Gamal A E. 2012. Monosex production oftilapia,Oreochromis niloticus using different doses of 17α- methyltestosterone with respect to the degree of sex stability after one year of treatment[J]. The Egyptian Journal of Aquatic Research,38(1):59-66.
Gjedrem T. 2000. Genetic improvement of cold-water fish species[J]. Aquaculture Research,31(1):25-33.
Green B W,Teichert-Coddington D R. 2000. Human food safety and environmental assessment of the use of 17α-methyltestosterone to produce male tilapia in the United States[J]. Journal of the World Aquaculture Society,31(3):337-357.
Grjederm T. 1979. Selection for growth rate and domestication in Atlantic salmon[J]. Journal of Animal Breeding and Genetics,96(1-4):56-59.
Hussain M G. 2004. Farming of tilapia:Breeding plans,mass seed production and aquaculture techniques[M].Dhaka: Habiba Akter Hussain.
Khaw H L,Ponzoni W R,Danting C J. 2008. Estimation of genetic change in the GIFT strain of NILE tilapia(Oreochromis niloticus) by comparing contemporary progeny produced by males born in 1991 or in 2003[J]. Aquaculture,275(1-4):64-69.
Ponzoni W R,Nguyen N H,Khaw H L,Hamzah A,Abu-Bakar K R,Yee H Y. 2011. Genetic improvement of NILE tilapia(Oreochromis niloticus) with special reference to the work conducted by the World Fish Center with the GIFT strain[J]. Reviews in Aquaculture,3(1):27-41.
(責任编辑 兰宗宝)
