鸭ChREBP基因表达载体构建及其对原代肝细胞和PC3细胞脂质性状的影响
2020-06-04谭光辉覃媛钰王单单李万贵罗华伦吴磊李杰章张依裕
谭光辉 覃媛钰 王单单 李万贵 罗华伦 吴磊 李杰章 张依裕

摘要:【目的】探究鴨原代肝细胞脂质含量与碳水化合物反应元件结合蛋白基因(ChREBP)表达的关联性,为深入研究ChREBP基因对畜禽脂质代谢的遗传调控机制提供参考依据。【方法】采用Ⅳ型胶原酶消化法分离孵化21 d的鸭胚原代肝细胞,以DMEM高糖培养基进行培养。利用RT-PCR扩增鸭ChREBP基因编码区(CDS)序列,构建携带His标签的真核表达载体pEGFP-N3-ChREBP-His,通过脂质体法分别转染鸭胚原代肝细胞和人前列腺癌细胞(PC3);采用His标签检测试剂盒检测ChREBP基因的表达量,以脂质指标测定试剂盒测定甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白(HDL)和低密度脂蛋白(LDL)的含量,并分析鸭胚原代肝细胞和PC3细胞中ChREBP基因表达与脂质指标含量的相关性。【结果】以构建的真核表达载体pEGFP-N3-ChREBP-His转染鸭原代肝细胞和PC3细胞均能发出绿色荧光,表明携带His标签的ChREBP基因能在鸭原代肝细胞和PC3细胞中表达。ChREBP基因表达量与鸭原代肝细胞和PC3细胞中的TG、TC和HDL含量均呈极显著正相关(P<0.01,下同),与LDL含量呈极显著负相关。【结论】以构建的真核表达载体pEGFP-N3-ChREBP-His转染鸭原代肝细胞和PC3细胞后均能发出绿色荧光,说明ChREBP基因表达对鸭原代肝细胞和PC3细胞中的脂质代谢作用机理相似,可促进细胞脂质累积。
关键词: 鸭;ChREBP基因;鸭原代肝细胞;PC3细胞;脂质代谢
Abstract:【Objective】To explore the relationship between lipid content and carbohydrate response element binding protein(ChREBP) gene expression in primary duck hepatocytes, so as to provide reference for further study of the genetic regulation mechanism of ChREBP gene on lipid metabolism in livestock and poultry. 【Method】Primary hepatocytes of 21-day-old duck embryos were isolated by type IV collagenase digestion and cultured in DMEM high glucose medium. The sequence of duck ChREBP gene coding region(CDS) was amplified by RT-PCR, and the eukaryotic expression vector pEGFP-N3-ChREBP-His with His tag was constructed and transfected into duck embryo primary hepatocytes and human prostate cancer cells (PC3) by liposome method. The expression of ChREBP gene was detected by His label detection kit, and the contents of triglyceride(TG), total cholesterol(TC), low density lipoprotein (LDL) and high density lipoprotein (HDL) were measured by lipid index assay kit. The correlation between ChREBP gene expression and lipid index content in primary duck embryo hepatocytes and PC3 cells was analyzed. 【Result】The constructed eukaryotic expression vector pEGFP-N3-ChREBP-His could emit green fluorescence in duck primary hepatocytes and PC3 cells, indicating that ChREBP gene with His tag could be expressed in duck primary hepatocytes and PC3 cells. The expression of ChREBP gene was very significantly positively correlated with the contents of TG, TC and HDL in primary duck hepatocytes and PC3 cells (P<0.01, the same below), and very significantly negatively correlated with the content of LDL. 【Conclusion】The constructed eukaryotic expression vector pEGFP-N3-ChREBP-His can emit green fluorescence after transfection into duck primary hepatocytes and PC3 cells, indicating that the mechanism of ChREBP gene expression on lipid metabolism in duck primary hepatocytes and PC3 cells is similar, which can promote cellular lipid accumulation.
0 引言
【研究意义】一直以来,家禽养殖均以生产高体重和高饲料转化率为目标,但随着社会的发展和人们生活水平的不断提高,还应考虑生产低体脂肪禽肉及改善禽肉营养价值以满足消费者的需求。人们的饮食习惯与其自身健康状况密切相关,膳食高胆固醇和高脂肪酸的食物会增加心血管疾病发病率,同时能引发癌症患病率(陈士巧,2014;马志敏和王吉云,2016)。已有研究表明,改善优化膳食脂肪的含量及组成是预防人群代谢性疾病的重要措施(Julibert et al.,2019),在能量平衡的条件下膳食适宜比例脂肪,可增加脂肪酸氧化及饮食介导的热量生成(夏娟,2016;Navidshad and Royan,2016)。因此,研究脂质代谢调控机制并改善家禽体内脂肪含量对满足消费者的膳食需求具有重要意义。【前人研究进展】碳水化合物反应元件结合蛋白(Carbohydrate response element binding protein,ChREBP)是糖脂代谢过程中的重要核转录因子,能直接调节肝脏糖酵解及脂肪合成,在畜禽肝脏的脂质合成和糖生成过程中发挥重要作用(Tang et al.,2016)。已有研究证实,ChREBP与丙酮酸激酶的葡萄糖反应元件及脂肪酸合成基因相结合而发挥其生物学功能,当机体内摄入过多碳水化合物时,ChREBP能诱导肝脏将多余的碳水化合物转化为三酰甘油,运送至肝脏外的脂肪组织中贮存(Osatomi et al.,1999)。ChREBP基因在啮齿类动物和哺乳类动物的肝脏、肾脏、小肠和脂肪组织表达量较高,在其他组织中的表达水平则相对较低;在动物机体中ChREBP的靶基因主要是参与糖酵解和脂质合成的一些酶类,其激活后可促进葡萄糖向脂质转化(刘长金等,2014;Iizuka et al.,2018)。同样,ChREBP能被蛋白磷酸酶(PP2A)诱导磷酸化,从而直接作用于DNA,然后协同SREBP-1诱导糖酵解及脂肪生成(Linden et al.,2018)。Jois等(2017)研究发现,肝脏ChREBP基因缺失能导致白色和棕色脂肪组织基因表达发生改变。此外,ChREBP在许多疾病的发展过程中发挥重要作用,如肝癌、肥胖症、糖尿病和胰岛素抵抗等疾病(Iizuka,2017;Sud et al.,2017)。ChREBP在膳食果糖的转运及转化为乳酸和葡萄糖的过程中也发挥关键作用,直接参与果糖转运、果糖分解和糖异生等(Oh et al.,2018)。ChREBP基因不仅是肥胖等疾病治疗的新靶点,还能介导系膜细胞的炎症反应和细胞凋亡,参与糖尿病肾病(DN)的发病机制(Jois et al.,2017;陆心雨等,2018;Niwa et al.,2018)。【本研究切入点】至今,有关家禽ChREBP基因在脂代谢方面的研究鲜见报道。【拟解决的关键问题】通过构建鸭ChREBP基因真核表达载体,转染鸭胚原代肝细胞,探究鸭原代肝细胞脂质含量与ChREBP基因表达的关联性;同时以鸭ChREBP基因真核表达载体转染人前列腺癌细胞(PC3),观测ChREBP基因表达对鸭原代肝细胞和PC3细胞脂質含量的效应是否一致,为深入研究ChREBP基因对畜禽脂质代谢的遗传调控机制提供参考依据。
1 材料与方法
1. 1 试验材料
产出7 d内的樱桃谷鸭种蛋来源于贵州大学动物科学院家禽试验场,熏蒸消毒后,在贵州省动物遗传育种与繁殖重点实验室进行恒温孵化(温度37.8 ℃,相对湿度65%~70%)。PC3细胞由高原山地动物遗传育种与繁殖教育部重点实验室保存提供;OPTI-MEM、胰酶、DMEM高糖培养基及其他常规试剂均购自生工生物工程(上海)股份有限公司;红细胞裂解液、抗支原体试剂和胎牛血清(FBS)购自美国Gibco公司;His标签检测试剂盒购自上海江莱生物科技有限公司;RT-PCR试剂盒、胶回收试剂盒、感受态细胞菌种、氨苄青霉素粉剂、卡那霉素粉剂、PCR产物克隆试剂盒、质粒提取试剂盒、pEGFP-N3载体、EcoR I和Kpn I限制性内切酶等购自TaKaRa公司;甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白(HDL)和低密度脂蛋白(LDL)检测试剂盒购自南京建成生物工程研究所;Thermo Fisher cDNA逆转录试剂盒、TRIzol试剂盒和Ⅳ型胶原酶购自Invitrogen公司。
1. 2 鸭胚原代肝细胞分离培养及PC3细胞培养
无菌条件下将孵化21 d的胚蛋弃蛋壳去除羊水等黏液,解剖取出鸭胚肝脏,双抗PBS清洗肝脏,以消毒处理的眼科剪剪碎肝脏组织,然后采用Ⅳ型胶原酶消化法分离鸭胚原代肝细胞,以DMEM高糖培养基进行培养(罗华伦等,2018)。对冻存于液氮中的PC3细胞进行复苏和铺板培养,贴壁长满后以0.25%胰蛋白酶进行消化,并接种至48孔板,置于5% CO2、37.0 ℃条件下进行培养。
1. 3 ChREBP基因扩增引物设计与合成
1. 4 肝脏总RNA提取及RT-PCR扩增
采用TRIzol法提取鸭胚肝脏总RNA,以2%琼脂糖凝胶电泳和核酸浓度检测仪NanoDrop 2000(美国NanoDrop公司)联合检测总RNA浓度,稀释至100 ng/μL备用。Thermo Fisher cDNA逆转录试剂盒逆转录合成cDNA,PCR反应体系50.0 μL:Es Taq Master Mixture(5 U/μL)20.0 μL,cDNA模板2.0 μL,上、下游引物各2.0 μL,RNase-free ddH2O 24.0 μL。扩增程序;95.0 ℃预变性10 min;95.0 ℃ 50 s,60.0 ℃ 50 s,72.0 ℃ 60 s,进行35个循环;72.0 ℃延伸10 min,-20.0 ℃保存。
1. 5 真核过表达载体pEGFP-N3-ChREBP-His构建
对PCR产物进行纯化回收,利用pUCm-T载体构建重组质粒pUCm-T-ChREBP,经双酶切鉴定、菌液PCR扩增及测序验证后,以EcoR I和Kpn I双酶切pEGFP-N3载体和重组质粒pUCm-T-ChREBP,回收目的片段,T4连接酶作用下将携带有EcoR I和Kpn I黏性末端的pEGFP-N3与ChREBP基因进行连接并转化DH5a感受态细胞,铺板培养18 h后挑取单菌落,再经摇床(37.0 ℃、200 r/min)培养14~16 h,提取真核表达载体pEGFP-N3-ChREBP-His,通过双酶切鉴定、菌液PCR扩增和测序分析进行验证,-80.0 ℃保存备用。
1. 6 重组质粒pEGFP-N3-ChREBP-His转染鸭原代肝细胞和PC3细胞
鸭原代肝细胞和PC3细胞各设9个处理组,每组均为3个重复,采用脂质体3000转染试剂盒将真核表达载体pEGFP-N3-ChREBP-His分别转染汇合度在70%和80%以上的鸭原代肝细胞和PC3细胞,转染48 h后倒置荧光显微镜观察鸭原代肝细胞和PC3细胞中是否发出荧光及真核表达载体pEGFP-N3-ChREBP-His的转染效率。
1. 7 鸭原代肝细胞和PC3细胞脂质性状测定及统计分析
以0.25%胰蛋白酶对转染48 h的鸭原代肝细胞和PC3细胞进行消化,采用血细胞计数板进行计数,调整为106/mL后进行离心沉淀和裂解,利用His标签检测试剂盒检测ChREBP基因的表达量;采用脂质指标测定试剂盒分别检测鸭原代肝细胞和PC3细胞中的TG、TC、HDL和LDL等4个脂质指标。使用Excel 2013整理数据,以SPSS 20.0进行相关分析。
2 结果与分析
2. 1 鸭原代肝细胞分离及培养效果
初分离获得的鸭原代肝细胞为圆形,透亮呈云雾状(图1-A),即分离效果良好。台盼蓝染色结果(图1-B)显示,鸭原代肝细胞活率较高,在85%以上;活细胞着色浅,晶莹透亮,死亡细胞则被染成蓝色,着色深。倒置显微镜下观察发现,接种培养12 h的鸭原代肝细胞出现少量细胞贴壁(图2-A),培养24 h后出现双核或多核结构(图2-B),说明贴壁细胞已开始增殖分裂,培养至48 h肝细胞贴壁状态良好(图2-C)。
2. 2 PC3细胞培养效果
将冷冻复苏的PC3细胞进行铺板培养,待其长满培养瓶,用胰蛋白酶消化并进行接种培养,培养12 h后PC3细胞开始出现贴壁状态,24 h后细胞体积逐渐扩大,贴壁状态的细胞逐渐增多(图3)。
2. 3 真核表达载体pEGFP-N3-ChREBP-His构建
以EcoR I和Kpn I双酶切pEGFP-N3载体和重组质粒pUCm-T-ChREBP,纯化回收携带黏性末端的目的片段,T4连接酶作用构建真核表达载体pEGFP-N3-ChREBP-His,经双酶切鉴定、菌液PCR扩增及测序验证,结果(图4)表明已成功构建获得真核表达载体pEGFP-N3-ChREBP-His。
2. 4 真核表达载体pEGFP-N3-ChREBP-His转染鸭原代肝细胞和PC3细胞的效果
鸭原代肝细胞(图5-A)和PC3细胞(图5-B)汇合度分别达70%和80%以上時,用真核表达载体pEGFP-N3-ChREBP-His进行转染,培养48 h后倒置荧光显微镜下观察其转染情况,结果显示,经真核表达载体pEGFP-N3-ChREBP-His转染后鸭原代肝细胞(图5-C)和PC3细胞(图5-D)均能发出绿色荧光,且效果良好,表明携带His标签的ChREBP基因能在鸭原代肝细胞和PC3细胞中表达。
2. 5 ChREBP基因表达与鸭原代肝细胞脂质性状的相关性
测定真核表达载体pEGFP-N3-ChREBP-His转染鸭原代肝细胞中的TG、TC、HDL和LDL等脂质指标含量及ChREBP基因表达量,结果显示在9个处理组中均能检测到4个脂质指标及ChREBP基因表达(表1)。相关分析结果表明,ChREBP基因表达量与TG、TC和HDL含量呈极显著正相关(P<0.01,下同),与LDL含量呈极显著负相关(表2),说明ChREBP基因表达对鸭原代肝细胞脂质沉积起调控作用。
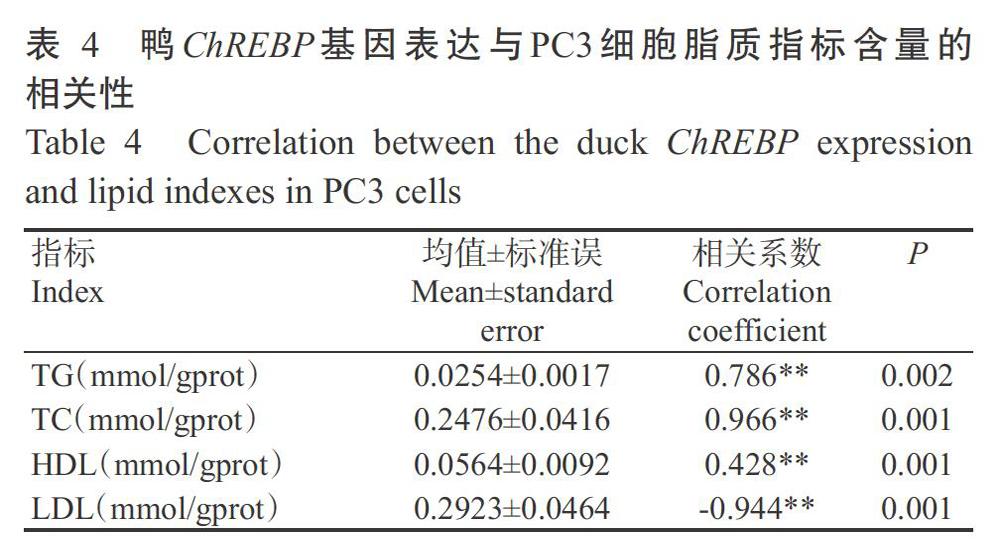
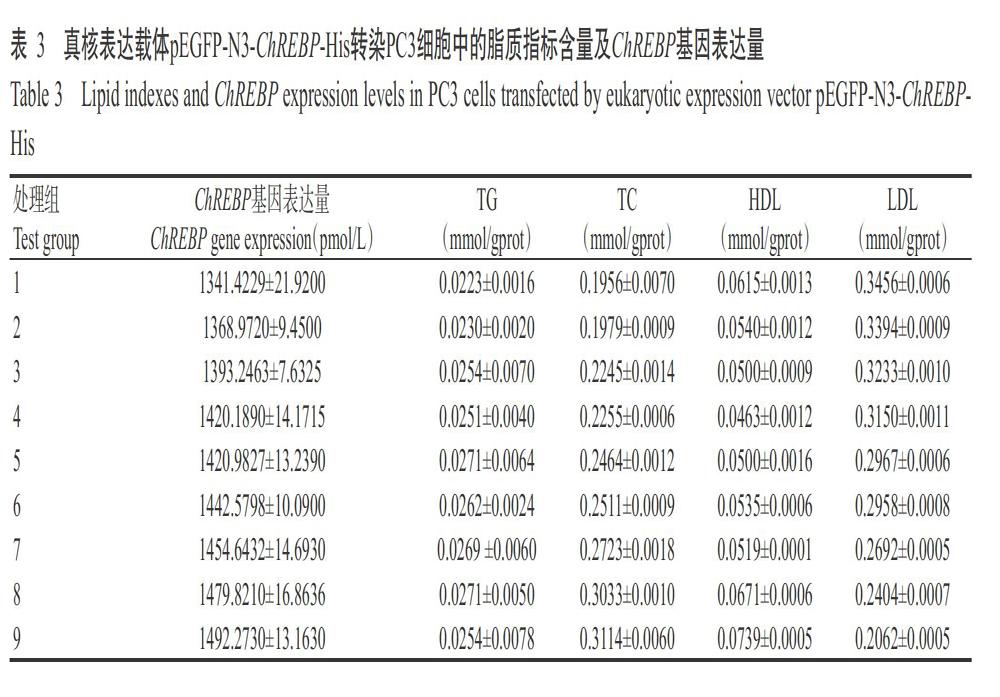
2. 6 ChREBP基因表达与PC3细胞脂质性状的相关性
由表3可知,在9个处理组中均能检测到4个脂质指标及ChREBP基因表达(表3)。相关分析结果表明,ChREBP基因表达量与PC3细胞中的TG、TC和HDL含量呈极显著正相关,与LDL含量呈极显著负相关(表4),揭示鸭ChREBP基因表达对PC3细胞中的脂质代谢有影响,且其影响机制可能与鸭原代肝细胞的相似。
3 讨论
肝脏糖脂代谢受到复杂的新陈代谢信号网络影响,胰岛素、胰高血糖素和肾上腺素等激素通过调节糖脂代谢相关酶的表达及其活性,而控制糖原生成和分解、脂肪酸合成和氧化的相互转换(Jones,2016)。ChREBP和肝脏X受体(LXR)是肝脏中脂肪生成转录调控的关键参与者,双敲除小鼠LXR能减少摄食诱导核O-连接的N-乙酰葡糖胺(O-GlcNAc)信号,从而减少脂肪沉积,即LXR在肝脏的葡萄糖利用与脂质合成中发挥重要作用(Fan et al.,2017)。ChREBP基因是肝脏和脂肪组织中脂肪生成的主要调节因子,且在多种细胞类型中作为响应环境和激素信号的中枢代谢协调器而发挥作用(Abdul-Wahed et al.,2017),对人类健康和疾病发生具有广泛的影响。Iizuka和Horikawa(2008)研究发现,ChREBP在脂质代谢中通过抑制脂肪酸氧化以降低血浆酮水平,可用于治疗非酒精性脂肪肝病(NAFLD)和高脂血症。ChREBP基因可通过防止胆固醇合成及ChREBP同源蛋白介导的促凋亡折叠蛋白反应而提供葡萄糖(Zhang et al.,2017);而小鼠肝细胞中胰岛素的新信号级联Pak1/MEK/ERK/Oct-1通过促进肝脏ChREBP产生以降低葡萄糖水平(Zeng et al.,2017)。此外,在1型糖尿病小鼠肾脏中发现胰岛素可上调糖尿病小鼠肾脏FAS和ChREBP基因的表达水平(王冰等,2016)。可见,ChREBP基因与葡萄糖及其引起的多种糖脂代谢疾病存在密切联系。
肝脏是碳水化合物和TG合成的主要场所,可将过量的碳水化合物转化为脂肪储存起来或供给机体能量。唐慧(2010)研究证实,对水禽鸭和鹅进行短期填饲碳水化合物如玉米可导致大量TG沉积于肝脏,即导致肝脂肪变性。TG具有供给和储存能源的功能,可固定和保护内脏。本研究以真核表达载体pEGFP-N3-ChREBP-His转染鸭原代肝细胞和PC3细胞后发现,ChREBP基因真核表达载体在PC3细胞中的表达量高于ChREBP基因,可能是PC3细胞的脂质代谢不同于正常细胞,在高速分裂和增殖过程中需要脂质装配细胞膜。相关分析结果表明,ChREBP基因的表达与TG、TC和HDL含量呈极显著正相关,与LDL含量呈极显著负相关,与Iizuka等(2018)的研究结果一致。LDL是一种运载胆固醇进入外周组织细胞的脂蛋白颗粒,当其过量时携带的胆固醇会积存在动脉壁上,而极易引起动脉硬化。HDL可将胆固醇转化为胆汁酸或直接通过胆汁从肠道排出,是一种抗动脉粥样硬化的血浆脂蛋白。本研究结果表明,ChREBP基因表達能增加TG合成酶类的转录活性,造成机体内脂肪酸代谢失衡,血液中脂类物质增加,促使肝脏胰岛素抵抗、脂肪变性及血脂异常等疾病的发生发展。Tong等(2009)、耿西林等(2016)研究表明,ChREBP基因表达异常是促进肝脏肿瘤的主要因素之一,且对结肠癌和肝癌的细胞糖酵解与脂肪酸合成起正调控效应;张明捷和陈寒蓓(2018)研究发现,特异性敲除小鼠肝细胞ChREBP基因后能明显改善其脂肪肝及胰岛素抵抗。说明ChREBP基因的敲除与变异对糖尿病和肿瘤等疾病有明显影响。本研究结果表明,鸭ChREBP基因表达对PC3细胞中的脂质代谢有影响,且其影响机制可能与鸭原代肝细胞的相似,即具有促进脂质代谢的作用。因此,在研究鸭ChREBP基因的遗传调控机制时,通过抑制ChREBP活性可防止高碳水化合物产生过多的脂肪沉积,为促进鸭肉品质改良提供参考。
4 结论
以构建的真核表达载体pEGFP-N3-ChREBP-His转染鸭原代肝细胞和PC3细胞后均能发出绿色荧光,说明ChREBP基因表达对鸭原代肝细胞和PC3细胞中的脂质代谢作用机理相似,可促进细胞脂质累积。
参考文献:
陈士巧. 2014. 癌症病人化疗后的饮食护理干预方法[J]. 内蒙古中医药,33(13):180-190. [Chen S Q. 2014. Dietary nursing intervention for cancer patients after chemotherapy[J]. Nei Mongol Journal of Traditional Chinese Medicine,33(13):180-190.]
耿西林,张煜,李晖,郑伟,张智勇,海军,杜立学. 2016. 碳水化合物反应元件结合蛋白在肝癌中表达与作用[J]. 中国普通外科杂志,25(7):1005-1010. [Geng X L,Zhang Y,Li H,Zheng W,Zhang Z Y,Hai J,Du L X. 2016. Expression of carbohydrate response element binding protein in hepatocellular carcinoma and its functions[J]. Chinese Journal of General Surgery,25(7):1005-1010.]
刘长金,刘磊,柯大智,林雪梅,姜蓉,胥文春,左国伟,王建伟. 2014. 高果糖引起的脂肪肝大鼠肾脏脂质合成相关基因和蛋白表达[J]. 中国细胞生物学学报,36(4):446-454. [Liu C J,Liu L,Ke D Z,Lin X M,Jiang R,Xu W C,Zuo G W,Wang J W. 2014. Renal lipid accumulation and expression of the proteins/genes responsible for fatty acid synthesis in rats with fatty liver induced by fructose overconsumption[J]. Chinese Journal of Cell Biology,36(4):446-454.]
陆心雨,陈希田,韦晓博,陈瑞瑶,刘斌,许娜. 2018. 胰岛β细胞中碳水化合物反应元件结合蛋白的研究进展[J]. 吉林医药学院学报,39(1):61-64. [Lu X Y,Chen X T,Wei X B,Chen R Y,Liu B,Xu N. 2018. Research progress of carbohydrate response element binding proteins in islet β cells[J]. Journal of Jilin Medical University,39(1):61-64.]
罗华伦,李万贵,张依裕,余蓉蓉. 2018. 鸭SCD1基因过表达对原代肝细胞脂质代谢的效应研究[J]. 农业生物技术学报,26(3):476-483. [Luo H L,Li W G,Zhang Y Y,Yu R R. 2018. Effects of duck(Anas platyrhynchos) SCD1 gene over-expression on lipid metabolism in primary hepatocytes[J]. Journal of Agricultural Biotechnology,26(3):476-483.]
马志敏,王吉云. 2016. 饮食与心血管疾病预防中的热点问题研究[J]. 中国全科医学,19(36):4423-4427. [Ma Z M,Wang J Y. 2016. Analysis of hot issues in diet and prevention of cardiovascular disease[J]. Chinese General Practice,19(36):4423-4427.]
唐慧. 2010. 鵝ChREBP基因克隆及其在肝脂肪变性中的作用初步研究[D]. 雅安:四川农业大学. [Tang H. 2010. Goose ChREBP gene cloning and the role of ChREBP in hepatic steatosis[D]. Yaan:Sichuan Agrieultural University.]
王冰,程丽静,刘明川,高政南. 2016. 脂肪酸合成酶和碳水化合物反应元件结合蛋白在1型糖尿病小鼠肾脏的表达及胰岛素对其的调节作用[J]. 中国糖尿病杂志,24(1):64-68. [Wang B,Cheng L J,Liu M C,Gao Z N. 2016. Expression of fatty acid sythase and carbohydrate responsive element binding protein in kidney of type 1 diabetic mouse and its regulation by insulin[J]. Chinese Journal of Diabetes,24(1):64-68.]
夏娟. 2016. 能量平衡状态下膳食脂肪供能比与肥胖相关指标的关系研究[D]. 北京:中国疾病预防控制中心. [Xia J. 2016. The relationship between the proportion of energy from dietary fat and the indexes related to obesity on ener-gy balance status[D]. Beijing: Chinese Center for Disease Control and Prevention.]
张明捷,陈寒蓓. 2018. 转录因子碳水化合物反应元件结合蛋白研究进展[J]. 中国疗养医学,27(8):800-805. [Zhang M J,Chen H B. 2018. Research development of carbohydrate response element binding protein[J]. Chinese Journal of Convalescent Medicine,27(8):800-805.]
Abdul-Wahed A,Guilmeau S,Postic C. 2017. Sweet sixteenth for ChREBP:Established roles and future goals[J]. Cell Metabolism,26(2):324-341.
Fan Q,N?rgaard R C,Bindesb?ll C,Lucas C,Dalen K T,Babaie E,Itkonen H M,Matthews J,Nebb H I,Gr?nning-Wang L M. 2017. LXRα regulates hepatic ChREBPα activity and lipogenesis upon glucose,but not fructose fee-ding in mice[J]. Nutrients,9(7). doi: 10.3390/nu9070678.
Jois T,Chen W,Howard V,Harvey R,Youngs K,Thalmann C,Saha P,Chan L,Cowley M A,Sleeman M W. 2017. Deletion of hepatic carbohydrate response element bin-ding protein(ChREBP) impairs glucose homeostasis and hepatic insulin sensitivity in mice[J]. Molecular Metabolism,6(11):1381-1394.
Jones J G. 2016. Hepatic glucose and lipid metabolism[J]. Dia-betologia,59(6):1098-1103.
Julibert A,Bibiloni M D M,Tur J A. 2019. Dietary fat intake and metabolic syndrome in adults:A systematic review[J]. Nutrition, Metabolism,and Cardiovascular Diseases,29(9):887-905.
Iizuka K. 2017. The transcription factor carbohydrate-response element-binding protein(ChREBP):A possible link between metabolic disease and cancer[J]. Biochimica et Biophysica Acta,1863(2):474-485.
Iizuka K,Horikawa Y. 2008. ChREBP:A glucose-activited transcription factor invovled in the development of metabolic syndrome[J]. Endocrine Journal,55(4):617-621.
Iizuka K,Takao K,Kato T,Horikawa Y,Takeda J. 2018. ChREBP reciprocally regulates liver and plasma triacylglycerol levels in different manners[J]. Nutrients,10(11). doi: 10.3390/nu10111699.
Linden A G,Li S,Choi H Y,Fang F,Fukasawa M,Uyeda K,Hammer R E,Horton J D,Engelking L J,Liang G. 2018. Interplay between ChREBP and SREBP-1c coordinates postprandial glycolysis and lipogenesis in livers of mice[J]. Journal of Lipid Research,59(3):475-487.
Navidshad B,Royan M. 2016. Effect of dietary fat on gene expression in poultry,a review[J]. Critical Reviews in Eukaryotic Gene Expression,26(4):333-341.
Niwa H,Iizuka K,Kato T,Wu W,Tsuchida H,Takao K,Horikawa Y,Takeda J. 2018. ChREBP rather than SHP regulates hepatic VLDL secretion[J]. Nutrients,10(3). doi: 10.3390/ nu10030321.
Oh A R,Sohn S,Lee J,Park J M,Nam K T,Hahm K B,Kim Y B,Lee H J,Cha J Y. 2018. ChREBP deficiency leads to diarrhea-predominant irritable bowel syndrome[J]. Metabolism,85:286-297.
Osatomi K,Hasegawa J,Wu R F,Uyeda K. 1999. A novel factor binding to the glucose response elements of liver pyruvate kinase and fatty acid synthase genes[J]. The Journal of Biological Chemistry,274(2):1100-1107.
Sud N,Zhang H,Pan K,Cheng X,Cui J,Su Q. 2017. Aberrant expression of microRNA induced by high-fructose diet:Implications in the pathogenesis of hyperlipidemia and hepatic insulin resistance[J]. The Journal of Nutritional Biochemistry,43:125-131.
Tang Y,Wallace M,Sanchez-Gurmaches J,Hsiao W Y,Li H,Lee P L,Vernia S,Metallo C M,Guertin D A. 2016. Adipose tissue mTORC2 regulates ChREBP-driven de novo lipogenesis and hepatic glucose metabolism[J]. Nature Communications,7:11365. doi: 10.1038/ncomms11365.
Tong X,Zhao F,Mancuso A,Gruber J J,Thompson C B. 2009. The glucose-responsive transcription factor ChREBP contributes to glucose-dependent anabolic synthesis and cell proliferation[J]. Proceedings of the National Academy of Sciences of the United States of America,106(51):21660-2166.
Zhang D,Tong X,van Dommelen K,Gupta N,Stamper K,Brady G F,Meng Z,Lin J,Rui L,Omary M B,Yin L. 2017. Lipogenic transcription factor ChREBP mediates fructose-induced metabolic adaptations to prevent hepatotoxicity[J]. The Journal of Clinical Investigation,127(7):2855-2867.
Zeng K,Tian L,Sirek A,Shao W,Liu L,Chiang Y T,Chernoff J,Ng D S,Weng J,Jin T. 2017. Pak1 mediates the stimulatory effect of insulin and curcumin on hepatic ChREBP expression[J]. Journal of Molecular Cell Biology,9(5):384-394.
(責任编辑 兰宗宝)
