一株拮抗放线菌的鉴定及其对香蕉枯萎病的生防效应
2020-06-04赖宝春戴瑞卿林明辉吴振强王家瑞
赖宝春 戴瑞卿 林明辉 吴振强 王家瑞


摘要:【目的】鑒定一株从健康辣椒根际土壤中分离获得的菌株(编号FX81),研究其防治植物病害和促进植物生长的潜能,为开发具有实用价值的香蕉枯萎病生防制剂及生物有机肥提供材料。【方法】采用平皿对峙法和菌丝生长速率法测定菌株FX81发酵液对13种病原真菌的抑菌活性及抑菌谱;将菌株FX81制成生物有机肥,利用菌剂根部穴施,评价其对香蕉植株的促生效果及对香蕉枯萎病的防治作用。通过形态学、生理生化特征及16S rDNA序列分析确定菌株FX81的分类地位。【结果】平皿对峙试验结果显示,菌株FX81对13种供试病原真菌均具有较好的拮抗作用,其中对香蕉枯萎病菌的抑制作用最强,抑菌带宽为13.1 mm;生长速率法测定结果显示,菌株FX81对香蕉枯萎病菌的抑制率为81.7%,对其他病原菌的抑制率为62.7%~80.8%,表明菌株FX81的抑菌谱较广。盆栽试验结果表明,施用生防菌剂FX81对香蕉有一定的促生作用,对香蕉枯萎病的防治效果达81.05%。综合菌株FX81的生理生化特征、培养特征及16S rDNA序列分析,鉴定菌株FX81为灰锈赤链霉菌(Streptomyces griseorubiginosus)。【结论】灰锈赤链霉菌FX81对香蕉枯萎病具有较好的防治效果,且对香蕉植株具有促生作用,在防治植物土传病害方面具有良好的开发前景。
关键词: 拮抗放线菌;灰锈赤链霉菌;分类鉴定;生防作用;香蕉枯萎病
Abstract:【Objective】A strain coded as FX81 from rhizosphere of healthy chilli plant was isolated and identified,its potential for controlling plant disease and promoting plant growth was analyzed to provide referencefor developing a biocotrol agent for banana fusarium wilt disease in banana and bio-organic fertilizers. 【Method】Flat-stand method and hyphal growth rate method were used to determine antibacterial activity and antimicrobial spectrum of strain FX81 fermentation liquid against 13 phytopathogens. A biofertilizer that contained strain FX81 was developed and applied to plant root and used to investigate the effects of strain FX81 on promoting growth of banana and controlling fusarium wilt in banana. Morphological, physiological and biochemistry characteristics and 16S rDNA sequence were used to identify the taxonomic status of strain FX81. 【Result】Results of flat-stand showed that the strain FX81 showed antibacterial effects on 13 plant pathogens. In addition, the antibacterial activity for against Fusarium oxysporum f.sp cubensewas the highest of all, the width of antibacterial band was 13.1 mm. Results of hyphal growth showed that the inhibition rate of strain FX81 to F. oxysporum was 81.7%, however the inhibition rate to the rest of pathogen was 62.7%-80.8%. It meaned that strain FX81 had broad antibiotic spectrum. The results of potted test showed that the mixture of the strain and organic fertilizer promoted the growth of banana, and the controlling efficiency on banana fusarium wilt was 81.05%. According to the results of morphological, physiological and biochemistry characteristics and 16S rDNA sequence, strain FX81 was identified as Streptomyces griseorubiginosus. 【Conclusion】S. griseorubiginosus FX81 is effective in biocontrolling wilt in banana caused by F. oxysporum and has growth promoting effects on banana plants. The findings demonstrate that the strain has potential value for soil-borne diseases controlling and preventing in the field.
0 引言
【研究意义】香蕉枯萎病是由尖孢镰刀菌古巴专化型(Fusarium oxysporum f. sp. cubense)侵染引起的毁灭性土传真菌病害(张志红等,2011)。目前世界上尚无防治香蕉枯萎病的特效药,生产上针对该病主要以种植抗病品种与施用药剂相结合,但种植的抗病品种存在抗病性状之外的其他经济性状丢失现象,如产量低、植株过高,香蕉果品味较差而无实际利用价值;大量使用化学药剂防治效果也不理想,易造成环境污染和生态失衡。因此,采用综合措施防控香蕉枯萎病尤为重要,利用活体微生物或其代谢产物防治香蕉枯萎病符合生态保护的发展趋势,但目前未见田间大面积试验并能成功防治香蕉枯萎病的实例,仍需筛选更多的生防菌并应用于生产实践。【前人研究进展】近年来,国内外学者在香蕉枯萎病生物防治方面开展了大量工作。Shen等(2015)研究发现,施用含解淀粉芽孢杆菌的有机肥能改变根际土壤微生物区系结构,显著提高土壤中细菌的多样性和降低尖孢镰刀菌的丰度,刺激产生大量的有益微生物,从而抑制香蕉枯萎病发生。王国芬等(2016)筛选到3株芽孢杆菌D7-16、A5-6和CL7,对香蕉枯萎病的防效分别为72.3%、45.4%和50.0%。张琳等(2016)研究了枯草芽孢杆菌TR21对粉杂1号香蕉枯萎病的防控效果,结果表明,TR21能降低粉杂1号香蕉枯萎病的发病率,增加单株产量,且能缩短粉杂1号的生育期。Wang等(2016)报道一株海洋解淀粉芽孢杆菌W19可产生促进植物生长的激素,在温室及大田条件下可促进香蕉生长,降低香蕉枯萎病的发病率。Fu等(2017)研究接种解淀粉芽孢杆菌有机肥与普通有机肥对患香蕉枯萎病植株根际土壤微生物的影响,结果表明,施用生物有机肥能显著增加根际土壤细菌的丰度,降低尖孢镰刀菌的丰度。田丹丹等(2018)从香蕉植株根部分离获得一株解淀粉芽孢杆菌GKT04,该菌对香蕉枯萎病菌的生长抑制率为33.33%,能降低香蕉枯萎病菌孢子萌发率,菌液灌根处理香蕉幼苗的枯萎病病情指数比对照降低49.23%。Khan等(2018)研究枯草芽孢杆菌30VD-1对香蕉枯萎病菌的抑菌机制,发现受抑制的香蕉枯萎病菌菌丝变形、肿胀,认为其几丁质酶、挥发物和其他抗真菌物质对枯萎病菌起到抑制作用。苏琴等(2019)筛选到一株绿头枝孢菌LS1,该菌对香蕉枯萎病具有明显的促生作用,盆栽试验结果表明LS1对香蕉枯萎病的防效为63.19%。徐志周等(2019)优化了一株对香蕉枯萎病具有较好抑制作用的伯克霍尔德菌,其抑菌率由优化前的9.18%提高至优化后的34.6%。叶乃玮等(2019)将3株木霉制成单剂或组合可湿性粉剂进行田间试验,两年的試验结果表明,组合木霉可湿性粉剂对香蕉枯萎病的防治效果分别为85.47%和89.73%。【本研究切入点】已报道拮抗香蕉枯萎病的生防菌株研究多集中在实验室抑菌阶段,盆栽试验试验设计中处理的病原菌以孢子液灌根或浸根为主,与田间自然发病的致病土存在较大差异,且施用拮抗菌剂以单剂为主,加之土壤环境因子复杂,导致盆栽防效较好的菌株在田间试验阶段防效并不理想。目前,将优良菌株制成生物有机肥,采用生物菌剂穴施及取田间致病土的方法进行香蕉枯萎病防治的研究报道较少。【拟解决的关键问题】以从福建省漳州市健康辣椒根际土壤中分离获得的一株对香蕉枯萎病菌有较强拮抗作用的菌株(编号FX81)为材料,病土取田间连作致病土,将拮抗菌制成生物有机肥,连续两年采用菌剂穴施根际的方法进行盆栽试验,评价菌株FX81对香蕉的促生作用及对枯萎病的防治效果,为开发具有实用价值的枯萎病生防制剂及生物有机肥提供材料。
1 材料与方法
1. 1 试验材料
拮抗菌株来源:分离自福建省漳州市平和县健康辣椒根际土壤(前茬作物为香蕉),编号FX81,保藏于福建省漳州市农业科学研究所。病原菌来源:香蕉枯萎病菌4号生理小种(F. oxysporum f. sp. cubense,Foc4)、蜜柚黑点病菌(Diaporthe citri)、西红柿枯萎病菌(F. oxysporum f. sp. lycopersici)、草莓根腐病菌(F.oxysporum)、蜜柚炭疽病菌(Colletotrichum gloeosporioides)、苦瓜枯萎病菌(F. oxysporum f. sp. momordicae)、蜜柚黑斑病菌(Phyllosticta citriasiana)、辣椒枯萎病菌(F. oxysporum f. sp. vasinfectum)和黄瓜枯萎病菌(F. oxysporum f. sp. cucurmerinum)由漳州市农业科学研究所分离,并经致病性测定、鉴定及保存;西红柿叶霉病菌(Fulvia fulva)、榕树炭疽病菌(C. gloeosporioides)、多肉黑斑病菌(Alternaria alternata)和兰花茎腐病菌(F. oxysporum)由福建省农业科学院植物保护研究所馈赠。
1. 2 试验方法
1. 2. 1 菌株FX81发酵液制备及其抑菌谱测定 将100 mL高氏一号液体培养基加入250 mL的三角瓶中,121 ℃高压灭菌30 min,待冷却后接入4 mm的菌饼5块,150 r/min、28 ℃下振荡培养7 d,得到的发酵液经8000 r/ min离心30 min,取上清液,-20 ℃冰箱保存备用。采用平皿对峙法(方羽生等,2001)和菌丝生长速率法(方中达,1998)对菌株FX81进行抑菌谱测定。
1. 2. 2 生防制剂制备 将优化好的猪粪与麦麸以质量比4∶6混匀装入250 mL三角瓶中,每瓶加发酵原料总量20 g,控制料水比为1∶0.8,调节pH 7.2~7.5,121 ℃灭菌20 min,即为固体发酵基质。按15%接种量接入菌株FX81发酵液,28 ℃培养,每天用无菌玻棒翻动2次,培养7 d,待瓶壁及固体培养基中长满菌丝,并散发出典型的“土腥味”,即完成固体菌剂发酵。
1. 2. 3 菌株FX81防治香蕉枯萎病盆栽试验
1. 2. 3. 1 供试香蕉组培苗 由漳州市农业科学研究所组培研究室提供,品种为威廉斯,待苗长至4~5片叶、株高13~15 cm时移栽到花盆(直径35 cm)中。
1. 2. 3. 2 试验设计 从漳州市南靖县连续20年种植香蕉且香蕉枯萎病发病率在75%以上的香蕉园取病土,试验前计数病土中尖孢镰刀菌的数量为2.1×104 CFU/g。试验设4个处理,处理1:病土+FX81固体发酵菌剂(20 g);处理2:病土+固体发酵基质(20 g);处理3:病土+与固体发酵基质营养成分相当的N、P、K化学肥料;对照:只用病土。试验结束后取香蕉根际土壤计数尖孢镰刀菌数量。采用稀释平板法计数(林先贵,2010),培养基采用Komada选择培养基(张绍升等,2011)。
固体发酵基质由猪粪与麦麸按质量比为4∶6制成,猪粪含0.50% N、0.60% P2O5、0.45% K2O及有机质18.25%;麦麸含2.10% N、2.52% P2O5、1.55% K2O及有机质40.20%。添加与2%固体发酵基质营养成分相当的N、P、K化学肥料于对照中作为处理3。每盆装致病土10 kg,每处理15盆,3次重复,每盆种植一株香蕉苗。待香蕉苗生长30 d,连根拔起计算生物量,评价促生效果。当对照香蕉植株发病严重时,剖开球茎,计算病情指数,评价抗病效果。试验重复2次,分别于2017年4月20日—7月10日和2018年4月15日—7月5日在福建省漳州市农业科学研究所试验大棚进行,正常管理。香蕉枯萎病内部症状病级分级标准(谢子四等,2009):1级,球茎不变色;2级,球茎不变色,但根与球茎交接处变色;3级,球茎变色面积占球茎的0~5%;4级,球茎变色面积占球茎的5%~20%;5级,球茎变色面积占球茎的20%~50%;6级,球茎变色面积占球茎的50%以上;7级,全部球茎变色、坏死;8级,植株枯死。统计病情指数和防治效果。
1. 2. 4 菌株FX81鉴定 形态特征观察:采用插片法,待菌丝长上盖玻片后,取菌丝生长适中的盖玻片置于光学显微镜(BPH-600Z,上海炳宇光学厂)下,观察菌株FX81的气生菌丝、基内菌丝、孢子丝和孢子的形态特征(方中达,1998)。
培养特征和生理生化特征:参照关统伟等(2015)的方法,进行菌株FX81的碳氮源利用、牛奶凝固、牛奶胨化、黑色素产生、纤维素分解、硝酸盐还原、明胶液化、色氨酸分解及硫化氢产生等生理生化特征鉴定。培养特征测定所用8种培养基见表4。
分子生物學鉴定:采用Ezup柱式细菌基因组DNA抽提试剂盒[生工生物工程(上海)股份有限公司],按照使用说明提取其基因组DNA,置于 -20 ℃冰箱保存备用。细菌通用引物参考宋利沙等(2018),27F:5'-AGAGTTTGATCMTGGCTCAG-3'和1492R:5'-TACGGYTACCTTGTTACGACTT-3',引物由生工生物工程(上海)股份有限公司合成。PCR反应体系25.0 μL:Taq PCR MasterMix 12.5 μL,DNA模板2.0 μL(100 ng/μL),10 μmol/L上、下游引物各1.0 μL,加ddH2O补足至25.0 μL;模板DNA用ddH2O代替作为阴性对照。扩增程序:94 ℃预变性4 min;94 ℃ 45 s,55 ℃ 45 s,72 ℃ 1 min,进行30个循环;72 ℃延伸10 min,4 ℃下保存。将扩增产物上样于含有GelRed染料的1%琼脂糖凝胶中电泳后回收目的条带,送至生工生物工程(上海)股份有限公司测序。测定的基因序列登录NCBI(www.ncbi.nlm.nih.gov)进行BLAST比对,并从GenBank数据库获得相关分离物的16S rDNA序列,使用MEGA 5.0的Neighbor-joining法构建系统发育进化树(王涵琦等,2014)。
2 结果与分析
2. 1 菌株FX81的抑菌谱测定结果
平皿对峙试验结果(表1)表明,菌株FX81对13种供试病原真菌均具有较好的拮抗作用,其中对香蕉枯萎病菌的抑菌带宽为13.1 mm,与其他病原菌的抑菌带宽差异极显著(P<0.01,下同),且随着培养时间的延长,菌丝出现退化现象(图1);对蜜柚黑斑病菌等6种病原菌的抑菌带宽度为12.1~12.7 mm;对兰花茎腐病菌等5种病原菌的抑菌带宽度为11.2~11.8 mm。生长速率法测定结果显示,菌株FX81对香蕉枯萎病菌的抑制率为81.7%,对其他病原菌的抑制率为62.7%~80.8%,且多次验证其抑菌效果稳定,说明菌株FX81的抑菌谱较广。
2. 2 菌株FX81对香蕉的促生及防病作用
2. 2. 1 菌株FX81对香蕉的促生效果 香蕉苗移栽30 d后,连根拔起5~6株健康香蕉植株进行生物量测定。结果(表2)显示,处理1、处理2和处理3对香蕉植株鲜重和株高均有促生效果,生防菌剂处理1的植株鲜重和株高均高于普通有机肥处理2和化学肥料处理3,三者对香蕉植株的促生效果表现为处理1>处理2>处理3,三者间对香蕉植株的促生效果差异极显著,且均与对照达极显著差异水平;其中,处理1、处理2和处理3的香蕉植株鲜重较对照分别提高50.35%、33.04%和15.19%,株高较对照分别提高80.56%、48.14%和24.08%。
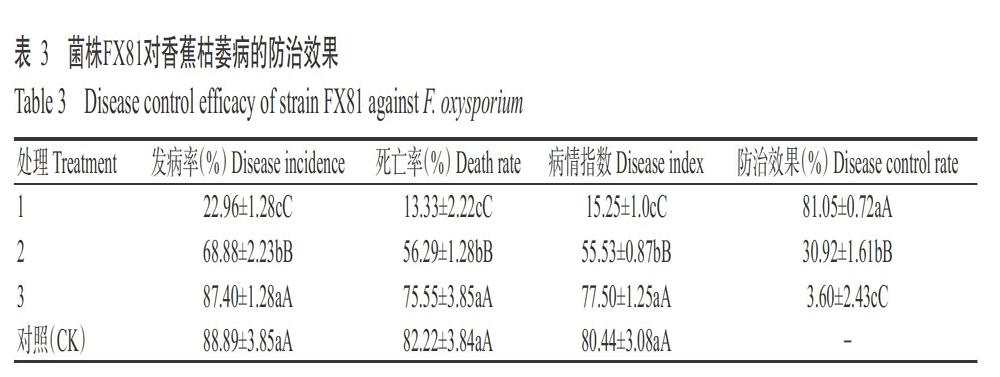
2. 2. 2 菌株FX81对香蕉枯萎病的生防效果 试验观察发现,香蕉苗移栽25 d后,只用病土的对照植株最先发病,发病部位从下部零星叶片开始黄化,逐渐向上部叶片扩展,后期整株黄化萎蔫,剖开球茎呈褐色腐烂,其次是处理3的植株发病,处理2和处理1最后发病,记录并观察至60 d,至对照植株发病严重时结束防效试验。
发病后第60 d统计4个处理香蕉的发病率、死亡率、病情指数和防治效果。结果(表3)显示,对照、处理3、处理2和处理1香蕉植株的病情指数分别为80.44、77.50、55.53和15.25,发病率和死亡率均逐渐降低,以处理1的防治效果最好,为81.05%,其次为处理2(30.92%),各处理间防治效果差异极显著。从表3结果可看出,施用生防菌剂FX81能显著降低香蕉枯萎病的发病率。
2. 2. 3 香蕉盆栽土壤中尖孢镰刀菌数量动态 尖孢镰刀菌在土壤中的数量与香蕉枯萎病的发生及严重程度密切相关。盆栽试验结束后,取各处理土壤测定尖孢镰刀菌数量,试验前计数致病土中尖孢镰刀菌的数量为2.1×104 CFU/g,试验后对照处理根际土壤尖孢镰刀菌的数量增加至3.8×105 CFU/g ,普通有机肥处理(处理2)和生防菌剂处理(处理1)的根际土壤尖孢镰刀菌数量变化不明显,分别为7.6×104和1.3×104 CFU/g,说明施用有机肥和生防菌剂均可减少根际土壤中病原菌的数量。
2. 3 菌株FX81的分类鉴定结果
2. 3. 1 菌株FX81的形态特征 在高氏一号培养基上,菌株FX81生长茂盛,菌落光滑、类圆形,中心凸起,浅黄色,培养至第3 d孢子丝开始从菌落边缘长出,初为白色,并逐渐转为灰白色。在显微镜下观察,气生菌丝和孢子丝均生长丰茂,高度分枝;无横隔,不断裂,孢子丝直或曲线形(图2-A,图中箭头为直线型分枝的孢子丝,时常不规则),孢子丝分化形成椭圆形的分生孢子(图2-B),分生孢子大小为0.70~0.85 ?m×0.90~1.05 ?m。
2. 3. 2 菌株FX81的生理生化特征及培养特性 在8种测试培养基上,菌株FX81培养1~2 d后形成菌落,培养3~4 d后产生孢子。菌株FX81在各培养基上的生长情况、基内菌丝颜色、孢子堆颜色、产生的色素均有差别,在大多数培养基上,菌株FX81能产生可溶性色素,气生菌丝由白色变为淡粉色或粉红白色,基内菌丝为黄粉红色至黄棕色(表4)。菌株FX81的生理生化特征如表5所示。根据形态特征、培养特性及生理生化特征初步鉴定菌株FX81属于链霉菌属。
2. 3. 3 菌株FX81的16S rDNA序列分析结果 从菌株FX81中PCR扩增得到1条约1472 bp的条带。将16S rDNA序列提交至GenBank数据库,选取同源性较高的模式菌株,用MEGA 5.0构建系统发育进化树(图3),发现菌株FX81的16S rDNA序列与灰锈赤链霉菌[Streptomyces griseorubiginosus(NBRC 13047)]的遗传距离最近,相似性达100%。综合上述特征,将菌株FX81鉴定为灰锈赤链霉菌。
3 讨论
生物防治具有无毒、无残留及可利用资源丰富等优点,是植物病害防治的发展趋势。在农业生产上用于防治植物病害的抗生素大多由链霉菌属产生(张健等,2018;李晓春等,2019)。已有文献报道,灰锈赤链霉菌能产多种抗生素及抗真菌纯化合物(Amano et al.,2010;Smaoui et al.,2012);此外,灰锈赤链霉菌是拮抗植物根腐病菌的重要生防资源(何冬梅等,2016)。本研究结果表明,放线菌菌株FX81对香蕉枯萎病菌具有较强的抑制作用,该菌株最终鉴定为灰锈赤链霉菌,对供试的土传病害病原真菌均有较强的拮抗活性,但其是否可作为农用抗生素的新来源还需进一步探究。
针对香蕉枯萎病的生物防治,大多数学者主要集中于拮抗菌筛选及其对香蕉枯萎病菌的抑菌机理和单一菌剂防治效果研究。由于土壤环境因素复杂,单独使用单一的生防菌普遍存在防治效率低、效果不稳定等问题。将优良拮抗菌添加到有机肥中制成生物有机菌肥施于田间,是目前效果较显著的一种防控方法。张志红等(2010)通过盆栽试驗比较堆肥、生物有机肥和生物复混肥对粉蕉的促生和防病效果,结果表明生物有机肥效果最佳,能促进粉蕉生长,其防病效果为61.5%。桂莎等(2019)研究发现,盆栽香蕉施用复合真菌制剂可显著降低香蕉枯萎病的病情指数,增加细菌和真菌群落的丰度和多样性,显著减少病原菌的数量,增强植株的抗病能力。周洁琼等(2019)利用生物菌肥进行大田试验,结果表明菌肥能使香蕉植株健壮,且能降低病情指数。本研究的拮抗放线菌FX81可直接抑制香蕉枯萎病菌及其他土传病菌的生长蔓延,将其制作成生物有机肥不仅能促进香蕉植株生长,还能降低土壤中尖孢镰刀菌的数量,且盆栽试验病土为本地多年连作的致病香蕉园土壤,更接近生产实际。试验方法采用香蕉苗根际穴施生物有机肥,有利于拮抗菌聚集于香蕉根际周围繁殖,更好保护香蕉根系免受病原菌的侵染,连续两年试验的防治效果均在80.00%以上,说明FX81生物有机肥对香蕉枯萎病的防治效果稳定。下一步将对FX81生物有机肥进行田间验证,对其在有机肥中的保质期及香蕉不同生长时期的施用进行深入研究。至今未见利用灰锈赤链霉菌对植物病害进行生物防治的研究报道,但已报道的灰锈赤链霉菌能产生多种抗菌物质。本研究发现拮抗放线菌FX81与有机物质制成复合微生物有机肥,既具有促进香蕉植株生长及防病的作用,还可调节土壤微生物群落结构,减少病原菌数量,创造有利于植株生长的生态环境。因此,该菌株作为生物有机肥的材料具有良好的开发潜力。
4 结论
菌株FX81对香蕉枯萎病菌具有较强的抑制作用,经鉴定为灰锈赤链霉菌(S. griseorubiginosus),将其制成生物有机肥对香蕉枯萎病的防治效果达81.05%,且对香蕉植株具有促生作用,表明该菌株在防治植物土传病害方面具有良好的开发前景。
参考文献:
方羽生,杨卫华,张洪玲,刘琼光,黄华林,赵军,卓侃,丘麒. 2001. 放线菌对4种病原真菌的拮抗作用初探[J]. 广东农业科学,(5):39-41. [Fang Y S,Yang W H,Zhang H L,Liu Q G,Huang H L,Zhao J,Zhuo K,Qiu Q. 2001. Antagonism of the Actinomycete on four pathogenic fungi and controlling trial[J]. Guangdong Agricultural Scien-ces,(5):39-41.]
方中达. 1998. 植病研究方法[M]. 第3版. 北京:中国农业出版社:243-250. [Fang Z D. 1998. Methodology for plant pathology[M]. The 3rd Edition. Beijing:China Agriculture Press:243-250.]
关统伟,张小平,Radhey S G,高贝乐,唐蜀昆,张玉琴,秦盛,刘松青,陈祥贵,赵珂,袁永俊,杨玲玲,张芸娇. 2015. 放线菌系统分类技术[M]. 北京:化学工业出版社:70-81. [Guan T W,Zhang X P,Radhey S G,Gao B L,Tang S K,Zhang Y Q,Qin S,Liu S Q,Chen X G,Zhao K,Yuan Y J,Yang L L,Zhang Y J. 2015. Classification technology of Actinomycetes[M]. Beijing:Chemical Industry Press:70-81.]
桂莎,刘芳,张立丹,樊小林. 2019. 复合菌剂防控香蕉枯萎病的效果及其微生物学机制[J]. 土壤学报,DOI:10.11766/trxb201904180111. [Gui S,Liu F,Zhang L D,Fan X L. 2019. Effects of complex anti-fungal agents biocontrolling fusarium wilt on banana and its microbiological mechanism[J]. Acta Pedologica Sinica,doi:10.11766/trxb201904180111.]
何冬梅,林嬋春,严铸云,李佳穗,王海,刘薇,马云桐. 2016. 川芎内生放线菌的分离及根腐病拮抗菌株的筛选[J]. 中药材,39(2):265-269. [He D M,Lin C C,Yan Z Y,Li J S,Wang H,Liu W,Ma Y T. 2016. Isolation and identification of antagonistic endophytic actinomycetes against root rot disease in Ligusticum chuanxiong[J]. Journal of Chinese Medicinal Materials,39(2):265-269.]
李晓春,王泽昊,于志国,席雪冬. 2019. 番茄灰霉病菌拮抗稀有放线菌的分离及其抑菌物质分析[J]. 河南农业科学,48(2):83-90. [Li X C,Wang Z H,Yu Z G,Xi X D. 2019. Isolation of antagonistic rare actinomycetes against
Botrytis cinerea and analysis of antifungal substances[J].
Journal of Henan Agricultural Sciences,48(2):83-90.]
林先贵. 2010. 土壤微生物研究原理与方法[M]. 北京:高等教育出版社:37-38. [Lin X G. 2010. Principles and methods of soil microbiology research[M]. Beijing:Higher Edu-cation Press:37-38.]
宋利沙,蒋妮,缪剑华,蓝祖栽. 2018. 肿节风炭疽病拮抗细菌的筛选与鉴定[J]. 植物保护,44(6):61-65. [Song L S,Jiang N,Miao J H,Lan Z Z. 2018. Screening and identification of the bacteria antagonistic to Colletotrichum dematium of Sarcandra glabra[J]. Plant Protection,44(6):61-65.]
苏琴,谢玲,陈艳露,廖仕同,张艳,农倩. 2019. 香蕉枯萎病生防菌绿头枝孢菌LS1的筛选鉴定[J]. 微生物学通报,46(12):3248-3256. [Su Q,Xie L,Chen Y L,Liao S T,Zhang Y,Nong Q. 2019. Screen and identification of biocontrol strain Cladosporium chlorocephalum LS1 against banana Fusarium wilt[J]. Microbiology China,46(12):3248-3256.]
田丹丹,周维,覃柳燕,韦莉萍,龙盛风,李朝生,黄素梅,韦 弟,韦绍龙. 2018. 香蕉枯萎病拮抗内生细菌的分离鉴定及防治效果初探[J]. 热带作物学报,39(10):2007-2013. [Tian D D,Zhou W,Qin L Y,Wei L P,Long S F,Li C S,Huang S M,Wei D,Wei S L. 2018. Isolation,identification and control effect of antagonistic endophytic bacterium against fusarium wilt[J]. Chinese Journal of Tropical Crops,39(10):2007-2013.]
王国芬,汪军,曹智淳,杨腊英,郭立佳,丁兆建,梁昌聪,刘磊,黄俊生. 2016. 芽胞杆菌对香蕉枯萎病的防效评价[J]. 中国农学通报,32(25):102-109. [Wang G F,Wang J,Cao Z C,Yang L Y,Guo L J,Ding Z J,Liang C C,Liu L,Huang J S. 2016. Control effect of Bacillus against banana fusarium wilt[J]. Chinese Agricultural Science Bulletin,32(25):102-109.]
王涵琦,畅涛,杨成德,陈秀蓉. 2014. 马铃薯炭疽病(Colletotrichum coccodes)拮抗菌株的筛选及鉴定[J]. 植物保护,40(1):38-42. [Wang H Q,Chang T,Yang C D,Chen X R. 2014. Screening and identification of the antagonistic organisms against Colletotrichum coccodes on potato[J]. Plant Protection, 40(1):38-42.]
谢子四,张欣,陈业渊,罗石荣,魏守兴. 2009. 10份香蕉种质对枯萎病的抗性评价[J]. 热带作物学报,30(3):362-364. [Xie Z S,Zhang X,Chen Y Y,Luo S R,Wei S X. 2009. Assessment of banana germplasm for resistance to fusarium wilt[J]. Chinese Journal of Tropical Crops,30(3):362-364.]
徐志周,王明元,杜锦鹏,刘建福,欧树文,秦紫艺,杨可然. 2019. 一株香蕉枯萎病拮抗菌 HQB-1的分离鉴定及其发酵条件优化[J]. 微生物学通报,46(7):1611-1618. [Xu Z Z,Wang M Y,Du J P,Liu J F,Ou S W,Qin Z Y,Yang K R.2019. Isolation,identification and fermentation optimization of an antagonistic bacterial strain HQB-1 against banana wilt disease[J]. Microbiology China,46(7):1611-1618.]
叶乃玮,吴紫燕,干华磊,王承芳,毛玮力. 2019. 组合木霉菌制剂防治香蕉枯萎病的研究[J]. 中国果树,(2):64-67.[Ye N W,Wu Z Y,Gan H L,Wang C F,Mao W L. 2019. Study on the control of banana fusarium wilt with combined Trichoderma preparation[J]. China Fruits,(2):64-67.]
張健,曹成亮,蒋继宏,鞠秀云. 2018. 毛泡桐内生放线菌及根际放线菌的筛选、鉴定及代谢产物分析[J]. 江苏农业学报,34(4):775-782. [Zhang J,Cao C L,Jiang J H,Ju X Y. 2018. Screening,identification and metabolite analysis of actinomycetes isolated from Paulownia tomentosa and rhizosphere[J]. Jiangsu Journal of Agricultural Sciences,34(4):775-782.]
张琳,程萍,喻国辉,王燕. 2016. 枯草芽胞杆菌TR21防控粉杂1号香蕉枯萎病的效果和对根系抗性相关信号物质累积的影响[J]. 中国生物防治学报,32(5):627-634. [Zhang L,Cheng P,Yu G H,Wang Y. 2016. Effects of Bacillus subtilis strain TR21 application on Fenza No.1 (Musa spp. ABB) fusarium wilt morbidity and resistance-related signal substances accumulation in roots[J]. Chinese Journal of Biological Control,32(5):627-634.]
张绍升,肖顺,刘国坤. 2011. 香蕉枯萎病早期诊断和病原菌快速检测[J]. 中国热带农业,(6):55-56. [Zhang S S,Xiao S,Liu G K. 2011. Early diagnosis and rapid detection of pathogenic bacteria for banana wilt[J]. China Tropical Agriculture,(6):55-56.]
张志红,冯宏,肖相政,李华兴. 2010. 生物肥防治香蕉枯萎病及对土壤微生物多样性的影响[J]. 果树学报,27(4):575-579. [Zhang Z H,Feng H,Xiao X Z,Li H X. 2010. Influence of bio-fertilizers on control of banana wilt disea-se and soil microbial diversity[J]. Journal of Fruit Science,27(4):575-579.]
张志红,彭桂香,李华兴,蔡燕飞,张新明,赵兰凤. 2011. 生物肥与甲壳素和恶霉灵配施对香蕉枯萎病的防治效果[J]. 生态学报,31(4):1149-1156. [Zhang Z H,Peng G X,Li H X,Cai Y F,Zhang X M,Zhao L F. 2011. Efects on controlling banana fusarium wilt by bio-fertilizer,chitosan,hymexazol and their combinations[J]. Acta Ecolo-gica Sinica,31(4):1149-1156.]
周洁琼,邓筱艳,刘慧. 2019. 生物菌肥对香蕉枯萎病的防治效果研究[J]. 农业研究与应用,32(1):6-9. [Zhou J Q,Deng X Y,Liu H. 2019. Study on control efficiency of bacterial manure on banana Fusarium oxysporum[J]. Agricultural Research and Application,32(1):6-9.]
Amano S,Morota T,Kano Y K,Narita H,Hashidzume T,Yamamoto S,Mizutani K,Sakuda S,Furihata K,Takano-Shiratori H,Takano H,Beppu T,Ueda K. 2010. Promomycin,a polyether promoting antibiotic production in Streptomyces spp.[J]. The Journal of Antibiotics,63(8):486-491.
Fu L,Penton C R,Ruan Y Z,Shen Z Z,Xue C,Li R,Shen Q R. 2017. Inducing the rhizosphere microbiome by biofertilizer application to suppress banana Fusarium wilt disease[J]. Soil Biology and Biochemistry,104:39-48.
Khan N,Martínez-Hidalgo P,Ice T A,Maymon M,Humm E A,Nejat N,Sanders E R,Kaplan D,Hirsch A M. 2018. Antifungal activity of Bacillus species against Fusarium and analysis of the potential mechanisms used in biocontrol[J]. Frontiers In Microbiology,9:2363.
Shen Z Z,Ruan Y,Chao X,Zhang J,Li R,SHen Q R. 2015. Rhizosphere microbial community manipulated by 2 years of consecutive biofertilizer application associated with banana Fusarium wilt disease suppression[J]. Bio-logy and Fertility of Soils,51(5):553-562.
Smaoui S,Mathieu F,Elleuch L,Coppel Y,Merlina G,Karray-Rebai I,Mellouli L. 2012. Taxonomy,purification and chemical characterization of four bioactive compounds from new Streptomyces sp. TN256 strain[J]. World Journal of Microbiology and Biotechnology,28(3):793-804.
Wang B B,Shen Z Z,Zhang F G,Raza W,Yuan J,Huang R,Ruan Y Z,Li R,Shen Q R. 2016. Bacillus amyloliquefaciens strain W19 can promote growth and yield and suppress fusarium wilt in banana under greenhouse and field conditions[J]. Pedosphere,26(5):733-744.
(責任编辑 麻小燕)
