2019新型冠状病毒实验室检测与预防研究
2020-06-03钱扬会综述董建英审校
钱扬会 综述,董建英 审校
北京京都儿童医院:1.检验科;2.院办,北京 102200
2019年12月湖北省武汉市发现多起肺炎病例均诊断为冠状病毒性肺炎/肺部感染,后来发现这种新型肺炎存在人传人现象。国家卫生健康委员会将这种被2019新型冠状病毒(SARS-CoV-2)感染导致的新型冠状病毒肺炎(COVID-19)纳入法定传染病乙类管理,采取甲类传染病的预防、控制措施。目前,国内外医疗机构及学者对SARS-CoV-2诊疗及防控进行研究,取得了较多进展。本院作为北京市首批开设24 h发热门诊,并接收患儿的儿童医院,在疾病的诊疗及防控方面具有一定的经验。本文主要介绍SARS-CoV-2的生物学特性、致病特点、实验室检测与预防。
1 SARS-CoV-2概述
SARS-CoV-2属于冠状病毒科,形态为圆形、椭圆形或轻度多形性,直径为100~120 nm。人冠状病毒有两个血清型,即HcoV-229E和HcoV-OC43,是引起人呼吸道感染的重要病原体,人类20%的普通感冒由冠状病毒引起,儿童的冠状病毒感染发病率较低[1-2]。随着细胞培养和分子生物学技术的迅速发展,临床上对冠状病毒的认识也逐步深入。
2 SARS-CoV-2的分子生物学特征
2.1SARS-CoV-2的基因组结构 近期,国内外多个研究团队对SARS-CoV-2基因组进行研究,2020年1月22日,国家基因组科学数据中心正式发布SARS-CoV-2资源库。该库整合了WHO、中国疾病预防控制中心(CDC)、美国国家生物技术信息中心(NCBI)、全球流感序列数据库(GISAID)等机构公开发布的SARS-CoV-2基因组序列数据、元信息、学术文献、新闻动态、科普文章,通过对全基因组序列相似性比较和变异位点分析,获取SARS-CoV-2病毒株之间、SARS-CoV-2病毒株与严重急性呼吸综合征(SARS)冠状病毒以及与类SARS冠状病毒蝙蝠株之间的变异程度、变异区域、变异碱基的详细信息。经数据分析,SARS-CoV-2与2003年爆发的SARS病毒基因组序列相似度为80%,与2017年2月从国内的蝙蝠中采集到的Bat SARS-like coronavirus isolate bat-SL-CoVZC45基因组序列相似性最高,相似度为88%[3]。
2.2SARS-CoV-2病原学特点 SARS-CoV-2属于β属的新型冠状病毒,有包膜,颗粒呈圆形或椭圆形,为多形性,直径60~140 nm[2]。体外分离培养时,SARS-CoV-2在96 h左右即可在人呼吸道上皮细胞内发现,而在Vero E6和Huh-7细胞系中分离培养需要6 d。SARS-CoV-2在进化树上初步定位是β属,与ZC45、ZXC21具有很高的同源性[4]。
3 SARS-CoV-2 临床致病特点
基于目前的流行病学调查,COVID-19潜伏期为1~14 d,多为3~7 d,以发热、乏力、干咳为主要表现,少数患者伴有鼻塞、流涕、咽痛和腹泻等症状。重症患者多在发病1周后出现呼吸困难和(或)低氧血症,严重者快速进展为急性呼吸窘迫综合征、脓毒症休克、难以纠正的代谢性酸中毒,以及出血和凝血功能障碍等,值得注意的是重型、危重型患者病程中可表现为中低热,甚至无明显发热。轻型患者仅表现为低热、轻微乏力等,无肺炎表现[5]。
从目前病例情况看,多数患者预后良好,少数患者病情危重。老年人和有慢性基础疾病者预后较差。儿童病例症状相对较轻。
4 SARS-CoV-2 的检测方法
4.1标本的采集要求 (1)进行SARS-CoV-2感染标本采集的技术人员应经过生物安全培训(培训合格)和具备相应的实验技能,在标本采集过程中,采样人员需穿着个人防护装备(PPE)。(2)病例标本的采集由所在病区经过培训的医护人员或在专业人员指导下完成。(3)根据实验室检测工作的需要,可根据患者病程或研究需求多次采样。(4)每个病例必须采集呼吸道标本,重症病例优先采集下呼吸道标本(如支气管或肺泡灌洗液、肺组织活检标本等),可根据临床表现与采集标本的时间间隔决定采集。
4.2标本的采集种类 (1)上呼吸道标本:口咽拭子、鼻咽拭子、鼻咽抽取物、深咳痰液。(2)下呼吸道标本:呼吸道抽取物、支气管灌洗液、肺泡灌洗液、肺组织活检标本。(3)血清:应尽量采集急性期血清,建议使用真空采血管。
4.3标本的采集对象 (1)SARS-CoV-2感染疑似病例、疑似聚集性病例的患者。(2)其他需要进行SARS-CoV-2 感染诊断或鉴别诊断的患者。(3)其他需要进一步筛查检测的环境或生物材料(如溯源分析)。
4.4采集标本的包装 (1)标本采集后应在生物安全二级实验室生物安全柜内分装。(2)所有标本应放在大小适合的带螺旋盖、内有垫圈、耐冷冻的标本采集管里,拧紧,容器外注明标本编号、种类、姓名及采集日期。(3)将密闭后的标本放入大小合适的塑料袋内密封,每袋装1份标本。
4.5采集标本的运输 (1)SARS-CoV-2毒株或其他潜在感染性生物材料的运输包装分类属于A类,对应的联合国编号为UN2814,包装符合国际民航组织文件《危险品航空安全运输技术细则》分类包装要求。(2)环境标本属于B类,对应的联合国编号为UN3373,包装符合国际民航组织文件《危险品航空安全运输技术细则》的分类包装要求,通过其他交通工具运输的可参照以上标准包装。(3)SARS-CoV-2毒株或其他潜在感染性材料运输应按照《可感染人类的高致病性病原微生物菌(毒)种或样本运输管理规定》执行。
4.6采集标本的保存 用于病毒分离和核酸检测的标本应尽快进行检测,24 h内能检测的标本可置于4 ℃保存,24 h内无法检测的标本则应置于-70 ℃或以下保存(若无-70 ℃,则应置于-20 ℃暂存)。血清可在4 ℃存放3 d,可在-20 ℃以下长期保存。标本运送期间应避免反复冻融,并应设立专库或专柜单独保存标本。
4.7SARS-CoV-2实时荧光定量反转录PCR(RT-PCR)检测 参照《新型冠状病毒感染的肺炎实验室检测技术指南(第三版)》[6]和《新型冠状病毒实验室生物安全指南(第二版)》[7]进行检测。实时荧光定量RT-PCR检测所用分子检测引物与探针如下。
4.7.1靶标一(ORF1a/b) 正向引物(F):CCC TGT GGG TTT TAC ACT TAA;反向引物(R):ACG ATT GTG CAT CAG CTG A;荧光探针(P):5′-FAM-CCG TCT GCG GTA TGT GGA AAG GTT ATG G-BHQ1-3′。
4.7.2靶标二(N) 正向引物(F):GGG GAA CTT CTC CTG CTA GAA T;反向引物(R):CAG ACA TTT TGC TCT CAA GCT G;荧光探针(P):5′-FAM-TTG CTG CTG CTT GAC AGA TT-TAMRA-3′。
4.8检测结果的判读 阴性:无Ct值或Ct值为40。Ct值小于37,可报告为阳性。Ct值为37~40,建议重复试验,若重做结果Ct值小于40,扩增曲线有明显起峰,该标本判断为阳性,否则为阴性。
RT-PCR能够在不同的样品中测定SARS-CoV-2的基因物质。总的来说,现有的PCR方法特异度较高,但是灵敏度较低。这就意味着阴性的测试结果并不能排除患者SARS-CoV-2的感染。同时,由于缺乏实验室质量控制而导致的实验室样品污染,可能导致假阳性结果的出现。PCR结果可以辅助临床诊断评价,但是不能确诊或排除疾病。
到目前为止,医生只能进行一般的病毒测试,然后必须对基因组进行排序和翻译。设备齐全的大型实验室能够做到这一点,但对于规模较小的实验室存在一定困难。德罗斯滕是SARS病毒的共同发现者之一,他认为SARS-CoV-2 与SARS病毒关系密切,拥有SARS控制标本库存的实验室可以用其诊断SARS-CoV-2,从而缩短创建测试所需的时间[8]。
5 SARS-CoV-2的生物安全防护[9]
根据目前了解的SARS-CoV-2 的生物学特性、传播特性、致病性、临床资料等信息,考虑到SARS-CoV-2具有感染聚集性发病且有重症病例和死亡病例的特点,实验室检测应按照病原微生物危害程度分类中第二类病原微生物对SARS-CoV-2 进行管理。
5.1病毒的培养 指病毒的分离、培养、滴定、中和实验、活病毒及其蛋白的纯化、病毒冻干以及产生活病毒的重组实验等操作,利用活病毒或其感染细胞(或细胞提取物),不经灭活进行的生化分析、血清学检测、免疫学检测等操作视为病原培养。上述操作应在生物安全三级(BSL-3)实验室中进行。使用病毒培养物提取核酸,裂解剂或灭活剂的加入必须在与病毒培养等同条件的实验室或防护条件下进行。灭活后的病毒培养物可在BSL-2或 BSL-1实验室操作。
5.2动物感染实验 指以活病毒感染动物的实验,应在BSL-3实验室中进行操作。
5.3未经培养的感染性材料的操作 未经培养的感染性材料在采用可靠的方法灭活前进行病毒抗原检测、血清学检测、核酸检测、生物化学分析等操作,应在BSL-2实验室操作,但个人防护应参照BSL-3实验室的防护要求。
5.4灭活材料的操作 感染性材料或活病毒在采用可靠的方法灭活后可在BSL-1实验室操作。
5.5无感染性材料的操作 指针对确认无感染性材料的各种操作,包括但不限于无感染性的病毒DNA的操作,可在BSL-1实验室操作。
6 SARS-CoV-2感染期间实验室防控[9]
6.1人员的个人防护 (1)工作人员严格按照清洁区、缓冲区、污染区的人流走向进入实验室。(2)进入实验室前须穿戴好个人防护用品,至少应佩戴帽子、口罩、手套,穿着工作服、工作裤和工作鞋。(3)所有标本均应视为具有潜在传染性,须采取标准预防措施。(4)进入发热门诊或患者留观室、病区时穿戴防护用品程序见图1。(5)离开发热门诊或留观室、病区前脱防护用品程序见图2。

图1 人员穿戴防护用品及进入污染区程序图

图2 人员离开污染区及脱防护用品程序图
6.2实验操作的防护 (1)呼吸道来源标本的操作:呼吸道来源标本应留取至密闭容器,用密闭转运容器进行送检,标本核收后应立即转入二级生物安全柜,操作过程小心谨慎,防溢、洒、渗、漏,一旦发生溢、洒后按照消毒程序进行处置。(2)其他来源标本:在尚未明确非呼吸道来源标本是否具有传染性的情况下,应将所有类型标本视为具有潜在危险性。(3)微量采血做到一人一针一管一消,对每位患者采血前后均应洗手和(或)手消。(4)离心标本应在安全柜中打开,离心机应盖严盖子,标本离心后应静置5 min以上方可打开离心机盖,如发生标本管破裂、溢、洒,应立即关闭离心机盖,按照消毒程序进行处置。(5)流感病毒检测的咽拭子标本被接收后,应在安全柜中检测,检测完毕置于医疗废物盒中,并盖严盖子。(6)在现有实验室条件下严禁进行SARS病毒毒株的分离鉴定和保存。
6.3实验室的清洁与消毒
6.3.1空气清洁消毒 首选自然通风,保证室内外空气的流通。室内无人时使用紫外线灯照射消毒,每次照射不小于0.5 h,每天2~3次。
6.3.2物体表面、地面的清洁和消毒 实验室所有的物体表面、地面都应当进行清洁,受到病原微生物污染时,应当先清洁,再进行消毒。
实验室每天应使用500~1 000 mg/L的含氯消毒剂擦拭台面、地面和物体表面,每天至少2次,遇污染时随时消毒。
现阶段可定时用1 000 mg/L健之素溶液擦拭台面、地面、垃圾容器盒表面等。
6.3.3标本渗、漏、溢、洒的消毒 发生标本溢、洒、渗、漏后应立即用纸巾或抹布覆盖,用75%的乙醇溶液或1 500~2 500 mg/L的有效氯溶液由外向内倾倒,作用30 min以上,用镊子移去纸巾或抹布,用消毒液擦拭后再用清水擦拭。溢洒处应设置明显标识,防止其他人员靠近。
6.3.4手部的清洁与消毒 流动水洗手,方法为非手触式开关,方法为七步洗手法,每一步骤均为10 s,最后用清水冲净清洗剂。手部的消毒剂采用75%的乙醇溶液或70%的异丙醇或醇的复合制剂3~5 mL,按洗手方法搓揉1~2 min。
6.3.5防护用品的清洗与消毒 非一次性使用的防护用品,放入专用转运箱中,每周由专人送洗衣房进行清洗、消毒。防护眼镜可以用500~1 000 mg/L的含氯消毒剂消毒,采用0.2%的过氧乙酸溶液或75%的乙醇溶液浸泡30 min,清洗干燥后备用。
6.3.6实验器材的消毒与灭菌 非一次性使用的实验器材应进行121 ℃、20 min的压力蒸汽灭菌,不适用于压力蒸汽灭菌的物品可采用化学消毒法,可用75%的乙醇溶液浸泡作用15~30 min,干燥保存。
6.4医疗废物的处置
6.4.1医疗废物的收集 医疗废物应分类收集,并按照类别放置于防渗、防漏、防锐器的专用包装物或密闭的容器内。医疗废物专用包装物、容器,应有明显的中英文警示标识。
医疗废物收集容器应符合有关部门的要求,所有废物盛装量不应超过容器或包装袋的3/4。严禁使用有破损或已经污染的收集容器,见图3。
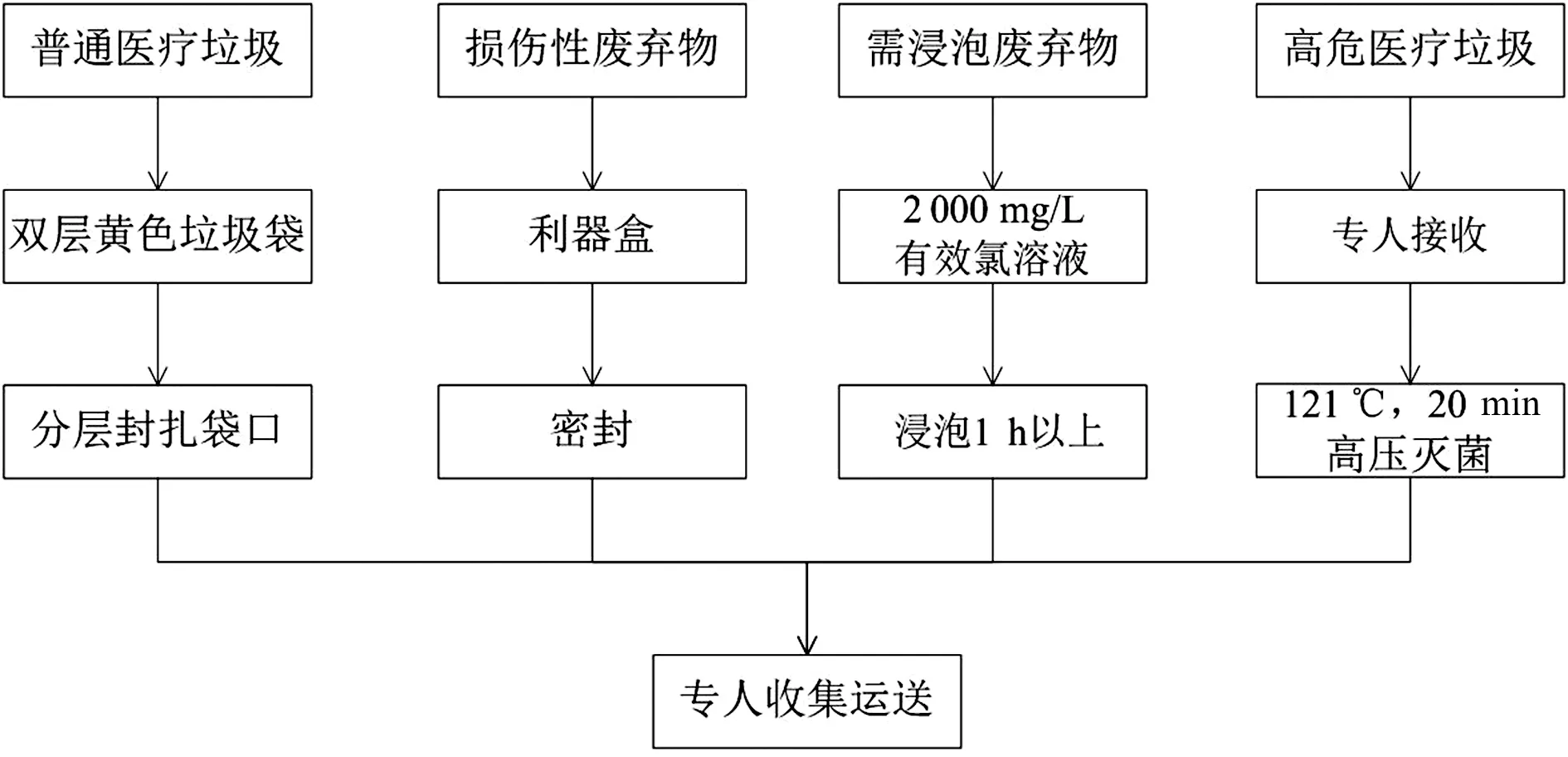
图3 医疗废物的收集流程图
6.4.2 医疗废物的转运 医疗废物应每日由专人使用专用转运工具,按照规定的时间、路线及时清运,就近转送到医院医疗废物专门暂存场
所,定期由医疗废物集中处置单位转运焚烧。运送工具、暂存场所等需及时清洁,遇污染时及时用1 000 mg/L的含氯消毒剂或0.2%的过氧乙酸溶液消毒。
对外运输的医疗废物必须做好交接工作,并认真记录,内容包括医疗废物的种类、数量、交接时间、集中处置单位以及经办人签名。登记资料至少保存两年。
