活动性类风湿关节炎患者单核细胞Toll样受体9表达及其临床意义
2020-06-03王绪山王敏李静陈开勇灌云县人民医院检验科江苏灌云222200
王绪山,王敏,李静,陈开勇(灌云县人民医院检验科,江苏灌云222200)
慢性炎症是类风湿关节炎(rheumatoid arthritis, RA)重要的发病机制,关节腔中浸润大量单核细胞等炎性细胞,导致患者关节腔滑膜异常增生、软骨和骨质破坏[1]。基于细胞表面CD14和CD16的表达情况,人类单核细胞可分为CD14++CD16-经典型、CD14+CD16+中间型和CD14lowCD16++非经典型,中间型和非经典型亚群被认为在RA等多种炎症、自身免疫病中发挥重要作用[2-3]。单核细胞表面表达Toll样受体9(Toll like receptor-9,TLR9),通过识别细菌/病毒等DNA的非甲基化胞嘧啶-磷酸-鸟嘌呤(CPG)、真核细胞线粒体DNA等配体,诱导单核细胞分泌炎性因子和趋化因子,发挥固有免疫应答的作用[4]。但TLR9在单核细胞亚群中的表达及其在RA疾病中的作用目前尚不明确。本研究通过流式细胞术检测RA患者外周血单核细胞TLR9表达,并通过非甲基化CPG活化TLR9,分析单核细胞分泌炎性细胞因子的变化,探讨单核细胞TLR9在RA疾病中的作用。
1 材料与方法
1.1研究对象 选择2018年1月—2019年2月在灌云县人民医院骨科就诊的活动性中重度RA患者32例,作为RA组,年龄(48.7±12.5)岁,男6例,女26例;纳入标准:符合2010年美国风湿病学会/欧洲风湿病联盟分类标准,未接受甲氨蝶呤或生物制剂治疗,DAS28-ESR疾病活动评分≥3.2分,3.2分
1.2仪器和试剂 Calibur流式细胞分析仪(美国BD公司),Luminex 200液相芯片检测系统(R&D公司),特定蛋白仪(德灵公司);异硫氰酸荧光素(FITC)-鼠抗人CD14单克隆抗体(mAb)、别藻青蛋白(APC)-鼠抗人TLR9 mAb、percpcy5.5-鼠抗人CD16 mAb及同型对照和红细胞裂解液(BD Biosciences公司),Ficoll-HyPaque分离液(上海西糖生物公司),RPMI-1640完全培养液(美国Gibco公司),非甲基化全链硫代修饰CpG-ODN 2006(上海生工公司),肿瘤坏死因子-α(TNF-α)、单核细胞趋化蛋白(MCP)-1和白细胞介素(IL)-6检测试剂(美国Bio-Rad公司)。
1.3方法
1.3.1标本采集 在空腹状态下抽取健康人对照者和RA患者静脉血6 mL置于肝素钠抗凝管中,其中1 mL用于流式细胞检测,其余5 mL用于分离单核细胞。RA患者有9例有关节腔积液,治疗前抽取积液4 mL,采用Ficoll密度梯度法分离积液单个核细胞,并用500 μL PBS重悬,用于流式细胞分析。
1.3.2流式细胞术检测单核细胞亚群及其表面TLR9 取肝素抗凝静脉血100 μL或PBS重悬的关节腔积液单个核细胞100 μL,加入10 μL FITC-鼠抗人CD14 mAb、10 μL percpcy5.5-鼠抗人CD16 mAb,避光反应30 min,1 000 r/min离心5 min,弃上清液,加入0.1%皂素500 μL破膜20 min。1 000 r/min离心5 min,弃上清液,加入10 μL APC-鼠抗人TLR9 mAb,避光反应30 min,然后加入500 μL红细胞裂解液,避光反应8 min,PBS洗涤后用400 μL PBS重悬,上流式分析仪检测。根据前向散射光和侧向散射光,外周血以单核细胞设门(关节液中细胞分散,以所有的细胞设门),检测CD14++CD16-经典型、CD14+CD16+中间型和CD14lowCD16++非经典型细胞比例,并检测各亚群细胞表面TLR9平均荧光强度(mean fluorescence intensity,MFI)。
1.3.3单核细胞分离和培养 采用Ficoll密度梯度法分离来自健康人志愿者和RA患者的外周血单个核细胞,用RPMI-1640完全培养液(含10%小牛血清、100 U/L链霉素、100 U/L青霉素)重悬,在24孔细胞培养板中贴壁2 h后,去除非贴壁细胞,加入RPMI-1640培养液继续培养4 h,收集单核细胞,取100 μL单核细胞,加入10 μL FITC-鼠抗人CD14 mAb,避光反应20 min,PBS洗涤后用400 μL PBS重悬,流式分析仪检测CD14阳性细胞比例,结果显示纯度>95%。
1.3.4细胞因子IL-6、TNF-α、MCP-1浓度检测 上述单核细胞经RPMI-1640培养液重悬,调整细胞浓度为1×104cells/mL,培养于24孔板,分2孔,其中1孔加入40 μg/mL CpG-ODN 2006,另1孔为空白对照,置于37 ℃、5%CO2培养箱培养48 h,收集上清液,储存于-80 ℃。用Luminex 200液相芯片检测上清液细胞因子IL-6、TNF-α、MCP-1浓度:取96孔板,每孔加50 μL交联待检细胞因子mAb的磁球,平放在磁铁板上5 min后弃上清液,然后每孔加50 μL样本和标准品,室温下振荡反应30 min,弃上清液,每孔加入亲和素标记的二抗25 μL,室温反应30 min,最后每孔加入50 μL PE标记的生物素,室温静置10 min后洗涤,Luminex 200检测系统检测样本的荧光强度,根据标准品的荧光强度计算各样本细胞因子浓度。每个样本检测3次,取均值。IL-6、TNF-α、MCP-1检测限分别为1.5 pg/mL、1.8 pg/mL和2.0 pg/mL。

2 结果
2.1RA患者外周血单核细胞亚群比例 以单核细胞设门(见图1A),根据CD14和CD16表达检测单核细胞亚群(见图1B)。与HC组相比,RA患者经典型单核细胞比例显著降低,中间型和非经典型单核细胞比例均显著上升,差异有统计学意义(P<0.05),结果见表1。
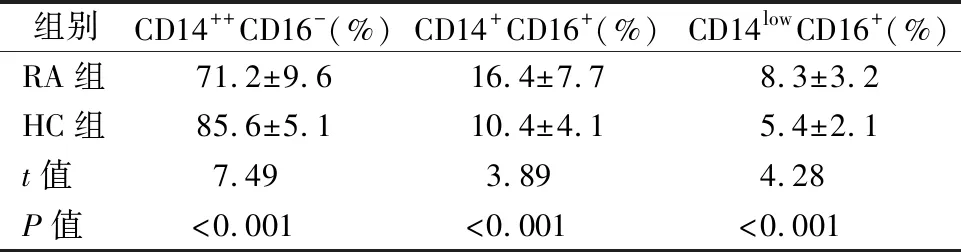
表1 外周血单核细胞亚群比例比较
2.2RA患者外周血单核细胞TLR9 MFI检测 与HC组相比,RA患者外周血3个单核细胞亚群TLR9 MFI均显著上升,差异有统计学意义(P<0.05),结果见图2、表2。
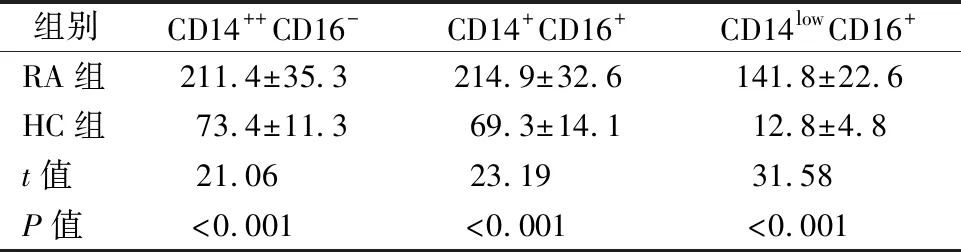
表2 外周血单核细胞亚群中TLR9平均荧光强度比较
2.3不同活动度RA患者外周血单核细胞亚群TLR9 MFI比较 高疾病活动度组与中疾病活动度组相比,单核细胞亚群TLR9 MFI表达均显著上升,差异有统计学意义(P<0.05)。见表3。
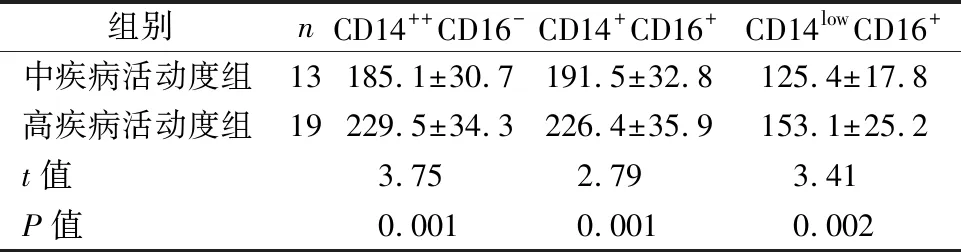
表3 不同活动度RA患者外周血单核细胞亚群TLR9 MFI
2.4RA患者关节腔积液单核细胞TLR9检测 RA患者关节腔积液单核细胞亚群比例分别为:经典型(60.6±9.1)%、中间型(31.1±6.4)%、非经典型(8.7±2.3)%;TLR9 MFI分别为:经典型309.6±32.4、中间型461.2±26.5、非经典型288.5±25.4。
2.5CPG活化的外周血单核细胞培养上清液细胞因子检测 与HC组活化后相比,RA患者组活化后上清液细胞因子浓度均显著上升,差异有统计学意义(P<0.05);与活化前相比,HC和RA组活化后上清液细胞因子浓度均显著上升,差异有统计学意义(P<0.05)。见表4。
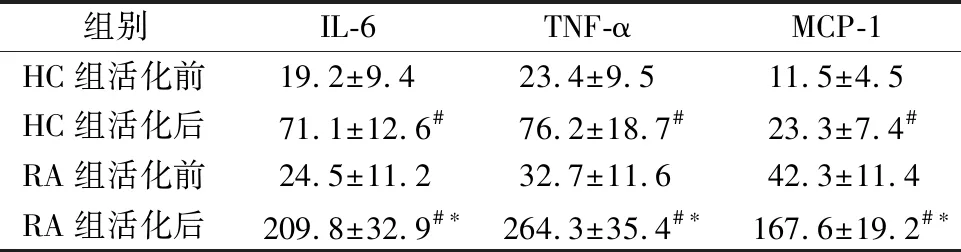
表4 CPG活化的单核细胞培养上清液细胞因子水平(pg/mL)
3 讨论
人类单核细胞CD14++CD16-经典型可产生高水平的活性氧(ROS)、IL-6和IL-8,迅速募集到炎症部位,吞噬清除病原体[6];CD14+CD16+中间型高表达HLA-DR,产生更高水平的活性氮物质(RNS)、IL-1β和TNF-α;而CD14dimCD16+非经典型参与巡逻血管内皮细胞对病毒和免疫复合物的反应[7]。早期研究表明RA患者外周血中CD14dimCD16+非经典型单核细胞增加[8],而最近研究表明外周血中CD14+CD16+中间型亚群的频率增加[9-10],且与疾病的严重程度显著相关。本研究结果表明RA患者外周血经典型亚群显著降低,中间型和非经典型显著上升。本研究还发现RA患者关节腔积液中存在较多的单核细胞,且中间型亚群比例高于外周血,表明这些细胞不断向炎症组织募集,参与参与关节腔炎症反应。
Kyburz等[11]研究表明TLR9信号传导抑制剂羟氯喹可抑制RA炎症的严重程度,其显著的治疗效果表明TLR9参与RA疾病过程。本研究在外周血和关节腔积液3个单核细胞亚群中均检测到TLR9的高表达,且高疾病活动度患者TLR9表达更显著,突显了单核细胞TLR9在RA疾病中的潜在作用。
RA患者血液中死亡细胞释放的含有非甲基化CpG重复序列的线粒体DNA、细菌/病毒等病原体DNA的非甲基化的CpG寡核苷酸均可作为TLR9内源性配体,活化激活丝裂原活化蛋白激酶p38和NF-κB信号通路,诱导细胞的固有免疫应答[12]。本研究证实,单核细胞经TLR9配体CpG-ODN 2006刺激后可分泌高浓度的IL-6、TNF-α和MCP-1。促炎细胞因子IL-6和TNF-α可刺激软骨细胞、破骨细胞、血管内皮、淋巴细胞、NK细胞和成纤维细胞的活化,从而直接介导滑膜增殖和损伤,并产生降解关节软骨基质的基质金属蛋白酶(MMP),导致RA中的骨吸收[13]。MCP-1是一种高效的趋化因子,参与炎症单核细胞的募集。以上结果表明,RA患者单核细胞高水平的TLR9参与促炎细胞因子或趋化因子IL-6、TNF-α和MCP-1的产生,参加RA疾病发展。
综上所述,活动性RA患者关节腔积液中存在高比例的中间型和非经典型单核细胞。另外,RA患者外周血单核细胞3个亚群均具有高水平的TLR9,TLR9激动剂增加炎性细胞因子和趋化因子的产生。因此,单核细胞TLR9在RA患者的疾病过程中发挥重要作用。本研究的局限性是对总体细胞的细胞因子分泌进行检测,未对单核细胞亚群进行分选,分析亚群中的功能。因此,单核细胞亚群TLR9在RA疾病中的作用需要进一步深入研究。
