果蔬发酵乳酸菌的筛选、鉴定及发酵性能分析
2020-06-01王伟伟王艳霞宋元达
王 璐,王伟伟,王艳霞,张 瑶,,宋元达
(1.山东理工大学农业工程与食品科学学院,山东 淄博 255000;2.淄博市中心医院,山东 淄博 255020)
乳酸菌是指能发酵碳水化合物产生大量乳酸并在自然界中广泛分布的一类革兰氏阳性细菌的通称[1-3]。由于乳酸菌具有营养、健康的特殊功效,风靡在欧、美、日、韩等市场,并被广泛应用于保健食品、饮料、肉制品、乳制品等食品及预防医学领域[4-10]。近年来关于乳酸菌发酵水果蔬菜饮料的研究日益增多。果蔬经过乳酸菌发酵后营养成分得到很好的保留和细化,不仅风味极佳,酸甜可口,营养价值也更高[11-14]。目前研究者对多种果蔬原料如南瓜、雪莲果、苹果、梨、胡萝卜、花椰菜、芹菜、番茄、龙眼、火龙果等单一果蔬或混合果蔬进行乳酸菌发酵工艺研究[14-20]。如今国内市场用于果蔬发酵的乳酸菌种多为商业化牛乳发酵菌种,虽然也有研究者从泡菜、果蔬酱、水果发酵液中分离筛选乳酸菌[21-23],但筛选的菌株仍存在利用果蔬能力有限及对发酵材料和发酵环境适用性差的问题。因此,开发具有优良发酵性能的果蔬发酵专用菌株至关重要。本研究采用强酸、高盐和高糖的MRS培养基从自然发酵苹果原浆样品中分离筛选出乳酸菌种并进行生理生化和分子生物学鉴定,同时通过测定菌体干质量、活菌数、pH值和酸度等指标对乳酸菌在MRS培养基和果蔬原浆中的发酵性能进行分析。该研究有望为丰富果蔬发酵专用菌种库以及开发新型果蔬发酵产品提供理论支持。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
沂源山地苹果产区自然发酵苹果原浆样品。
1.1.2 培养基
MRS分离培养基:牛肉膏10 g/L,蛋白胨10 g/L,吐温80 1 g/L,葡萄糖50 g/L,乙酸钠5 g/L,硫酸镁0.2 g/L,磷酸氢二钾2 g/L,柠檬酸二铵2 g/L,溴甲基酚紫0.4 g/L,酵母提取物5 g/L,琼脂15~20 g/L,pH 6.3~6.7,121 ℃湿热灭菌30 min。
初筛培养基:在MRS分离培养基的基础上,添加0.5%碳酸钙,乳酸调pH 2.0。
高盐复筛培养基:在MRS分离培养基的基础上,添加10%氯化钠和0.5%碳酸钙。
高糖复筛培养基:在MRS分离培养基的基础上将葡萄糖质量分数提高到30%,添加0.5%碳酸钙。
明胶培养基:蛋白胨25 g/L,牛肉膏7.5 g/L,氯化钠 5 g/L,明胶100 g/L,pH 7.0~7.2,121 ℃湿热灭菌15 min。
果蔬发酵培养基:将苹果、胡萝卜、西瓜、西红柿等水果、蔬菜清洗去皮切分后分别榨汁除渣制得发酵果酱,然后按1∶1∶1∶1比例混合经巴氏灭菌后4 ℃冷藏。按照混合果蔬汁33.3%、葡萄糖5%、蔗糖5%、氯化钙0.5%、磷酸氢二钠0.05%、磷酸二氢钠0.05%、硫酸镁0.03%、柠檬酸0.1%的配比配制,除果蔬和柠檬酸外其余成分于115 ℃湿热灭菌15 min。
菌种生理生化鉴定用培养基见文献[24-25]。
1.2 仪器与设备
QHZ-12A隔水式恒温培养箱 江苏盛蓝仪器制造有限公司;紫外分光光度计 岛津企业管理(中国)有限公司;高温高压灭菌锅 厦门森态仪器仪表有限公司;分析天平 德国Mettler-Toledo公司;TH-YJ-1450A/B型净化工作台 苏州华科净化设备有限公司;PHS-25数显pH计 上海雷磁仪器有限公司。
1.3 方法
1.3.1 乳酸菌的分离筛选
取沂源山地苹果产区自然发酵苹果原浆,用0.9%灭菌生理盐水进行10 倍梯度稀释后,吸取适宜稀释度溶液涂布至MRS分离培养基中,37 ℃恒温厌氧培养24 h,挑取菌落黄色范围大并具有乳酸菌典型特征的单菌落,进行革兰氏染色观察菌体形态。将革兰氏染色阳性菌落接种于MRS培养基,37 ℃恒温厌氧培养24 h,重复划线培养,连续传代培养不少于3 次,直至得到单菌种纯培养物,作为乳酸菌备选菌株。
将备选菌株分别接种在初筛培养基,37 ℃恒温厌氧培养24 h,然后挑选目标菌落继续在高盐复筛培养基中进行筛选,挑选黄色钙圈明显的单菌落继续点接在高糖复筛培养基,37 ℃恒温厌氧培养24 h,挑取明显变黄的菌落转至MRS固体斜面,低温保藏备用。
1.3.2 乳酸菌的鉴定
1.3.2.1 形态学鉴定
菌落形态:将菌株活化后接种在MRS固体平板上培养,观察菌落形态;革兰氏染色:将菌株进行革兰氏染色观察菌体细胞形态。
1.3.2.2 耐受性分析
将菌株甘油冻存管分别活化至菌体浓度调至2.5×108CFU/mL,然后分别接种于pH 2.0~3.0、NaCl质量分数5.0%~10.0%或葡萄糖质量分数10.0%~30.0%的MRS液体培养基,37 ℃恒温培养,于0 h和3 h分别取样进行活菌计数,以0 h样品为对照,按式(1)计算样品中菌株的存活率:
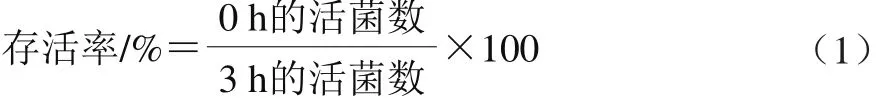
1.3.2.3 生理生化鉴定
对分离菌株进行过氧化氢酶以应、硫化氢、明胶液化、吲哚产生、石蕊牛乳、乳酸纸层析以及碳水化合物利用等实验,结果对照《伯杰细菌鉴定手册》[26]进行综合评定。
过氧化氢酶以应:将筛选菌株接于MRS斜面培养基上,37 ℃培养24 h后,滴加几滴过氧化氢溶液,观察是否产生气泡。
硫化氢实验:将筛选菌株接种于三糖铁琼脂培养基中,20 ℃培养7 d观察是否变黑。
明胶液化实验:将筛选菌株接种于明胶培养基试管,20 ℃培养观察菌生长情况及明胶是否融化。
吲哚实验:将筛选菌株接种于蛋白胨水培养基中,37 ℃培养24 h,后加入乙醚和吲哚试剂,观察液层界面呈现玫瑰色则为阳性,否则为阴性。
石蕊牛乳实验:将筛选菌株接种于石蕊牛乳试管中,37 ℃培养1、3、5、7、14 d观察有无酸凝、酶凝、胨化、还原等现象。
乳酸纸层析实验:将筛选菌株的发酵培养液、2%乳酸及空白培养液点在滤纸上,放入装有展层剂(水-正丁醇-苯甲醇体积比为1∶5∶5)的层析缸,约10 h后,取出滤纸风干。向滤纸均匀喷洒0.04%溴酚蓝乙醇溶液显色,对比样品与乳酸所出现黄色斑点位置,计算Rf值以判断样品中是否含有乳酸。
碳水化合物利用实验:将筛选菌株接入各种碳水化合物培养试管,37 ℃恒温培养24 h,观察试管中培养物颜色变化及有无气体产生。
1.3.2.4 菌株的16S rRNA分子鉴定
将筛选菌株送至生工生物工程(上海)股份有限公司测定16S rRNA序列。
1.3.3 乳酸菌发酵性能测定
将筛选出的耐酸、耐盐、耐糖菌株进行活化、扩培后,按5%接种量分别接种于果蔬发酵培养基中,37 ℃恒温厌氧培养,定时取样,测定各发酵时间点的生物量、活菌数、pH值、酸度等(自发酵始每隔3 h测定生物量、pH值和酸度,每隔12 h测定活菌数),每次测定重复3 次。
生物量:测定样品在600 nm波长处的OD值,根据时间和OD600nm值绘制菌株生长曲线;菌体干质量:定量取5 mL菌体烘干至质量恒定,称质量计算;pH值:采用pH计直接测定;活菌数:采用伊红美蓝活菌数快速测定方法[27]测定;酸度(以乳酸浓度计):采用酸碱滴定法测定[25,28],具体步骤如下:吸取果蔬发酵液10 g,用0.1 mol/L NaOH标准溶液滴定并边滴定边搅拌测定pH值,滴定至pH值为8.2,记录标准NaOH用量,同时做空白对照,按式(2)计算发酵液酸度:
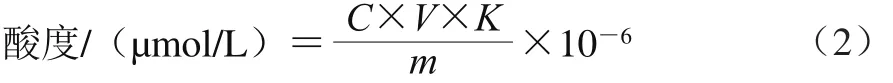
式中:C为NaOH标准溶液的浓度/(mol/L);V为滴定至pH 8.2时消耗的NaOH溶液的用量/mL;K为乳酸转化系数,0.09;m为吸取发酵液体积/mL。
1.4 数据处理
所有实验均设置3 次重复,实验结果采用SPSS软件进行统计分析。图表采用Origin Pro 8.0进行处理与分析。
2 结果与分析
2.1 乳酸菌筛选及形态学鉴定
在以溴甲基酚紫为指示剂的MRS分离培养基上,从苹果样品中分离出36 株变黄明显,且具有乳酸菌典型菌落形态特征的菌株(图1a)。其中有10 株产酸较强,菌株编号见表1,其菌体形态特征和镜检结果见图1b和表1。
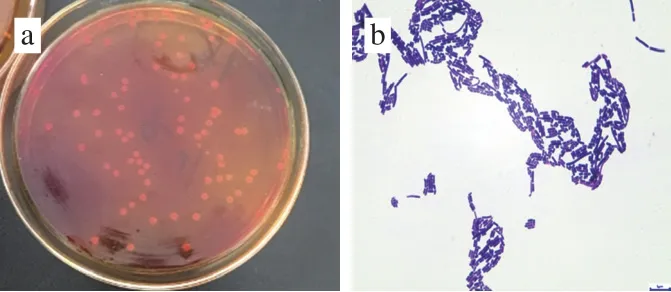
图1 MRS分离培养基上菌落形态(a)和菌体形态(b)Fig. 1 Colony morphology (a) and bacterial morphology (b) on MRS medium
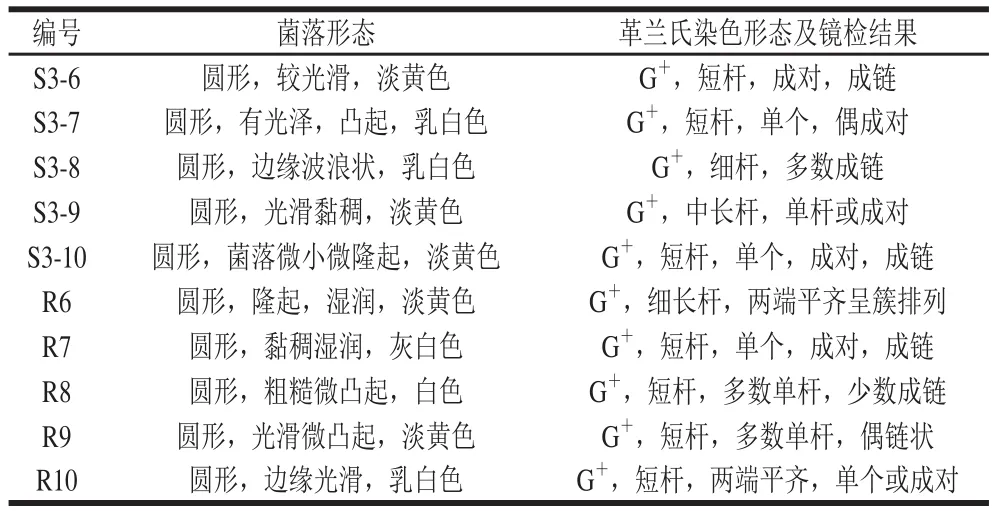
表1 菌落及菌体形态特征Table 1 Colony and bacterial morphology characteristics
溶钙圈可以作为衡量产酸能力的重要指标[25]。10 株疑似菌中有4 株在初筛培养基生长良好,产生较大的溶钙圈,表明这4 株菌耐酸能力强产酸多,将这4 株菌在含高盐和高糖的复筛培养基上继续培养,发现仅有2 株生长较好,能够耐受高盐高糖环境,这2 株菌分别为S3-10和R10。将这2 株菌分别接种于不同pH值(pH 2.0~3.0)、盐质量分数(5.0%~10.0%)或葡萄糖质量分数(10.0%~30.0%)的MRS培养基中进行耐受性验证(表2),结果表明2 株菌的存活率都能保持在85%以上,均能耐受较低的pH值环境和高盐、高糖环境。
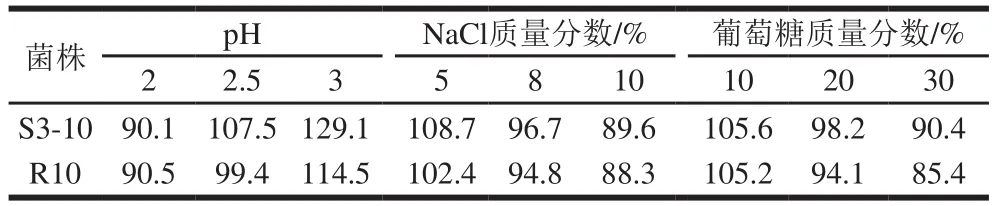
表2 菌株耐受性实验的存活率Table 2 pH, NaCl and glucose tolerance (survival rate) of two strains%
2.2 乳酸菌生理生化鉴定
由表3可得,2 株菌在过氧化氢酶实验、硫化氢实验、明胶液化实验、吲哚实验等生化以应均呈阴性。石蕊牛乳实验中,2 株菌培养后使石蕊褪色,并且大量产酸使得牛乳凝固。乳酸纸层析实验中,2 株菌的发酵液与乳酸对照相比,Rf值相近,说明两菌株发酵产物中含有乳酸。碳水化合物利用实验结果表明,2 株菌对多种糖醇如葡萄糖、乳糖、麦芽糖、山梨醇、甘露醇、蔗糖、纤维二糖、甘露糖、半乳糖、核糖等都能够利用,且发酵葡萄糖均产酸不产气。这与前期有关乳酸菌糖醇利用的实验结果一致[25,29]。
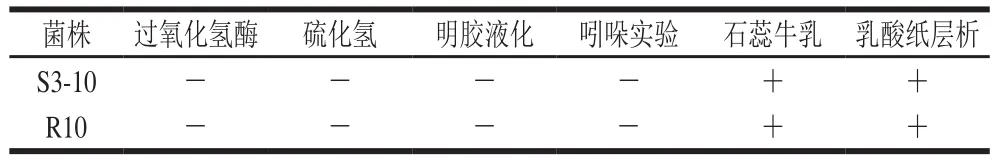
表3 菌株部分生理生化鉴定实验结果Table 3 Partial physiological and biochemical properties of two strains
2.3 菌株16S rRNA鉴定
将筛选菌株S3-10和R10送至生工生物工程(上海)股份有限公司测定16S rRNA序列。将测定的序列在NCBI数据库进行BLAST比对,发现S3-10菌株与植物乳杆菌同源性高达99%。结合S3-10菌株的形态特征及生理生化指标测定等表型鉴定结果,将S3-10菌株鉴定为植物乳杆菌(Lactobacillus plantarum,菌种保藏号CGMCC No.16750)。同理,将R10菌株鉴定为干酪乳杆菌(L. casei,菌种保藏号CGMCC No.16750)。
2.4 乳酸菌发酵性能分析
2.4.1 乳酸菌生长情况分析
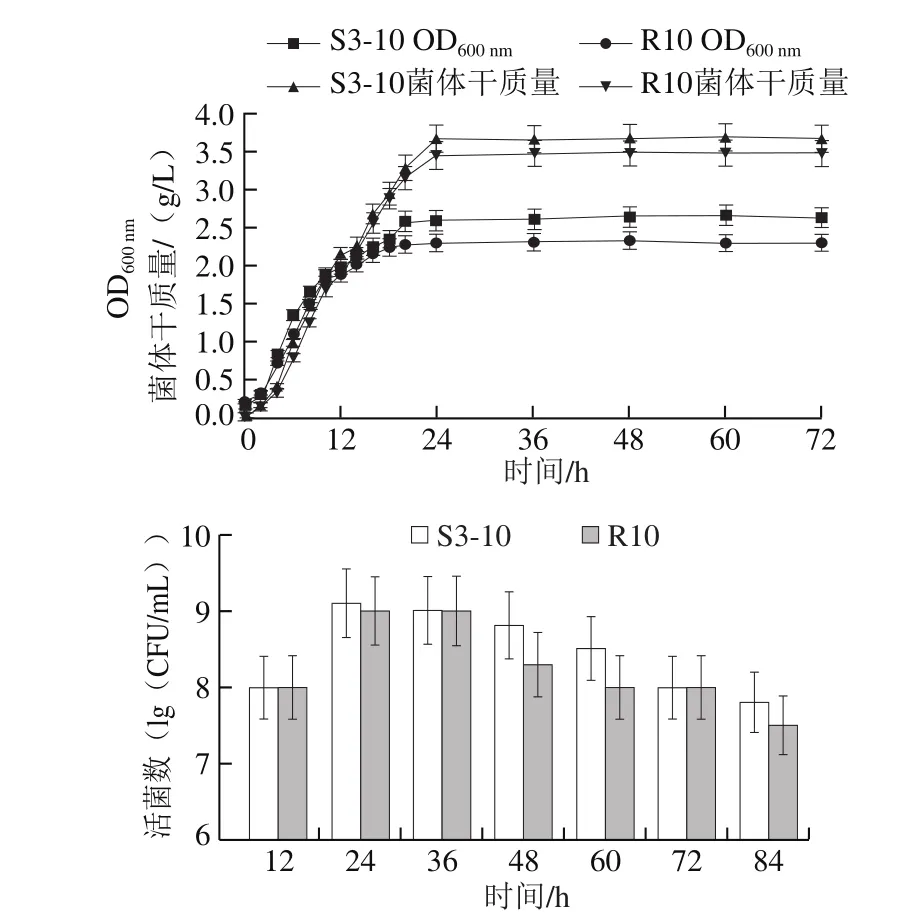
图2 2 株乳酸菌在MRS培养基上的生长曲线及活菌数变化Fig. 2 Growth curves and viable cell counts of two strains cultured on MRS medium
由图2可知,2 株乳酸菌生长趋势大致相同,均无延滞期,很快进入对数生长期,并在发酵20 h进入稳定期,随后生长速率逐渐放慢并达到饱和。植物乳杆菌S3-10比干酪乳杆菌R10生长速率略快,最终获得的最大菌体干质量S3-10为3.68 g/L,R10为3.49 g/L。发酵基质中活菌数变化以映菌种利用发酵基质性能的强弱[25]。图2显示,植物乳杆菌S3-10在发酵12 h时活菌数增加且在36 h之前活菌数均达到109CFU/mL,之后活菌数略有下降,但在84 h内活菌数始终保持在108CFU/mL以上。干酪乳杆菌R10发酵活菌数变化趋势与植物乳杆菌S3-10大体一致,但活菌数在发酵36 h后低于S3-10,发酵72 h内活菌数保持在108CFU/mL。
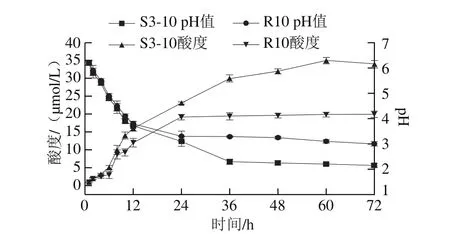
图3 2 株乳酸菌在MRS培养基上发酵的pH值和酸度变化Fig. 3 Changes in pH and acidity of two strains cultured on MRS medium
发酵液中pH值的变化幅度也可以映菌株发酵性能的优劣。pH值的降低不仅说明菌株对发酵基质的利用率高,还能影响一些不耐酸的微生物的生长繁殖。如图3所示,2 株乳酸菌的发酵过程中pH值的下降趋势大致相似。发酵前期(前24 h)pH值下降迅速,这与发酵前期乳酸菌大量增殖有关;发酵后期,由于代谢产物、pH值等因素抑制,乳酸菌活菌数降低渐进入稳定期,此时pH值下降缓慢直至趋于稳定,pH值分别达到2.15(S3-10)和3.0(R10)。植物乳杆菌S3-10 pH值下降速率明显比干酪乳杆菌R10快,说明植物乳杆菌S3-10受条件抑制影响较小,生长情况较好。酸度值是衡量菌株发酵产酸能力的重要指标。由图3可以看出,2 株乳酸菌酸度趋势大致相同,在发酵10~36 h产酸速率最快,之后酸度增幅不大。植物乳杆菌S3-10酸度明显高于干酪乳杆菌R10,最终发酵结束获得的最大酸度约为35 μmol/L,是干酪乳杆菌R10产酸量的1.75 倍。
2.4.2 乳酸菌果蔬发酵性能分析
将2 株乳酸菌接入天然果蔬原浆中进行发酵,由图4可知,2 株乳酸菌无论在果蔬原料还是MRS培养基上生长趋势均大致相同,接种后立即进入对数生长期,并在发酵24 h进入稳定期直至发酵结束。植物乳杆菌S3-10生长速率仍略高于干酪乳杆菌R10,最终获得的最大菌体干质量S3-10为5.4 g/L,R10为5.08 g/L。对发酵液中活菌数测定结果(图4)表明,2 株乳酸菌发酵果蔬过程中均保持较高的活菌数,且活菌数变化趋势大体一致。植物乳杆菌S3-10在发酵第12小时活菌数增加且在48 h之前活菌数均达到109CFU/mL,之后活菌数略有下降,但在72 h内活菌数始终保持在108CFU/mL以上。干酪乳杆菌R10发酵活菌数在发酵24 h后略低于S3-10,发酵60 h内活菌数保持在108CFU/mL。已有研究结果表明[19,30],多数乳酸菌发酵果蔬24 h后活菌数明显下降,且48 h就已降到105CFU/mL以下。而本研究所筛选的2 株乳酸菌发酵果蔬均能保持较长时间的高活菌数,更适用于果蔬汁的发酵。
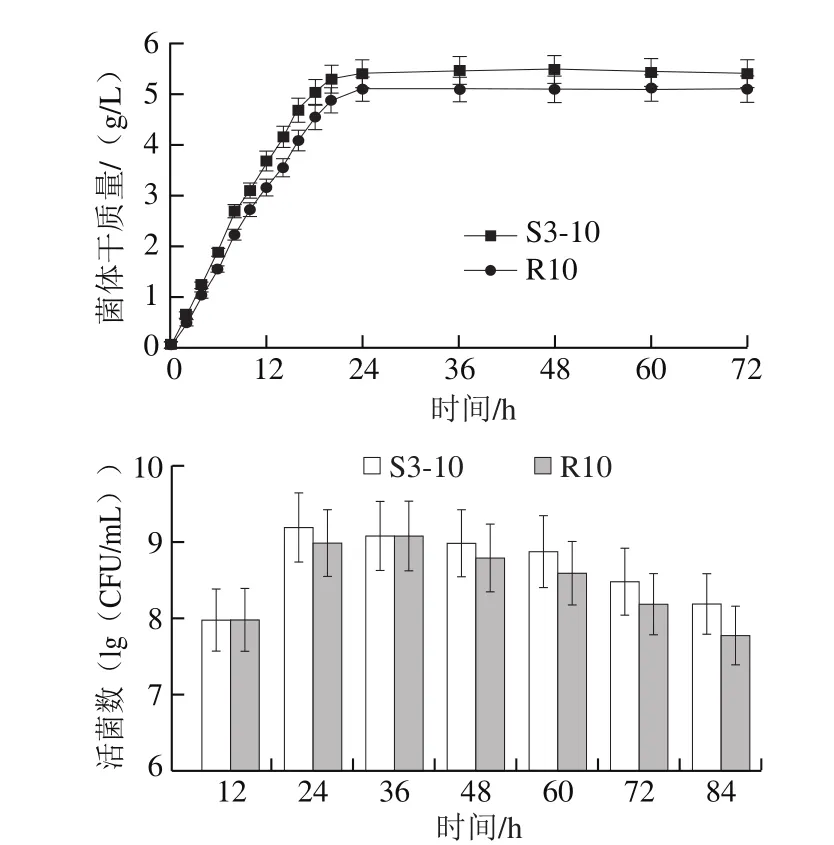
图4 2 株乳酸菌发酵果蔬过程中菌体干质量及活菌数变化Fig. 4 Changes in dry cell mass and viable cell counts of two strains during fermentation of fruits and vegetables
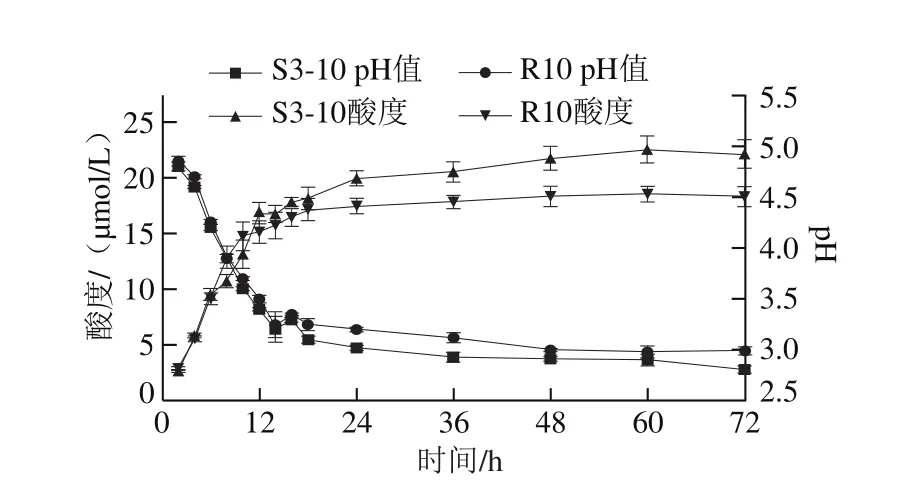
图5 2 株乳酸菌发酵果蔬过程中pH值和酸度变化Fig. 5 Changes in pH and acidity during fermentation of fruits and vegetables by two strains
混合果蔬原料中酸度、糖度相比于普通培养基都较高。如图5所示,2 株乳酸菌在果蔬发酵过程中pH值的下降趋势和产酸趋势大致相似。发酵前期(前24 h)pH值下降迅速,之后pH值下降缓慢直至趋于稳定,最终pH值分别达到2.81(S3-10)和2.98(R10)。已有研究结果表明[19,25,30],多数乳酸菌发酵果蔬pH值变化趋势和本研究一致,且发酵结束pH值均降到3左右。本研究pH值在24 h后即已降到3以下,而此时仍能保持较高的活菌数,说明这2 株乳酸菌受条件抑制影响较小。在发酵10~24 h产酸速率最快,之后酸度增幅不大。与MRS培养基发酵结果相同,植物乳杆菌S3-10产酸量明显高于干酪乳杆菌R10,最终发酵结束获得的最大酸度约为22.6 μmol/L,是干酪乳杆菌R10酸度的1.26 倍。以上结果说明2 株乳酸菌对果蔬原料的利用率都较高,在果蔬发酵液中生长良好。
3 结 论
本研究从沂源山地苹果产区自然发酵苹果原浆样品中分离筛选出2 株具有良好的耐酸、耐盐、耐糖特性的乳酸菌,经生理生化及分子生物学鉴定分别为植物乳杆菌S3-10和干酪乳杆菌R10。乳酸菌S3-10和R10均能较好地适应果蔬发酵基质,生长繁殖旺盛、产酸速率快,其中植物乳杆菌S3-10生长量和产酸量显著高于干酪乳杆菌R10,在发酵果蔬汁、开发功能益生产品方面有更广阔的应用前景。植物乳杆菌和干酪乳杆菌是果蔬乳酸发酵的常用菌种,菌株S3-10和R10发酵果蔬性能优异,可进一步尝试将2 株菌混合或与其他乳酸菌协同发酵果蔬原料,开发出营养保健功能更强的果蔬汁或功能益生产品。
