食品中肌醇测定用菌株的筛选及检测方法建立和应用
2020-06-01崔学文房玉国闻宏亮范一灵
张 宁,范 迪,杨 燕,王 赢,徐 琼,崔学文,房玉国,闻宏亮,秦 峰,刘 浩,范一灵,
(1.国家药品监督管理局药品微生物检测技术重点实验室,上海市食品药品检验所,上海 201203;2.上海质量监督检验技术研究院,上海 200233;3.上海海关,上海 200135;4.四川省食品药品检验检测院,四川 成都 611731;5.国家乳制品质量监督检验中心,黑龙江 哈尔滨 150086)
肌醇又称环己六醇,是一种具有生物活性的环状糖醇。1928年,Eastcott首次制备了纯净态的肌醇[1]。1940年Wooley首次发现肌醇具有抗脱毛作用,从而揭开了肌醇具有维生素活性这一特性。研究发现,肌醇理论上具有9 种立体异构体[2-4],其中内消旋(1,2,3,5-顺式)环己醇具有维生素生物活性。
肌醇广泛分布于动植物体内,几乎所有的生物中都含有游离态或结合态肌醇,是生物体生命活动不可缺少的物质[5],特别是在全谷物和柑橘类水果内。肌醇通过磷酸化和去磷酸化以应形成带有不同数量磷酸基团的衍生物,参与各种生物代谢过程[6],具有多种生理药理活性[7],广泛应用于饲料[8-9]、食品[10]、医药[11-13]等行业。医药行业中,肌醇能促进脂肪代谢,防止体内脂肪累积,具有免疫、预防和治疗某些疾病等作用[14-16]。食品工业中,肌醇是人体多类型细胞的必需生长因子,尤其在胎儿及儿童生长发育过程中发挥关键作用[17],因此,其作为一种营养强化剂添加于婴幼儿配方乳粉及特殊膳食食品中。
国内外有关肌醇检测的方法主要有色谱法(气相色谱法[18-20]、气相色谱-质谱法[21-22]、高效液相色谱法[23]、液相色谱-质谱法[24]、离子色谱法[25])和微生物法[8,26]。目前,国际标准关于肌醇检测的方法均为理化检验法,涉及的方法有AOAC 2011.18的液相色谱法、AOAC 2012.12的离子色谱法以及ISO 20637:2015的液相色谱法,上述方法适用基质均为婴幼儿和成人营养配方食品;国内关于肌醇检测的标准主要有GB 5009.270—2016《食品中肌醇的测定》、GB/T 5009.196—2003《保健食品中肌醇的测定》、NY/T 1345—2007《添加剂预混合饲料中肌醇的测定》、GB/T 23879—2009《饲料添加剂 肌醇》,涉及的方法主要以理化色谱法为主,仅GB 5009.270—2016中涉及到微生物法。色谱法主要适用于含量较高、基质成分简单的强化食品中肌醇的测定;微生物法基于某些微生物对肌醇利用的特异性,具有高灵敏度,更适合含量较低、基质成分复杂的天然食品中肌醇的测定。然而,在实际应用中,GB 5009.270—2016中的微生物法[26]在测试菌株肌醇利用特异性、方法操作步骤及终点判断原则规范化等方面仍需改进及明确,因此,本研究分别从肌醇利用特异性菌株的筛选、菌悬液的制备方式、标准曲线的拟合方式及培养终点时间的判断等方面进行方法探索,从而对该国标的方法进行优化改良,最终以不同类别的食品为基质,进行实验室间的方法验证,分别考察方法的精密度、回收率及重现性,最终获得可靠稳定的用于肌醇测定的微生物方法。
1 材料与方法
1.1 材料与试剂
酿酒酵母菌:Saccharomyces cerevisiae CICC 32919、ATCC 9080、ACCC 20065;葡萄汁酵母菌:S. uvarum CICC 1465、CICC 31161、ACCC 20202。
肌醇测定培养基 青岛日水生物科技有限公司;麦芽汁浸粉琼脂培养基、麦芽汁肉汤培养基 上海瑞楚生物科技有限公司;肌醇标准品(纯度99.5%) 美国Sigma公司。
1.2 仪器与设备
Infinite F200 PRO型酶标仪 瑞士Tecan公司;UV2450分光光度计 日本岛津公司;PYX-DHS-600-BS型恒温培养箱 上海贺德实验设备有限公司;SI-600R型振荡培养箱 韩国Jeiotech公司;HV-110型压力蒸汽消毒器 日本Hirayama公司。
1.3 方法
1.3.1 肌醇标准溶液的配制
按照GB 5009.270—2016中3.4节标准溶液配制[26]。
1.3.2 接种菌悬液的制备
将菌株活化后接种至麦芽浸粉琼脂斜面培养基,(30±1)℃培养2~3 d后,制成贮备菌种,贮于4 ℃冰箱中,保存期不要超过2 周。
使用前1 d,将保存菌种转接至10 mL灭菌麦芽浸粉液体培养基,(30±1)℃培养20~24 h。取麦芽浸粉液体培养基培养物,无菌条件下2 000 r/min离心15 min,倾去上清液。加入10 mL无菌0.9%氯化钠溶液,重新分散细胞,于旋涡混合器上快速混合均匀,离心15 min,倾去上清液。重复离心和清洗步骤3 次。最后一次细胞分散液用无菌0.9%氯化钠溶液悬浮,制成混悬液,备用。用紫外-可见分光光度计,以无菌0.9%氯化钠溶液作空白,550 nm波长处测定接种菌悬液的透光率,调整加入的菌液量或者加入一定量的无菌0.9%氯化钠溶液使该菌悬液透光率在60%~80%之间,尽快使用。
1.3.3 样品处理
样品前处理:薏米样品粉碎、研磨、过筛;南瓜粉及猪肝粉样品用前混匀;饮料样品用前振摇混匀。
样品提取:准确称取含肌醇0.50~2.00 mg的上述试样于250 mL锥形瓶中,固体试样加入80 mL 0.44 mol/L盐酸溶液,液体试样加入100 mL 0.44 mol/L盐酸溶液,混匀。将锥形瓶以铝箔纸覆盖,在灭菌釜中125 ℃水解1 h。取出,冷却至室温,加入约3 mL 12.5 mol/L氢氧化钠溶液,冷却。用适宜浓度的氢氧化钠溶液或盐酸溶液调pH 5.2±0.1,转入250 mL容量瓶中,定容至刻度。混匀,过滤,收集滤液。调整滤液稀释倍数,使待测液肌醇质量浓度在0.1~1.0 μg/mL范围内,作为试样提取液。
1.3.4 标准曲线及待测液系列管制作
1.3.4.1 标准曲线管的制作
按照GB 5009.270—2016中5.4节标准曲线的制作[26]。
1.3.4.2 待测液系列管的制作
按照GB 5009.270—2016中5.5节待测液的制作[26]。
1.3.4.3 接种及培养
向1.3.4.1节和1.3.4.2节中所有的试管各加入玻璃珠1 颗,121 ℃、5 min灭菌,迅速冷却,将1.3.2节制备好的接种菌悬液向上述试管内(除对照管)各加约150 μL,混匀,(30±1)℃振荡培养。
1.3.4.4 96 孔板中的加样制备及培养
系列管按1.3.4.1节和1.3.4.2节制作后,每孔加入200 μL制备液,将孔板置于酶标仪中,(30±1)℃振荡培养48 h,培养过程中每小时检测一次OD550nm。
1.3.5 肌醇测定菌株的筛选
按照1.3.4.1节分别制备对照管(S1)3 管,无肌醇培养体系(S2:肌醇质量浓度0 μg/mL)及高质量浓度肌醇培养体系(S10:肌醇质量浓度1 μg/mL)各18 管。按照1.3.2节方法将6 株酵母菌分别制备接种菌悬液,将制备好的6 株菌菌悬液分别按照1.3.4.3节接种至上述S2、S10管(每株菌每管平行制备各3 管),将制备好的培养体系分别按照1.3.4.4节方法进行96 孔板的加样制备及培养。
1.3.6 肌醇测定菌株培养时间的考察
按照1.3.4.1节分别制备3 管S1及若干管S10。按照1.3.2节方法制备S. uvarum CICC 1465菌悬液,按照1.3.4.3节方法接种至上述S10管,(30±1)℃培养24 h后,每隔1 h取样测定OD550nm,以时间为横坐标,OD550nm为纵坐标,绘制S. uvarum CICC 1465的生长曲线。
1.3.7 肌醇测定菌株标准曲线的绘制
按照1.3.4.1节进行标准曲线管的制作,按照1.3.2节方法制备S. uvarum CICC 1465菌悬液,按照1.3.4.3节接种至上述标准曲线管并培养,以肌醇质量浓度为横坐标,不同肌醇质量浓度下菌株生长OD550nm为纵坐标,进行标准曲线的绘制,采用四参数Logistic拟合方式。四参数Logistic模型的方程如下:
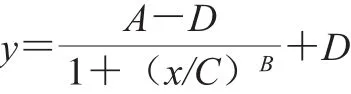
式中:A、B、C、D为拟合曲线的4 个特征性参数,其中,A为以应下限值,D为以应上限值,B为曲线的斜率因子,C为半数有效浓度(EC50)。
1.3.8 培养终点期菌株生长变化量的考察
按照1.3.4.1节进行标准曲线管的制作,按照1.3.2节方法制备S. uvarum CICC 1465菌悬液,按照1.3.4.3节接种至上述标准曲线管并培养,培养至38 h后,每隔2 h测定S10管的OD550nm,最终以6 次独立实验结果进行统计分析。
1.3.9 方法学验证
验证单位:4 家国内食品检验检测实验室,编号1~4。
验证方法:以S. uvarum CICC 1465为测试菌株,按照1.3.1~1.3.3、1.3.4.1~1.3.4.3节方法进行实验,采用四参数Logistic方程进行标准曲线拟合,终点判断原则为培养约38 h后,同等条件下每隔2 h监测最高质量浓度标准曲线管S10,测定其OD550nm,两次OD550nm的绝对差结果不大于5%时,终止培养,一般培养时间不超过44 h。通过上述方法进行样品中肌醇含量的测定。
验证样品:维生素功能饮料、猪肝粉、南瓜粉及薏米粉。
精密度验证:每个实验室分别对每种试样进行7 次独立测定实验。
回收率验证:每个实验室分别对每个样品进行试样与标准品1∶1加标回收率实验。
重现性验证:综合对4 家实验室测定的4 种样品的肌醇含量进行重现性分析。
2 结果与分析
2.1 肌醇测定菌株的筛选
肌醇是酵母菌生长必须的生长因子[27],有些酵母菌自身能够合成细胞生长所需的肌醇[28],而有些酵母菌却是天然的肌醇缺陷型,必须依赖培养基中的外源肌醇[29]。因此,本研究基于此原理,分别从大量酵母菌中选择6 株常用于维生素检测的酵母菌,进行肌醇测定菌株的筛选。

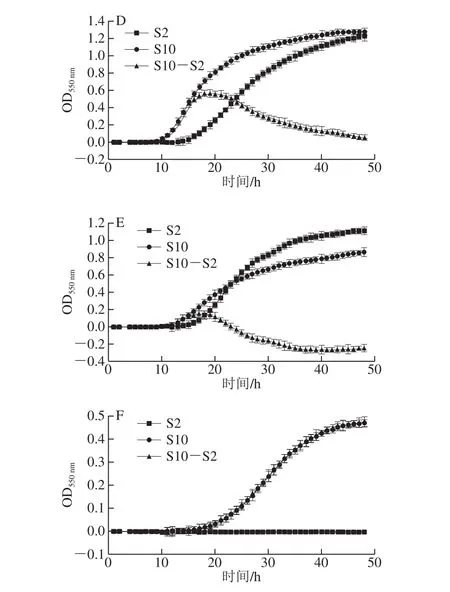
图1 肌醇对不同菌株生长的特异性Fig. 1 Effect of inositol concentration on the growth specificity of different strains
由图1可知,与每株菌在S10中生长趋势相比较,S. cerevisiaeATCC 9080、S. cerevisiaeACCC 20065、S. cerevisiaeCICC 32919、S. uvarumCICC 31161、S. uvarumACCC 20202在无肌醇培养体系中(S2)均有明显的同步生长,而S. uvarumCICC 1465在S2中未有明显生长。因此,葡萄汁酵母S. uvarumCICC 1465为肌醇利用特异性菌株,具有特异性检测肌醇含量的潜力。
2.2 肌醇测定菌株培养时间的选择
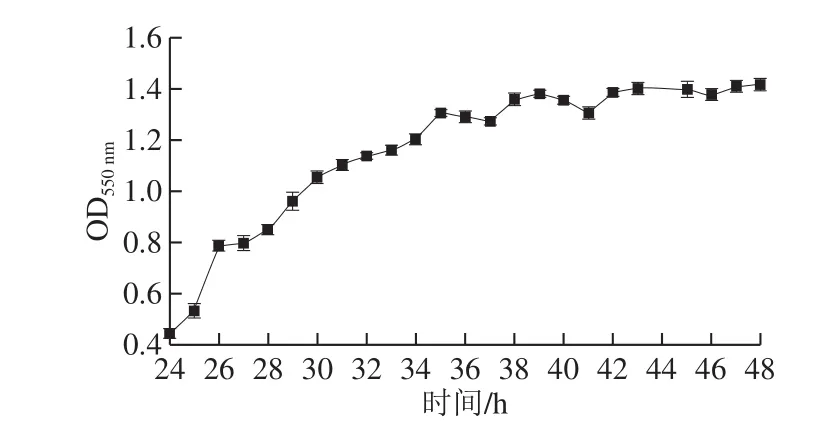
图2 S. uvarum CICC 1465菌株生长曲线(24~48 h)Fig. 2 Growth curve of S. uvarum CICC 1465 during cultivation period from 24 to 48 hours
由图2可知,菌株S. uvarumCICC 1465在生长至38~48 h趋于稳定期,因而建议采用S. uvarumCICC 1465菌株进行肌醇测定时,在38~48 h进行监控,确定终点培养时间。
2.3 肌醇测定菌株标准曲线
实验发现菌株S. uvarumCICC 1465生长OD550nm与培养体系中肌醇质量浓度呈S型曲线关系,四参数Logistic模型是S型曲线的常用拟合模型[30-31],各参数对生物以应关系更具有实际意义,因此,本研究采用四参数Logistic拟合方式,以肌醇质量浓度为横坐标,不同肌醇质量浓度下菌株生长OD550nm为纵坐标,进行标准曲线的拟合绘制。
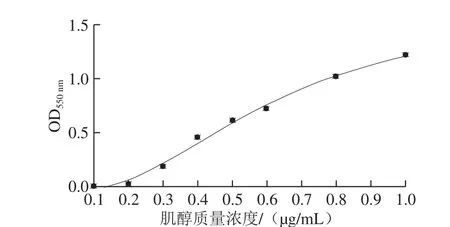
图3 S. uvarum CICC 1465肌醇测定标准曲线Fig. 3 Standard curve for determination of inositol using S. uvarum CICC 1465
由图3可知,肌醇质量浓度0.1~0.2 μg/mL时,菌株OD550nm增长较为缓慢,肌醇质量浓度0.2~0.7 μg/mL时,菌株OD550nm呈对数增长,肌醇质量浓度0.7~1.0 μg/mL时,菌株OD550nm增长逐渐趋于平缓,曲线呈S型曲线以应关系,适宜于四参数Logistic模型。此外,本研究采用四参数Logistic拟合的标准曲线r2大于0.99,曲线拟合较好。
2.4 培养终点期菌株生长变化量
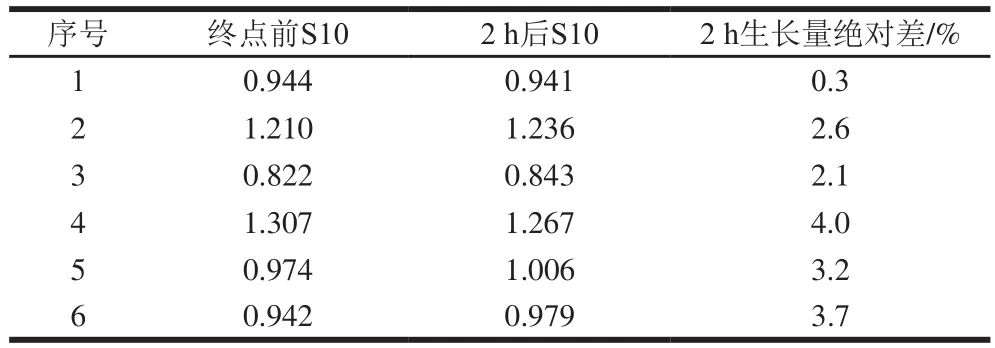
表1 S. uvarum CICC 1465在培养终点2 h内OD550 nm的变化Table 1 Change in OD550 nm of S. uvarum CICC 1465 within 2 h before the end point of culture
由表1可知,培养至终点时,2 h内菌株OD550nm的绝对差结果不大于5%。因此,建议培养约38 h后,同等条件下每隔2 h监测最高质量浓度标准曲线管S10,测定其OD550nm,两次OD550nm的绝对差结果不大于5%时,终止培养,一般培养时间不超过44 h。
2.5 方法学验证
2.5.1 精密度
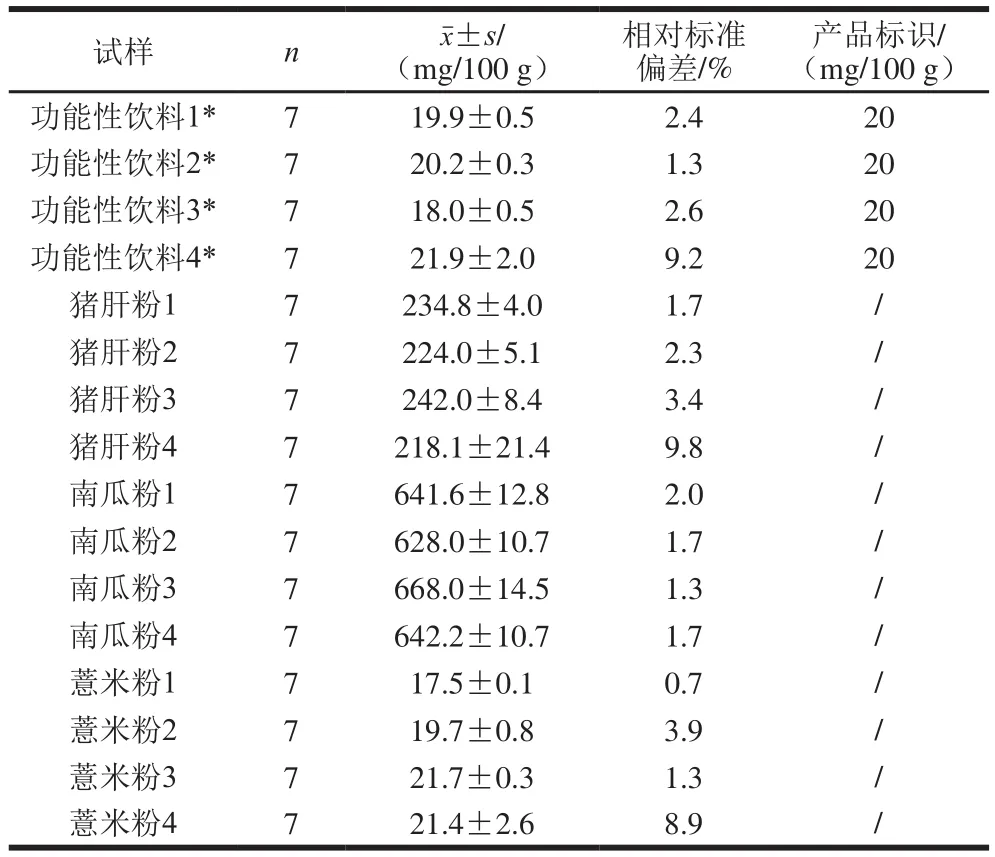
表2 精密度测定结果Table 2 Results of precision test
表2结果表明,本方法在上述试样的测定中,精密度均在10%以内,其中南瓜粉试样的测定精密度均在2%以内。
2.5.2 回收率
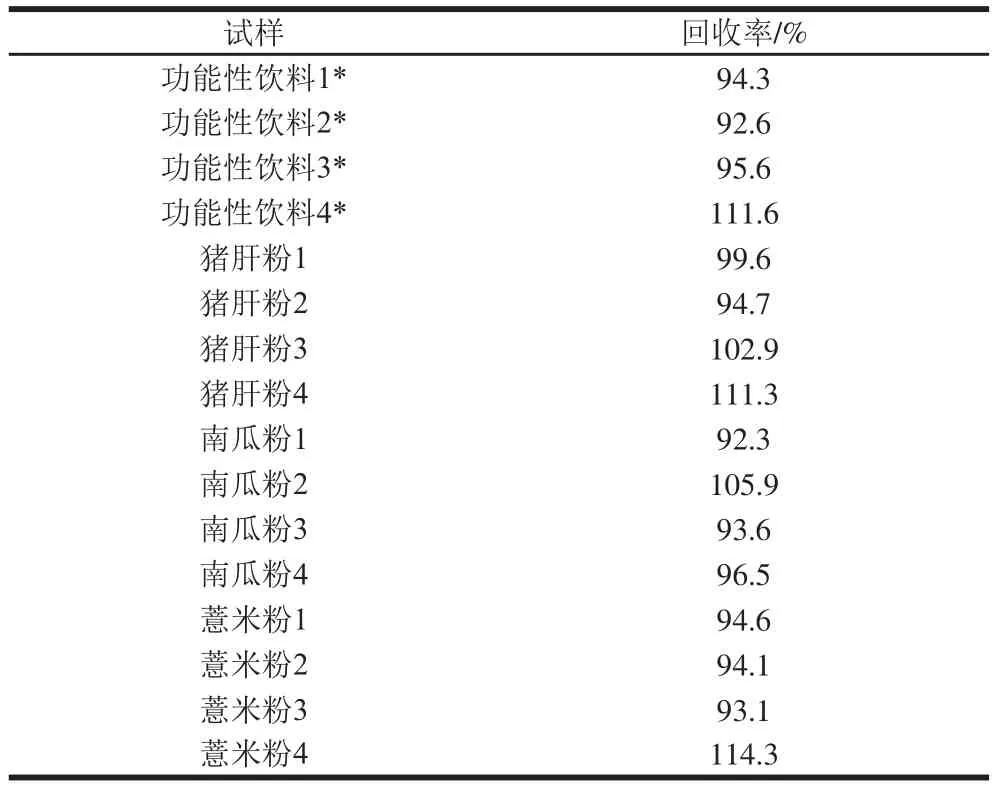
表3 回收率测定结果Table 3 Results of recovery test
由表3可知,本方法在不同基质中的回收率为92.3%~114.3%。
2.5.3 重现性
本实验涉及维生素功能饮料、猪肝粉、南瓜粉及薏米粉4 种试样,通过采用本研究方法分析同一试样在不同验证单位间的肌醇,考察本方法的重现性。表4结果显示,本方法的重现性相对标准偏差均在10%以内。

表4 重现性测定结果Table 4 Results of reproducibility test
因此,综合考察食品中肌醇测定方法的精密度、回收率及重现性,显示筛选的测试菌株及测定方法在应用可行,能够满足测定要求。
3 讨 论
3.1 接种菌悬液制备方式的优化
GB 5009.270—2016微生物法中,直接刮取麦芽浸粉琼脂斜面培养基上的菌苔制备菌悬液。本研究将麦芽浸粉琼脂斜面菌种转接麦芽浸粉液体培养基后,再取培养物制备菌悬液。该操作避免了将琼脂成分携带至菌悬液中,减少了对菌悬液透光率测定的干扰,从而保证了接种菌量的准确性。
3.2 测试菌株的优化
GB 5009.270—2016微生物法测定肌醇含量采用的测试菌株为酿酒酵母菌S. cerevisiaeATCC 9080。实验过程发现,S. cerevisiaeATCC 9080在无肌醇培养体系中菌株仍可快速生长,缺乏对肌醇的生长特异性。因此,本研究通过菌株的肌醇利用特异性筛选实验,筛选得肌醇生长特异性菌株葡萄汁酵母S. uvarumCICC 1465,经验证,葡萄汁酵母S. uvarumCICC 1465符合方法的测定原理,且能够满足方法的测定要求。
3.3 终点判断原则的优化
有关微生物法测定维生素含量的方法中,培养终点时间的判断对测定结果准确度至关重要。若在终点前结束培养进行测定,那么高质量浓度培养体系中的肌醇未被微生物完全利用,从而导致测定结果无法以映试样中肌醇的实际含量。因此,本研究通过监控肌醇最高浓度培养管的OD550nm变化,确定了培养的终点判断原则,从而保证了测定方法的准确性及严谨性。
3.4 标准曲线拟合方式的优化
微生物法测定食品中维生素研究过程中发现,标准曲线常呈S型曲线,这使得传统的线性拟合方式不能实现对标准曲线的良好拟合,而四参数Logistic模型是针对S型曲线实验数据处理常用的方程。该模型符合生物学活性计算的前提和原则,操作简便,普适性强,美国药典(USP40)、欧洲药典(EP9.0)、英国药典(BP2017)均已收载四参数回归计算法[32]。本研究将该模型用于微生物法测定食品中维生素含量中,经多次实验验证及比较,均表明该模型适用于本方法,且优于传统的拟合方式,能够满足测定要求。
4 结 论
本研究成功筛选到1 株肌醇利用特异性菌株葡萄汁酵母S. uvarumCICC 1465,利用该菌进行食品中肌醇检测方法研究,同时,将四参数Logistic拟合方式用于标准曲线的制作,并采用不同类别的试样进行实验室间方法学验证,结果表明,本研究方法精密度、回收率及重现性均得到较好的效果。本研究改良了现行国家标准微生物法中的测试菌株,进一步明确并细化了方法中的相关操作步骤,规范了方法中的相关限制性原则及指标,使得方法的可操作性更强,保证了方法实施的严谨性,为相关食品安全监管部门及企业提供了更可靠的技术支撑。因此,本研究方法更适用于食品中肌醇的定量测定。
