miR-205靶向调控PLCε抑制膀胱癌T24细胞EMT和迁移的作用机制研究
2020-05-28孙宾刘多凤陈建华
孙宾 刘多凤 陈建华
EMT; invasion; metastasis
膀胱癌是常见的泌尿系统恶性肿瘤之一,发病隐匿,转移率高。早期膀胱癌患者中,肌层浸润性膀胱癌约占30%左右,其中1/2的患者发现时已出现远处转移。发生转移后患者的生存率明显下降,即使采用手术切除与联合化疗方法治疗,5年的生存率不足30%[1],因此预防和控制膀胱癌向深处浸润和远端转移是目前医学工作者不断探索的难题。有研究报道上皮间质转化(EMT)是癌细胞出现转移的驱动力,因此研究EMT发生分子机制,是提高肿瘤诊治的关键[2]。磷脂酰肌醇特异性磷脂酶Cepsilon(PLCε)作为癌基因Ras的效应分子,近年来发现其在恶性肿瘤的发生发展过程中起着关键作用[3,4],有文献报道PLCε在膀胱癌组织中呈现高表达状态,且能够促进癌细胞发生EMT和转移[5]。miRNA作为全长含有20~25个核苷酸的小分子RNA,能够通过与靶基因mRNA的 3’端结合,从而抑制靶基因翻译。有文献表明miRNA在肿瘤的增殖、转移和侵袭过程中起着至关重要的作用[6,7]。有研究发现miR-205在乳腺癌[8]、卵巢癌[9]中起到促癌基因作用,在胃癌[10]中起到抑癌基因的作用,但其在膀胱癌中的研究笔者尚未见报道。本研究采用生物信息学工具预测靶向调控PLCε的miRNA,同时上调/沉默miR-205表达,观察对膀胱癌T24细胞EMT和迁移的影响,为治疗膀胱癌提供新的方法。
1 资料与方法
1.1 一般资料 收集2017年1月至2018年12月于我院就诊且经病理学确诊的膀胱癌患者癌组织及癌旁组织80例,其中男40例,女40例;年龄35~60岁,平均年龄(40.45±7.54)岁;术前患者均未进行放化疗。患者及家属签署知情同意书。膀胱癌T24细胞采购自ATCC细胞库。
1.2 试剂与仪器 胰蛋白酶、qRT-PCR检测试剂盒购自碧云天生物技术有限公司;RPIM1640细胞培养基购自购自美国Gibco公司;Trizol总RNA 提取试剂盒购自广东锐博生物科技技术股份有限公司;miR-205 inhibitors、miR-205mimics和阴性对照由上海吉玛制药技术有限公司代为合成;Lipofectamine 2000购自美国 Invitrogen 公司;青、链霉素购自华北制药有限公司、SYBR Premix Extaq system 日本 Takara 公司、Transwell小室及相应产品购自美国Corning公司;细胞培养箱采购自上海三腾仪器有限公司。PTEN 兔抗 (WB)、PTEN 兔抗 (IHC)、Occludin 兔抗购自美国abcam公司、二抗(IHC)、Actin 鼠抗购自Fermentas 公司。实时荧光定量PCR仪购美国Thermo 公司、恒温培养箱购自一恒科学仪器有限公司。
1.3 方法
1.3.1 细胞培养:从液氮中取出人膀胱癌细胞系T24,置于37℃水浴溶解,加入含有10%FBS的RPIM1640培养基中,离心去上清,加入细胞培养液悬浮细胞,接种于培养瓶中,37℃,5%CO2培养,PBS清洗,0.25%胰蛋白酶消化,显微镜观察,加入10%胎牛血清 1640 培养基终止消化,加入到10%FBS的RPIM1640种,37℃,5%CO2培养传代。传代次数一致且细胞处于对数期且用于后续研究。
1.3.2 实时定量PCR检测miR-205的表达:取膀胱癌及癌旁组织研磨加入裂解液,混合作用10 min,12 000 r/min 4℃离心10 min,离心取上清,加入Trizol与氯仿震荡混合均匀,12 000 r/min 离心20 min,加入异丙醇,12 000 r/min离心后,弃上层清液,取管底絮状沉淀,加入Trizol与乙醇混合液,离心弃上清,沉淀则为细胞RNA。将RNA用DEPC水溶解,反转录试剂盒转录cDNA。按照SYBR方法进行实时定量PCR,并以Actin为内参。反应条件为94℃,30 s,1 cycle;95℃,5 s,60℃,30 s,40 cycles;95℃,5 s,60℃,1 min,95℃,1 cycle。结果用2-ΔΔCT表示。检测各组基因的表达量。引物miR-205 上游5’-ACTCAGTAACCCACACA-3’下游5’-GGGTCCACACTGTGGT-3’。
1.3.3 细胞转染:调整膀胱癌细胞T24细胞浓度为1×106个/ml,取2 ml接种于6孔板中,培养过夜,采用Lipofectamine2000将浓度均为100 nM的miR-205 inhibitor、miR-205 mimics和阴性对照转染至细胞,以空脂质体作为对照。qRT-PCR检测miR-205的表达量。
1.3.4 蛋白免疫印迹检测E-Cadhein、Vimentin、Slug蛋白的表达:取转染48h细胞,RIPA裂解液,冰上放置20~30 min,超声裂解30 s,12 000 r/min,4℃离心10 min,收集上清,置于-20℃保存。BCA定量法检测蛋白浓度,待测样品和Loading buffer混合,100℃水域变性5 min,然后加入至制备好的SDS-PAGE凝胶(5%浓缩胶,10%分离胶)上样孔中,每孔25 μl,浓缩胶时调整电压为60 V,分离胶电压为120 V,结束后取出凝胶,4℃转膜1.5 h,采用5%脱脂奶粉封闭PVDF膜2 h,加入一抗,4℃过夜,TBST洗膜后加入辣根过氧化物标记的羊抗兔IgG,37℃孕育2 h。加入ECL显影,采用自动凝胶成像系统采集图像,以GAPDH作为内参,分析蛋白水平。
1.3.5 细胞侵袭实验:稀释液与基底胶质按7∶1体积混合,吸取8 μl的Matrigel覆盖于transwell小室微孔膜底部,37℃放置30 min,10%FBS的RPIM1640调整 T24 细胞的浓度为1×105, 含5%胎牛血清的培养基加入到下室中,上室加入培养的细胞, 37℃ 5%CO2培养,擦去癌细胞和基质胶,95%乙醇固定15 min;用1%的结晶紫染色30 min,PBS冲洗多余染料,放于高倍镜视野计数穿透细胞数。
1.3.6 细胞迁移实验:取转染48 h 的细胞,0.25%胰酶消化,RPIM1640培养基调整细胞浓度1×105,接种于6孔板中,37℃,5%CO2培养过夜。待细胞均匀融合于培养板底部,用一次性接种环画出无细胞区后划横线,采用磷酸缓冲液吸取划痕后脱落的细胞并进行拍照,实验分为3组:对照组、miR-205 inhibitors组、miR-205 mimics组。培养24 h后进行拍照,观察细胞迁移能力。
1.4 双荧光素酶报告基因测定 使用生物信息学网站Target Scan数据库预测PLCε可互补结合的微小RNA(microRNA,miRNA),以正常人基因组DNA为模板,采用PCR扩增含有miR-205、PLCε互补位点,构建至荧光素酶报告基因载体psi-CHECK中,记为野生型,同时构建突变型重组质粒mutant。将HEK293T 细胞按30%左右密度铺24孔板,分别将海肾荧光素酶质粒、miR-205及其阴性对照分别与野生型及突变型mutant共转染至HEK293T细胞。转染后24 h,根据双荧光素酶测定试剂盒说明书检测荧光素酶活性,萤火虫荧光素酶/海肾荧光素酶活性值即为报告基因活性。

2 结果
2.1 miR-205在膀胱癌组织和癌旁组织中的表达 qRT-PCR结果显示细胞癌组织中miR-205的表达量显著低于癌旁组织,差异有统计学意义(P<0.05)。见表1,图1。


类别miR-205相对表达量膀胱癌组织0.32±0.13癌旁组织 0.97±0.07t值39.376P值<0.001
2.2 miR-205 在转染后膀胱癌细胞系T24的表达 miR-205 inhibitors、miR-205mimics和空脂质体转染膀胱癌细胞系T24 后,RT-PCR检测结果显示miR-205 inhibitors组中miR-205的表达明显低于对照组(P<0.05),miR-205mimics组中miR-205的表达明显高于对照组(P<0.05)。提示成功构建miR-205沉默细胞株/过表达细胞株。见表2,图2。

图1 miR-205在膀胱癌组织和癌旁组织中的表达

表2 3组细胞中miR-205相对表达量

组别miR-205相对表达量对照组 1.04±0.05miR-205mimics组 2.87±0.11∗miR-205 inhibitors组0.15±0.02∗F值8.279P值<0.001
注:与对照组比较,*P<0.05

图2 RT-PCR检测miR-205在膀胱癌细胞T24中的表达
2.3 miR-205-对T24细胞侵袭能力的影响 miR-205 inhibitors组中穿透细胞数明显高于对照组(P<0.05),miR-205 mimics组中穿透细胞数低于对照组(P<0.05),提示miR-205能够抑制T24癌细胞侵袭能力。见表3,图3。


组别穿透细胞数/视野对照组 94±9miR-205mimics组 55±8∗miR-205 inhibitors组364±18∗F值65.298P值<0.001
注:与对照组比较,*P<0.05
2.4 miR-205对T24膀胱癌迁移能力的影响 miR-205 inhibitors组T24迁移率高于对照组(P<0.05),miR-205 mimics组T24迁移率明显低于对照组(P<0.05),提示miR-205能够抑制T24细胞的迁移能力。见表4,图4。


组别细胞迁移率(%)对照组 79.31±4.56miR-205mimics组 50.19±4.32∗miR-205 inhibitors组96.27±4.34∗F值83.212P值<0.001
注:与对照组比较,*P<0.05
2.5 miR-205对E-Cadhein、Vimentin、Slug蛋白的影响 Western blot检测结果显示miR-205 inhibitors组中上皮标志物E-Cadhein的表达明显低于对照组(P<0.05),间质标志物Vimentin、Slug的表达明显高于对照组(P<0.05),miR-205 mimics组上皮标志物E-Cadhein的表达明显高于对照组(P<0.05),间质标志物Vimentin、Slug的表达明显低于对照组,差异有统计学意义(P<0.05)。见表5,图5。

miR-205 mimics组对照组miR-205 inhibitors组
图3miR-205对膀胱癌细胞T24侵袭能力的影响(结晶紫染色×200)

图4 miR-205对T24迁移能力的影响(×100)


组别E-Cadhein相对表达量Vimentin相对表达量Slug相对表达量对照组 1.12±0.151.17±0.111.16±0.09miR-205mimics组 2.87±0.24∗0.23±0.07∗0.27±0.08∗miR-205 inhibitors组0.24±0.06∗3.98±0.21∗4.17±0.22∗F值13.26519.28724.314P值<0.001<0.001<0.001
注:与对照组比较,*P<0.05
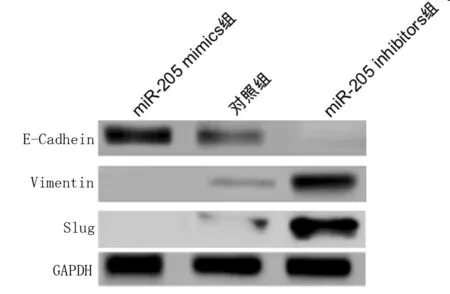
图5 miR-205对E-Cadhein、Vimentin、Slug蛋白的影响
2.6 荧光素酶实验结果 经Target Scan数据库分析发现PLCε和miR-205之间有互补结合序列,推测两者可能具有靶向调控关系。双荧光素酶报告基因结果显示,转染miR-205后,野生型PLCε的荧光素酶活性被抑制(P<0.05),突变型PLCε的荧光素酶活性无明显变化(P>0.05),证实PLCε和miR-205具有靶向调控关系。Western blot检测上调miR-205细胞系和空白细胞对照中PLCε结果表明,上调miR-205后,PLCε表达水平显著下降(P<0.05),证实miR-205可以特异性结合PLCε并发挥负向调控作用。见表6、7,图6、7。


组别荧光素酶活性相对表大量野生型突变型miR-205组0.56±0.091.54±0.17对照组 1.45±0.121.48±0.12t值13.2670.645P值<0.0010.535

图6荧光素酶时间检测miR-205与PLCε相互作用关系


组别PLCε相对表达量对照组 0.95±0.06miR-205mimics组0.29±0.08t值14.758P值<0.001

图7miR-205对PLCε表达的影响
3 讨论
膀胱癌为危害人类健康的的重要疾病之一,在我国的检出率和发病率呈递增趋势,研究显示,男性膀胱癌在所有恶性肿瘤中排第七位,其生物学行为复杂,易出现转移和复发,文献报道初发的膀胱癌约有1/3的患者出现局部进展和远处转移,其5年生存率较低,如何控制膀胱癌细胞组织浸润和转移是成为医学科研工作者不断探寻的课题[11-13]。
miRNA是一类广泛分布于哺乳动物细胞中的小分子RNA,通过碱基不完全互补的方式结合于靶基因上导致基因降解,从而抑制蛋白合成[14]。miR-205是由一段UCCUUCAUUCCACCGGAGUCUG编码的miRNA,文献报道称其在多种系中高度保守,且其在多种肿瘤细胞中发挥着抑癌或促癌的作用,但其在膀胱癌中的作用笔者尚未见有报道,本研究采用RT-PCR检测其在膀胱癌组织和癌旁组织中的表达,结果显示膀胱癌组织中miR-205表达水平明显低于癌旁组织,提示miR-205在膀胱癌可能起到抑癌的作用。
为进一步研究miR-205在膀胱癌侵袭与转移中的作用,本研究通过上调/下调miR-205观察T24细胞系侵袭迁移能力变化,Transwell结果显示miR-205 inhibitors组中穿透细胞数明显高于对照组,差异有统计学意义(P<0.05),miR-205 mimics组中穿透细胞数明显低于对照组,差异有统计学意义(P<0.05),提示miR-205能够抑制T24癌细胞侵袭能力。划线法结果显示miR-205 inhibitors组T24迁移率明显高于对照组,差异有统计学意义(P<0.05),miR-205 mimics组T24迁移率明显低于对照组,差异有统计学意义(P<0.05),提示miR-205能够抑制T24细胞的迁移能力。
EMT是上皮细胞受到癌细胞浸润转变为具有转移能力的间质细胞的过程,恶性肿瘤通过上皮间质化实现浸润、扩散、转移,因此EMT在癌症转移中具有重要的意义[15,16]。本研究采用Western blot检测上调/下调miR-205后上皮标志物E-Cadhein,间质标志物Vimentin、Slug的表达量,提示miR-205能够抑制T24癌细胞EMT进程,综合Transwell和划线法结果提示miR-205抑制膀胱细胞侵袭和转移可能是通过抑制EMT实现的。
PLCε位于人类染色体10q23,作为新发现的和肿瘤发生相关的基因,有报道其在膀胱癌中起到促癌的作用[17],且其表达水平与膀胱癌患者临床分期有关,有学者采用慢病毒干扰技术沉默其表达,发现膀胱癌细胞的增殖迁移能力检索,且EMT标志物也显著下调[18],本研究采用生物信息学预测显示miR-205和PLCε存在靶向结合区域,进一步的采用荧光素酶实验,验证了二者存在靶向调控关系,且miR-205能够负相调控PLCε。
综上所述,miR-205在膀胱癌中作为抑癌基因,能够靶向调控PLCε 抑制膀胱癌T24细胞EMT和迁移的作用。
