人参皂苷Rg3联合沉默MMP-9抑制乳腺癌肿瘤细胞的生长和转移
2020-05-28廖天志成宏
廖天志 成宏
乳腺癌是女性高危型性肿瘤之一,其发生率在女性肿瘤中居于首位[1]。另外,乳腺癌已经成为危害发达城市女性生命安全的第二大疾病,仅次于肺癌[2,3]。临床手术、放化疗、内分泌治疗、分子靶向治疗等手段在治疗乳腺癌中均有较明显的缺陷[4],因此,仍需积极探索乳腺癌发生发展机制,探寻更有效的抗癌药物和治疗方式。人参皂苷Rg3来源于名贵中药材人参,是一种已被多项研究确认具有明显抗肿瘤作用的人参活性单体成分,可抑制乳腺癌的增殖、迁移、耐药性,然而,越来越多研究发现Rg3可能和抗肿瘤西药结合使用具有良好的疗效[5-9]。另外,人参皂苷Rg3对于乳腺癌侵袭能力的抑制作用和机制的研究笔者所见较少。基质金属蛋白酶(MMP)-9可以调节包括乳腺癌在内的多种恶性肿瘤细胞的转移和组织血管生成[10-12]。而且,在甲状腺癌、结肠癌、肺癌、卵巢癌中人参皂苷Rg3均可通过抑制MMP-9等表达活性对此类肿瘤的转移和恶性发展发挥抑制作用[13-15]。有研究发现,在乳腺癌细胞中人参皂苷Rg3可抑制MMP-9的分泌[16]。然而到目前为止,人参皂苷Rg3是否通过调节MMP-9在乳腺癌中介导恶性发展还不清楚。本研究使用Rg3刺激体外高转移性乳腺癌细胞系MDA-MB-231,拟验明Rg3对高转移性乳腺癌细胞同样具有抗迁移和侵袭的作用,通过高表达MMP-9的研究Rg3抑制乳腺癌侵袭作用的下游分子机制,探讨人参皂苷Rg3联合沉默MMP-9基因对乳腺癌肿瘤生长和转移的作用,报告如下。
1 材料与方法
1.1 材料 高转移性乳腺癌细胞系MDA-MB-231购买于ATCC美国模式培养物保藏所。人参皂苷Rg3购买于上海纯优生物科技,MMP-9沉默载体MMP-9 siRNA的构建和MMP-9稳定低表达的MDA-MB-231细胞均购于上海吉玛公司公司,10%胎牛血清(fetal bovine Serum,FBS,10099-141)购买于美国Gibco BRL公司;Ki-67、CDK1、VEGF、Twist1、MMP-9、GAPDH蛋白抗体均购于美国Abcam公司,基质胶和Transwell 小室购于美国BD公司。CCK-8检测试剂盒购于美国MCE公司,DNA含量检测细胞周期试剂盒购于美国Solarbio公司,细胞凋亡检测试剂盒Cell Death Detection ELISAPLUS购于德国Roche公司。
1.2 细胞培养 MDA-MB-231的培养使用L-15培养基(其中含10% FBS)进行常规含有5%CO2的37℃培养箱培养。待形成细胞单层后使用0.25%胰蛋白酶消化传代,传代比例1∶3,并继续培养。供后续实验使用。
1.3 细胞转染和药物处理分组 细胞按照实验目的接种于合适的培养皿或者多孔板中进行处理,control组:无处理的MDA-MB-231细胞;Rg3组:单独0.1 mmol/L人参皂苷Rg3处理细胞;Rg3+pcMMP-9:Rg3和MMP-9过表达载体共处理组;Rg3+pcMMP-9-NC:Rg3和过表达空载体作为阴性对照组;Rg3+siMMP-9:人参皂苷Rg3(Rg3,0.1 mmol/L)联合沉默MMP-9;Rg3+siNC:人参皂苷Rg3(Rg3,0.1 mmol/L)联合沉默MMP-9的阴性对照组。
1.4 细胞划痕实验 各处理组细胞收集至48孔板。培养细胞至融合率达到80%,换成无血清培养基培养24 h。使用无菌200 μl吸管尖端行培养板内侧底部划痕,然后移除培养基,换成新鲜无血清培养基。用配有数码相机的Olympus IX70显微镜进行拍照,拍照时间为划痕后0 h及24 h。利用Image J 1.5软件计算划痕两侧的距离,测量划痕宽度变化。
1.5 Transwell细胞侵袭实验 Transwell侵袭实验按照供应商提供的实验步骤进行。上室底部铺Matrigel基质胶,使用前进行基底膜水化。上室接种不同处理组的细胞(浓度为1× 106/ml)0.5 ml。下室0.6 ml含10% FBS的DMEM培养基,再将小室放进培养板。培养24 h后,在上层和下层的测试容器中分别加入0.4%的台盼蓝,并进行风干,使用结晶紫对膜进行染色,在显微镜(200×)视野下选取5个区域对细胞迁移数量直接进行计数统计。
1.6 RT-qPCR 对各组细胞入适量的TRIzol试剂,严格按照说明书提取总RNA,采用反转录试剂盒将5 μg总RNA反转录为cDNA。然后用SYBR Green进行实时定量PCR,每组设置3个复孔,反应条件设置为:94℃ 5 min,57℃ 30 s,72℃ 30 s,共35个循环。GAPDH作为内参,目的基因的相对表达量采用2-ΔΔCt方法计算。
1.7 Western blot 用PBS清洗各组细胞3次,加入细胞裂解液于4℃反应15 min,4℃离心12 000 r/min,15 min。收集上清并测定各组样品的蛋白浓度。每个样品按照20 μg的上样量,于SDS-PAGE凝胶上分离蛋白,转膜,采用3%的脱脂牛奶于室温封闭2 h,4℃过夜孵育一抗,孵育辣根过氧化酶标记的二抗于室温反应1.5 h。最后,ECL发光显色,X线胶片曝光,采用ImageJ统计各条带灰度值。
1.8 CCK-8实验 各组细胞转入24孔板于37℃培养箱培养24 h;每孔加入10 μl CCK-8,37℃、5%CO2饱和湿度条件培养4 h;酶标仪测定各孔吸光值OD 450。细胞增殖活性率的计算:survival rate (%)= OD/OD0h×100%。
1.9 细胞周期实验 通过DNA含量的检测对细胞周期进行分析。对各处理组的细胞进行收集,随后对细胞进行碘化丙啶(Life Tecnologies)染色,使用FACS Calibur Flow Cytometer (BD Biosciences)流式细胞仪确定细胞周期并对G0/G1和S期的细胞中DNA含量变化,确定细胞周期并计算不同组间的差异。

2 结果
2.1 Rg3抑制高转移性乳腺癌细胞MDA-MB-231的迁移和侵袭及MMP-9的表达 与control组比较,Rg3组MDA-MB-231细胞的迁移率下调,差异有统计学意义(P<0.05),且Rg3组细胞的侵袭率亦下调,差异有统计学意义(P<0.05)。与control组比较,MMP-9的mRNA水平和蛋白水平均下调,差异均有统计学意义(P<0.05)。见表1,图1。


组别细胞迁移率(%)细胞侵袭率(%)MMP-9 mRNA水平相对表达量MMP-9蛋白水平相对表达量Control组72.49±3.7728.86±1.180.94±0.160.88±0.09Rg3组 48.11±2.32∗17.68±2.51∗0.56±0.09∗0.38±0.13∗
注:与Control组比较,*P<0.05


图1Rg3抑制乳腺癌细胞的迁移和侵袭及MMP-9的表达;A 细胞伤口愈合实验检测细胞迁移率的变化;B Transwell实验检测细胞侵袭率;MMP-9相对 mRNA(C)和蛋白(D)的表达变化
2.2 Rg3通过抑制MMP-9的表达负调控高转移性乳腺癌细胞的迁移和侵袭 与单独Rg3处理相比,Rg3+pc-MMP-9组的MDA-MB-231细胞的迁移率部分上调,差异有统计学意义(P<0.05),且Rg3组细胞的侵袭率同样增加,差异有统计学意义(P<0.05)。与control组相比,Rg3处理后VEGF和Twst1的蛋白水平都下调(P<0.05),与单独Rg3处理相比,VEGF和Twst1的蛋白水平部分恢复,差异有统计学意义(P<0.05)。Rg3下调MMP-9是其抗乳腺癌细胞的迁移和侵袭的关键机制之一。见表2,图2。


组别MMP-9 蛋白水平相对表达量细胞迁移率(%)细胞侵袭率(%)VEGF蛋白水平相对表达量Twist1蛋白水平相对表达量Control组0.25±0.0973.08±2.6126.75±2.640.85±0.060.83±0.08pc-NC组0.24±0.08pc-MMP-9组0.88±0.10Rg3组49.67±3.4319.56±1.920.22±0.070.23±0.07pc-MMP-9+Rg3组59.40±2.4323.19±3.070.34±0.050.31±0.02pc-NC+Rg3组49.99±6.8820.42±2.060.24±0.050.23±0.09∗P vs.control组<0.05<0.05<0.05<0.05<0.05#P vs.Rg3组<0.05<0.05<0.05<0.05
2.3 Rg3联合沉默MMP-9抑制高转移性乳腺癌细胞的增殖活性和G1/S周期进展 CCK-8结果发现,与单独Rg3处理组相比,Rg3处理和MMP-9沉默联合处理抑制乳腺癌细胞的增殖活性,差异有统计学意义(P<0.05),且Ki-67蛋白的表达在联合处理组中下调,差异有统计学意义(P<0.05)。其次,G1/S期进展研究结果发现,与单独Rg3处理组相比,Rg3处理和MMP-9沉默联合处理可抑制G1期细胞向S进展,差异有统计学意义(P<0.05)。且细胞周期依赖性蛋白CDK1的表达水平被下调,差异有统计学意义(P<0.05)。Rg3联合MMP-9沉默可明显抑制高转移性乳腺癌细胞的增殖活性和G1/S周期进展。见表3,图3。


图2Rg3联合MMP-9过表达调节乳腺癌细胞的迁移和侵袭;A MMP-9蛋白相对表达变化;*P<0.05 vs.control组,n=3;B 细胞迁移率的变化;C Transwell实验检测细胞侵袭率变化;VEGF(D)和Twist1(E)蛋白表达变化,#P<0.05 vs.control组,△P<0.05 vs.Rg3组,Rg3:人参皂苷Rg3;pc-MMP-9:MMP-9蛋白的真核表达载体pcDNA3.1(+)-MMP-9;pc-NC:pcDNA3.1(+)空载体作为阴性对照

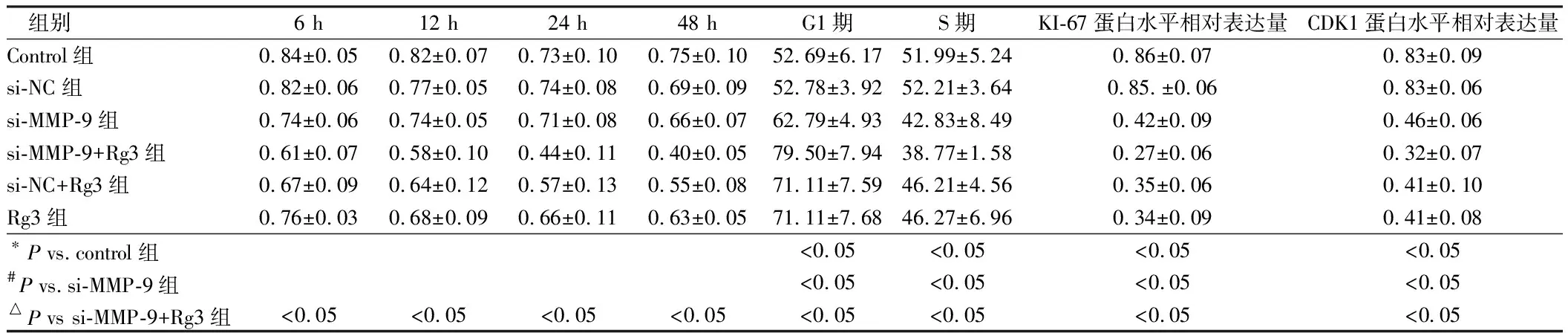
组别6 h12 h24 h48 hG1期S期KI-67蛋白水平相对表达量CDK1蛋白水平相对表达量Control组0.84±0.050.82±0.070.73±0.100.75±0.1052.69±6.1751.99±5.240.86±0.070.83±0.09si-NC组0.82±0.060.77±0.050.74±0.080.69±0.0952.78±3.9252.21±3.640.85.±0.060.83±0.06si-MMP-9组0.74±0.060.74±0.050.71±0.080.66±0.0762.79±4.9342.83±8.490.42±0.090.46±0.06si-MMP-9+Rg3组0.61±0.070.58±0.100.44±0.110.40±0.0579.50±7.9438.77±1.580.27±0.060.32±0.07si-NC+Rg3组0.67±0.090.64±0.120.57±0.130.55±0.0871.11±7.5946.21±4.560.35±0.060.41±0.10Rg3组0.76±0.030.68±0.090.66±0.110.63±0.0571.11±7.6846.27±6.960.34±0.090.41±0.08∗P vs.control组<0.05<0.05<0.05<0.05#P vs.si-MMP-9组<0.05<0.05<0.05<0.05△P vs si-MMP-9+Rg3组<0.05<0.05<0.05<0.05<0.05<0.05<0.05<0.05


图3Rg3联合MMP-9沉默调节乳腺癌细胞的增殖和细胞周期进程;A CCK-8检测细胞的增殖活性;#P<0.05 vs.control组,n=3;B Ki-67蛋白水平变化;C G1期细胞和S期细胞相对数目变化;(D)CDK1蛋白水平变化,*P<0.05 vs.control组,#P<0.05 vs.si-MMP-9组,△P<0.05 vs.si-MMP-9+Rg3组,Rg3:人参皂苷Rg3;si-MMP-9:MMP-9 siRNA沉默载体;si-NC:siRNA阴性对照
2.4 Rg3联合沉默MMP-9抑制高转移性乳腺癌细胞的迁移和侵袭 细胞划痕实验发现,与单独Rg3处理组相比,Rg3处理和MMP-9沉默联合处理可抑制乳腺癌细胞的划痕愈合能力,差异有统计学意义(P<0.05),Transwell细胞侵袭实验发现,与单独Rg3处理相比,Rg3处理和MMP-9沉默联合处理可以抑制细胞的侵袭率,差异有统计学意义(P<0.05)。且VEGF和Twist1的蛋白的表达水平均被下调,差异有统计学意义(P<0.05)。因此,Rg3联合MMP-9沉默可明显抑制高转移性乳腺癌细胞的迁移和侵袭。见表4,图4。


组别细胞迁移率(%)细胞侵袭率(%)VEGF蛋白水平相对表达量Twist1蛋白水平相对表达量Control组74.27±4.2927.36±2.170.90±0.050.94±0.08si-NC组74.73±6.6127.33±2.950.89±0.120.93±0.14si-MMP-9组55.08±7.2619.99±2.900.34±0.060.33±0.09si-MMP-9+Rg3组37.72±5.1114.69±4.390.27±0.120.25±0.09si-NC+Rg3组51.49±4.4522.94±4.100.36±0.090.38±0.08Rg3组51.28±3.4822.78±5.330.36±0.080.38±0.09∗P vs.control组<0.05<0.05<0.05<0.05∗P vs.si-MMP-9组<0.05<0.05<0.05<0.05△P vs si-MMP-9+Rg3组<0.05<0.05<0.05<0.05


图4Rg3联合MMP-9沉默调节乳腺癌细胞的迁移和侵袭;A 伤口愈合实验检测细胞迁移率的变化;B Transwell实验检测细胞侵袭率变化;VEGF(C)和Twist1(D)蛋白表达变化;#P<0.05 vs.control组,*P<0.05 vs.control组,#P<0.05 vs.si-MMP-9组,△P<0.05 vs.si-MMP-9+Rg3组,Rg3:人参皂苷Rg3;si-MMP-9:MMP-9 siRNA沉默载体;si-NC:siRNA阴性对照
3 讨论
MDA-MB-231细胞是一种恶性程度较高的人乳腺癌细胞,具有高转移性和高增殖活性[17]。人参皂苷Rg3可抑制多种恶性肿瘤细胞的增殖活性并抑制凋亡,其中就包括乳腺癌细胞MDA-MB-231[5,18]。而且最新研究发现人参皂苷Rg3可抑制MDA-MB-231细胞的迁移能力[18]。然而,到目前为止Rg3对于乳腺癌细胞的侵袭能力的影响并不明确。本研究结果发现,Rg3不仅抑制MDA-MB-231细胞的划痕愈合能力,而且可抑制MDA-MB-231细胞的侵袭能力。因此,Rg3不仅明显抑制MDA-MB-231细胞的增殖和迁移,而且对MDA-MB-231的侵袭性同样具有明显的抑制作用。表明人参皂苷Rg3是一种潜在的抗恶性乳腺癌细胞侵袭的药物。
MMPs介导基膜和细胞外基质降解和细胞迁移等过程[19]。而且,MMP9是最关键的肿瘤分泌MMPs之一,在基膜Ⅵ胶原和其他基质蛋白的降解过程中发挥重要作用[20]。有研究表明Rg3在抑制黑素瘤细胞的肺转移过程中,同样抑制了MMP-9的表达[21],同样的结果在结肠癌细胞HT-29中被验证[22]。本研究发现Rg3同样可以抑制乳腺癌MDA-MB-231细胞中的MMP-9的mRNA和蛋白水平的表达。更重要的是,本研究发现过表达MMP-9明显逆转Rg3对该乳腺癌细胞侵袭作用的抑制效果。因此表明Rg3可通过下调MMP-9的表达抑制高转移性乳腺癌细胞的侵袭能力。
中药联合基因治疗是中西医结合的治疗方法之一,已被运用于许多病症的基础与临床研究。在治疗肺癌恶性胸水的研究中,王维等使用攻癌利水散的外敷并联合重组的p53基因腺病毒胸腔灌注进行治疗[23]。对原发性肝癌的中西医治疗也得到良好的治疗效果[24]。更重要的是,研究发现沉默MMP-9可以抑制多种肿瘤细胞的生长,包括胃癌细胞[25]、白血病单核细胞[26]、黑色素瘤细胞等[27]。本研究同样发现单独沉默MMP-9对乳腺癌细胞的增殖和细胞周期进程具有明显的抑制作用,而且沉默MMP-9联合Rg3处理对高侵袭性乳腺癌细胞的增殖活性和细胞的周期进展的抑制效果均高于单独沉默MMP-9。肿瘤的中西医联合治疗方式在多种报道中已经表明,其效果均优于单独治疗。重组人血管内皮抑制素联合Rg3处理乳腺癌细胞可以抑制乳腺癌肿瘤小鼠的瘤生长,这种抑制效果明显优于单独Rg3或单独使用重组人血管内皮抑制素处理[28]。另外,Rg3和多种抗肿瘤西药联合使用对多种肿瘤细胞的生长和血管生成均具有较好的抑制效果[29,30]。而且,研究发现MMP-9沉默抑制多种癌细胞的侵袭和迁移[31]。而本研究结果同样发现,Rg3联合MMP-9基因沉默对细胞侵袭和迁移具有更明显的抑制作用。另外,相比单独沉默MMP-9,siRNA联合沉默MMP-9和FAK基因可以明显抑制高转移性小鼠黑色素瘤细胞B16F10的侵袭和迁移[27]。
综上所述,中药单体Rg3联合MMP-9敲减可能是西医结合治疗乳腺癌的有效方法之一。仍需进一步在体内实验进行反复验证,为乳腺癌等多种肿瘤治疗方法提供新的思路。
