白术胚轴和胚根直接分化不定芽的再生体系
2020-05-23梁玉玲鲜于梁艳刘雯雯张媛媛
梁玉玲,鲜于梁艳,刘雯雯,张媛媛
(1.河北大学 生命科学学院,河北 保定 071002;2.河北省生物工程技术中心,河北 保定 071002)
白术AtractylodesmacrocephalaKoidz.,属菊科苍术属多年生草本植物,为常用中药材,其主要药用成分为苍术酮、倍半萜内酯等挥发油类,具有健脾益气、燥湿利水、止汗、安胎[1]以及抗肿瘤[2]和调节胃肠道功能的功效[3].目前野生白术资源濒临灭绝,市场上所用的生药材大部分来自人工种植白术,而人工栽培白术需经过繁琐的、长时间的育苗过程[4].利用组织培养快繁技术可在较短时间内得到大量白术试管苗来满足白术的标准化生产种植.国内关于白术离体植株再生的报道并不多,主要集中在利用白术侧芽、叶片、茎尖或根状茎萌发的幼芽作为外植体进行其离体快繁[5-8],但增殖率不高,且经过愈伤组织的器官发生易产生体细胞遗传变异,影响再生植株的品质稳定.本研究利用白术胚轴、胚根幼嫩外植体诱导其直接分化芽,再诱导芽生根,建立离体植株再生体系.为药用植物白术的工厂化育苗和脱病毒以及利用植物基因工程技术进行品质改良提供了有效的再生途径.
1 材料与方法
1.1 实验材料
白术AtractylodesmacrocephalaKoidz.种子购自河北安国药材市场.
1.2 培养基
以MS(Murashige and Skoog)为基本培养基,添加不同的生长调节剂组合,其中,芽诱导培养基为MS+TDZ(thidiazuron)1.0 mg/L,MS+6-BA(6-benzyladenine) 1.0 mg/L,MS+ NAA(naphthylacetic acid) 0.2 mg/L +TDZ(0.2,0.5,1.0,1.5,2.0) mg/L和MS+TDZ 1.5 mg/L+NAA(0.2,0.5,1.0,1.2) mg/L;生根诱导培养基为1/2 MS+NAA 0.5 mg/L和1/2 MS+IBA(indol 3-butiric acid) 0.5 mg/L.培养基中添加蔗糖和琼脂,使其质量分数分别为3%和0.8%,pH 5.8,121 ℃高压灭菌15 min.
1.3 实验方法
1.3.1 无菌幼苗的获得
选取粒大、饱满的种子,用流水冲洗干净,体积分数75%酒精浸泡1 min后,采用2步法消毒,即去除种皮前用质量分数0.1%的HgCl2浸泡种子10 min,无菌水冲洗3~5次,无菌水中浸泡6 h后,剥去种皮;再用质量分数1.5%的NaClO消毒10 min,无菌水冲洗3~5遍.消毒后的种子,接种于无附加生长调节剂的MS培养基中,于25 ℃黑暗处培养,待种子萌发后转移至光下继续培养.
1.3.2 不定芽的诱导分化与增殖
待种子萌发后继续培养1周,株高2~3 cm时取出,分别切取胚根、胚轴、子叶和第1片真叶作为外植体,切成0.3~0.5 cm,分别接种至1.2中芽诱导培养基上诱导不定芽的分化.将诱导分化培养4周后的分化不定芽继续培养于筛选出的最适芽分化培养基中进行增殖培养.
1.3.3 生根诱导
将生长健壮的2~3 cm长的绿芽,转接至1/2 MS+NAA 0.5 mg/L或1/2 MS+IBA 0.5 mg/L的生根培养基中,诱导生根.
1.3.4 培养条件
植物材料光照培养条件为(25±2) ℃,光照12 h/d,光照强度3 000 lx;暗培养条件为(25±2) ℃,黑暗.
1.3.5 数据统计
芽分化率=分化芽外植体数/接种外植体总数×100%;外植体平均分化芽数=分化芽数/分化芽外植体数;愈伤组织诱导率=产生愈伤组织的外植体数/接种外植体总数×100%;生根率=生根芽数/接种芽总数×100%.使用软件SPSS 22.0对实验结果进行误差和显著性分析.
1.3.6 再生植株的移栽
将已经生根且生长状态良好的试管苗,打开培养瓶盖,培养间中炼苗2~3 d后小心取出试管苗,洗净培养基,移栽至装有灭菌基质(蛭石、砂和营养土质量比为1∶1∶1)的小钵中,浇透水,薄膜覆盖保湿,注意通风和保持适宜的温度.
2 结果与分析
2.1 6-BA和TDZ对白术不同类型外植体分化不定芽的影响
白术不同外植体在添加不同种类细胞分裂素(1 mg/L TDZ或1 mg/L 6-BA)的MS培养基中分化不定芽的效果不同.在培养初期(3~5 d),上胚轴和胚根外植体在切口处明显膨大,颜色为鲜艳的黄绿色,而子叶和真叶外植体切口部位没有明显的膨大且大部分切口颜色变暗;培养2周以后在膨大的胚轴和胚根处开始出现绿色芽点,继续培养至4周时,胚根和胚轴外植体均从外植体上直接分化出了不定芽,没有明显的愈伤组织产生(图1a,b),而子叶和真叶外植体在相同的培养基中均没有出现不定芽分化,只有少量愈伤组织产生.不同种类细胞分裂素对不定芽分化率的影响不同,胚轴在含有1 mg/L TDZ的培养基中不定芽分化率为66.63%,在1 mg/L 6-BA时为63.33%;胚根在含有1 mg/L TDZ的培养基中芽分化率为50.00%,在1 mg/L 6-BA时为26.67%;每个外植体分化不定芽2~5个,其中胚根在2种不同的培养基中的不定芽分化数目有极显著的差异(P<0.01);胚轴在MS+1 mg/L TDZ培养基上分化芽5个,在2种培养基中的不定芽分化数目差异不明显(P>0.05)(表1).与添加6-BA相比,无论是胚轴外植体还是胚根外植体,添加TDZ的培养基中芽诱导率较高,产生不定芽较多,表明TDZ诱导白术外植体产生不定芽的效果更好.
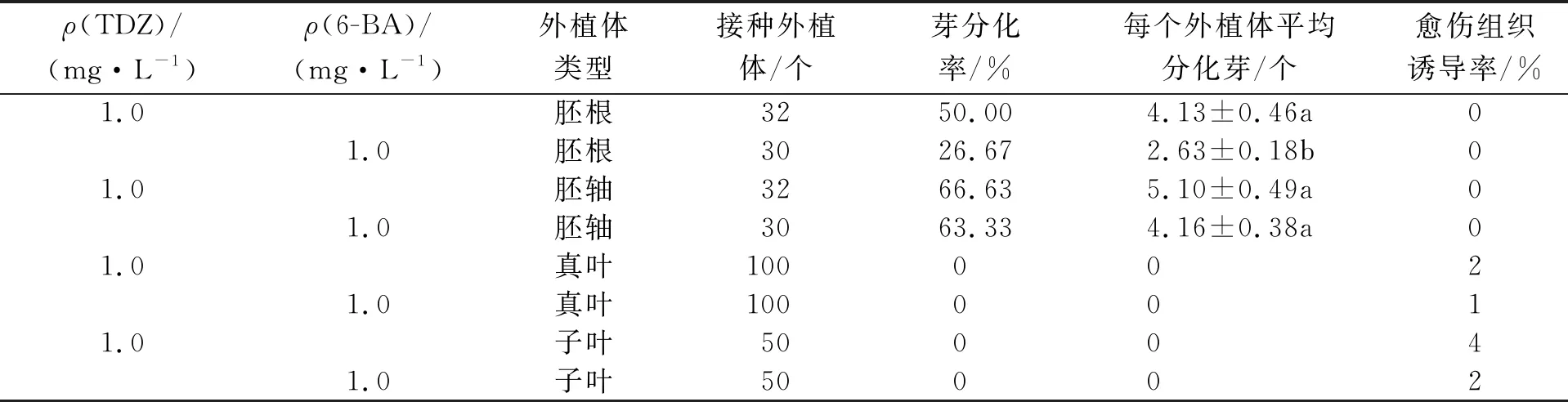
表1 细胞分裂素TDZ和6-BA对白术不同外植体分化不定芽的影响
不同小写字母表示差异显著(P<0.01) .
2.2 不同质量浓度TDZ与0.2 mg/L NAA组合对白术不同外植体分化不定芽的影响
在0.2 mg/L NAA条件下,考察不同质量浓度TDZ对白术胚轴和胚根外植体不定芽分化的影响.胚轴和胚根在不同质量浓度TDZ分化培养基上均有不定芽分化,培养30 d后统计芽分化率和芽数(表2).观察不定芽的分化情况发现,外植体在培养1周以后切口部位开始肿胀,但没有明显的愈伤组织产生,培养2周出现芽原基突起,之后不定芽直接由伤口部位及其附近部位产生.胚根和上胚轴外植体不定芽分化率和不定芽数均受到不同TDZ质量浓度的显著影响(P<0.01).当TDZ质量浓度为0.2~1.5 mg/L时,胚根外植体芽分化率为15.38%~68.30%,平均不定芽为(3.58±1.62)~(7.95±1.72)个;胚轴外植体芽分化率为84.38%~91.18%,平均不定芽为(4.11±1.96)~(13.13±2.75)个.2种外植体不定芽分化率均在TDZ质量浓度为1.5 mg/L时最高,TDZ质量浓度为2.0 mg/L时最低;不定芽数在TDZ质量浓度为1.5 mg/L时最高,0.2 mg/L时最低.在相同TDZ质量浓度下,上胚轴外植体的不定芽分化率和每个外植体平均分化芽数均高于胚根外植体.在实验中,将不同质量浓度TDZ培养基中培养30 d后分化不定芽少于3个的胚轴和胚根外植体转接入MS+1.5 mg/L TDZ+0.2 mg/L NAA培养基中继续培养30 d后,平均分化芽分别提高至(15.67±1.53)个和(7.52±1.34)个.
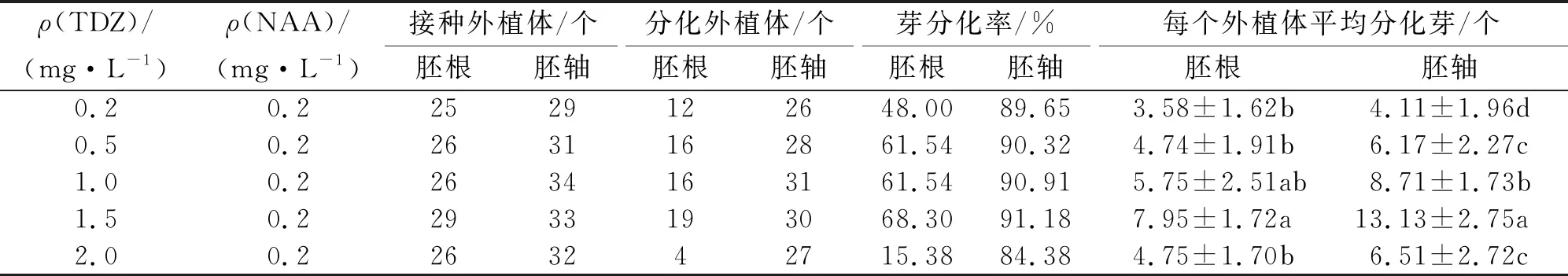
表2 不同质量浓度TDZ与0.2 mg/L NAA组合对白术胚根和上胚轴分化不定芽的影响
不同小写字母表示差异显著(P<0.01) .
2.3 不同质量浓度NAA与1.5 mg/L TDZ组合对白术不同外植体分化不定芽的影响
选定 TDZ质量浓度 1.5 mg/L与不同质量浓度NAA进行组合,研究不同质量浓度NAA对白术胚根和下胚轴2种外植体不定芽分化的影响.NAA质量浓度为0.2~1.2 mg/L时,随着NAA质量浓度的增加,2种外植体的不定芽分化率以及不定芽数都逐渐减小,不同NAA质量浓度之间存在显著差异(P<0.01)(表3).结果表明,NAA质量浓度的增加会逐渐抑制白术胚根和上胚轴外植体不定芽的分化,同时,较高质量浓度的NAA还会促进愈伤组织的形成(数据略).

表3 不同质量浓度NAA与1.5 mg/L TDZ组合对诱导白术胚根和胚轴分化不定芽的影响
不同小写字母表示差异显著(P<0.01) .
2.4 不定芽诱导生根与移栽
当分化的不定芽长至2~3 cm时,将其成簇切下,接种至1/2 MS+IBA 0.5 mg/L和1/2 MS+NAA 0.5 mg/L中诱导生根.培养20 d左右,在芽的基部接触培养基的部分出现根原基,25 d开始生根,培养40 d后根长可达2~3 cm(图1c).在1/2 MS+IBA 0.5 mg/L培养基中,生根率为66.66%,在1/2 MS+NAA 0.5 mg/L 培养基中,生根率为31.03%.在含IBA的培养基中再生根更加粗壮,生根后的再生植株叶片绿色并逐渐伸展变大.待白术再生植株根长至2~3 cm 时,经炼苗2~3 d后,移栽至土壤基质中(图1d),移栽7 d后统计试管苗的成活率可达85% 以上.在诱导生根实验中尝试了将成簇的不定芽分离成单芽接种至相同培养基中,培养3~4周后芽变黄枯萎,没有根长出,原因尚需进一步研究.

a.胚根外植体分化不定芽;b.上胚轴外植体分化不定芽;c.具根的再生植株;d.再生植株移栽.图1 白术不定芽分化与植株再生Fig.1 Adventitious shoot differentation and plant regeneration for Atractylodes macrocephala in vitro
3 讨论
本研究利用无菌幼苗胚轴和胚根作为外植体建立了直接诱导不定芽分化的白术离体再生体系,2种外植体在MS+TDZ 1.5 mg/L +NAA 0.2 mg/L中不定芽分化率分别为91.18%和68.30%,每个外植体分化芽为(13.13±2.75)个和(7.95±1.72)个,不定芽在1/2 MS+IBA 0.5 mg/L培养基中生根,生根率66.66%.白术是重要的药用植物,其干燥的根茎作为药材使用.有研究者报道以白术叶片、叶柄、茎段、胚轴为外植体经过愈伤组织诱导再生芽以及以茎尖、腋芽为外植体促进芽原基伸长及丛生芽产生进行白术的离体快速繁殖.朱玉球等[9]以白术叶片和叶柄为外植体诱导愈伤组织再生芽分化,在添加不同激素配比MS培养基上,愈伤组织诱导率分别为8.3%~67.4%和17.6%~89.6%,分化率分别为5.4%~42.5%和6.3%~21.7%.陈娟等[7]以白术叶片为外植体经诱导愈伤组织再生植株建立再生体系,其愈伤组织诱导率可达96.7%,芽分化率为90%.在这2则报道中都是经愈伤组织再生芽,前者报道的芽分化率最高为42.5%,腋芽增殖倍数最高4.35[9].后者中愈伤组织分化率最高达90%,但是同时也指出愈伤组织容易褐化,用带腋芽原基的小块可以诱导出丛生芽,其增殖倍数最高达4.45[7].在植物离体培养中愈伤组织培养阶段容易产生褐化、体细胞变异等现象,且长期继代培养的愈伤组织还会出现分化能力和遗传稳定性降低等变化,所以诱导外植体直接分化不定芽是保持母体植株遗传稳定性的一个有效途径.在本研究中诱导白术胚轴和胚根直接分化不定芽,分化率高、每个外植体分化芽数多,且避免了愈伤组织培养阶段容易产生体细胞变异的现象,在一定程度上可以提高再生植株的遗传稳定性.胚轴分化率较胚根高,每个外植体上不定芽分化多,生长健壮,而且每个无菌幼苗的胚轴可以被切成4~6个外植体切段,减少了种子的消耗.利用胚轴作为外植体诱导直接分化芽在蜜桔Citrustangerina中也有报道,在MS附加6-BA和 NAA的培养基中蜜桔胚轴、子叶节能直接分化出芽,而茎尖则不分化[10].TDZ是一种新型的植物生长调节剂,具有很强的细胞分裂素活性,本研究中TDZ 1.5 mg/L结合NAA0.2 mg/L诱导芽的分化效果高于其他组合.在凤仙花Impatienswalleriana高效植株再生和转化体系建立中,利用TDZ结合6-BA诱导凤仙花子叶节直接分化芽的数量高达每个外植体167个[11].使用TDZ诱导高效离体再生在甘露子中也有报道[12],在白术离体再生中使用TDZ尚未见报道.本研究利用胚轴、胚根作为外植体直接分化不定芽,建立了白术高效再生体系,这一再生体系可用于白术的遗传转化,为利用植物基因工程技术改良白术品质提供技术保障,还可以用于白术工厂化育苗与脱病毒.
