苦丁皂苷L、苦丁皂苷N与牛血清白蛋白的相互作用研究
2020-05-21,*,*
,*,*
(1.长春工业大学化学与生命科学学院,吉林长春 130012; 2.吉林省中医药科学院,吉林长春 130012; 3.吉林农业大学中药材学院,吉林长春 130118; 4.吉林大学药学院,吉林长春 130021)
苦丁茶冬青(IlexkudingchaC.J.Tseng)为冬青科冬青属乔木植物,主产于广西、湖北、湖南、广东、海南等地,是药、饮兼用之名贵珍品。苦丁茶冬青含有五环三萜及苷类、黄酮、多酚、氨基酸、挥发油等多种化学成分[1-3],皂苷类化合物是其主要成分。研究表明,苦丁茶冬青具有降血脂、降血压、抗菌、消炎、增强和调节免疫功能等药理作用,目前临床上主要用于治疗高血压、高血脂、高血糖等疾病[4-5]。
血清白蛋白(SA)是血液中含量最丰富的蛋白质,能携带许多药物分子通过血浆储运到达受体部位产生药效,易与多种内外源物质结合,对药物的储存、转运有重要作用[6-7]。因此,确定药物与血清白蛋白的结合能力和类型等信息,对研究药物的药效学、药代动力学、药理学以及毒理学具有重要意义。牛血清白蛋白(BSA)与人血清白蛋白(HSA)结构与功能性质相似[8-9],所以人们长期研究药物与BSA的结合情况,作为对HSA结合情况的参考。
苦丁茶苯丙素苷类与蛋白质相互作用研究已有文献报道[10],苦丁茶皂苷类成分与BSA相互作用未见报道。本文采用荧光光谱法和圆二色谱法对苦丁茶皂苷类成分与BSA相互作用进行研究,有助于了解其在体内与HSA结合和转运的过程,在分子水平上认识苦丁茶皂苷类成分与HSA相互作用机理提供实验依据,对苦丁茶皂苷类成分的研究与开发提供科学的理论和实验基础。
1 材料与方法
1.1 材料与仪器
苦丁皂苷L(kudinoside L)、苦丁皂苷N(kudinoside N) 均为实验室自制,纯度≥98%;牛血清白蛋白(≥98%,Mr=68000) Sigma-Aldrich9(上海)贸易有限公司;乙腈、甲醇 色谱纯,美国TEDIA公司;pH=7.4 Na2HPO4-NaH2PO4缓冲溶液;水 超纯水;其他试剂 均为国产分析纯。
LC-20A型高效液相色谱仪、SPD-M20A二极管阵列检测器、RF-5301荧光光谱仪、MOS-450圆二色谱仪 日本岛津公司;BT-25S电子分析天平 德国赛多利斯公司;Pos-D微量移液器 美国Rainin公司;ZD-600A恒温循环槽 上海精科仪器厂。
1.2 实验方法
1.2.1 kudinoside L、kudinoside N分离纯化及鉴定 将干燥的苦丁茶冬青叶7.5 kg粉碎,加入8 BV的70%乙醇浸提3次,每次5 d,合并提取液,减压浓缩成浸膏。依次用石油醚(3×4 L)、乙酸乙酯(3×4 L)、水饱和正丁醇(3×4 L)萃取:将流体状浸膏转入分液漏斗中,先加入4 L萃取剂充分振摇,静置分层,收集萃取部分(石油醚部分弃去),萃取3次,合并萃取液;再在流体状浸膏中加入下一萃取剂同样方法重复萃取3次。将各萃取部位减压浓缩、低温蒸干后,粉末固体过100目筛。各萃取部位分别得到固体:乙酸乙酯部(393 g)、正丁醇部(820 g)、剩余水部分(750 g)。取正丁醇萃取部位粉末100 g,经硅胶柱层析(二氯甲烷-甲醇=4∶1,50倍体积洗脱),收集洗脱部分,再经C18填料及半制备型高效液相分离。色谱条件:选用YMC-Pack C18柱,流动相乙腈-水二元梯度洗脱,0~15 min 30%乙腈,15~45 min 30%~50%乙腈,分析时间45 min,流速2 mL/min,柱温35 ℃,检测波长210 nm,进样量40 μL,分离得到化合物A、化合物B。化合物A、化合物B浓度:(样品峰面积/总峰面积)×100%。分别取10 mg化合物A、B,用0.5 mL氘代吡啶溶解后转移到核磁管中待测,通过1H-NMR、13C-NMR鉴定化合物是否为kudinoside L、kudinoside N。1H-NMR测定条件:测定温度298 K,频率600 MHz,谱宽33333 Hz;13C-NMR测定条件:测定温度298 K,频率150 MHz,谱宽33333 Hz。
1.2.2 溶液制备 pH=7.4 Na2HPO4-NaH2PO4缓冲溶液:取19 mL 0.2 mol/L的NaH2PO4,81 mL 0.2 mol/L的Na2HPO4,加水稀释到1000 mL;1×10-5mol/L的牛血清白蛋白贮备溶液:称取6.8 mg BSA溶于10 mL磷酸缓冲溶液中,置于4 ℃冰箱中备用;将kudinoside L、kudinoside N溶于磷酸缓冲溶液中,配制成浓度为1×10-2mol/L贮备溶液,置于4 ℃冰箱中备用。
1.2.3 荧光光谱法测定 用移液枪精密吸取3 mL 1×10-5mol/L的BSA溶液加入到1 cm的荧光比色皿中,用微量注射器逐次加入浓度为1.0×10-2mol/L的kudinoside L、kudinoside N溶液,吹打混匀,累积加样总体积控制在0.1 mL内;利用恒温循环槽保持反应体系的温度(25和37 ℃),将激发波长设置为280 nm,在290~500 nm波长范围内进行荧光光谱检测。

1.2.4 圆二色谱测法测定 室温下,利用0.1 mm石英比色皿进行圆二色谱的测量。扫描参数:狭缝宽度1 nm,反应时间2 s,波长扫描范围190~250 nm,扫描速度1 nm/5 s,kudinoside L、kudinoside N与BSA的摩尔浓度比分别为13∶1、26∶1、39∶1、52∶1、65∶1,利用磷酸缓冲溶液作为参比,观察反应体系随着药物分子的加入,圆二色谱值的变化,并用平均残基摩尔椭圆率MRE来计算出BSA二级结构中的α-螺旋含量的变化[13]。
2 结果与分析
2.1 结构鉴定
对化合物A、化合物B进行1H-NMR、13C-NMR鉴定。综合化合物的核磁数据与文献[14-15]报道基本吻合,故化合物A、B鉴定为kudinoside L、kudinoside N,纯度分别为98.87%、98.03%,液相色谱结果如图1所示,核磁结果如图2所示,分子结构式如图3所示。

图2 kudinoside L、kudinoside N的1H-NMR、13C-NMR图谱Fig.2 1H-NMR and 13C-NMR NMRspectra of kudinoside L,kudinoside N
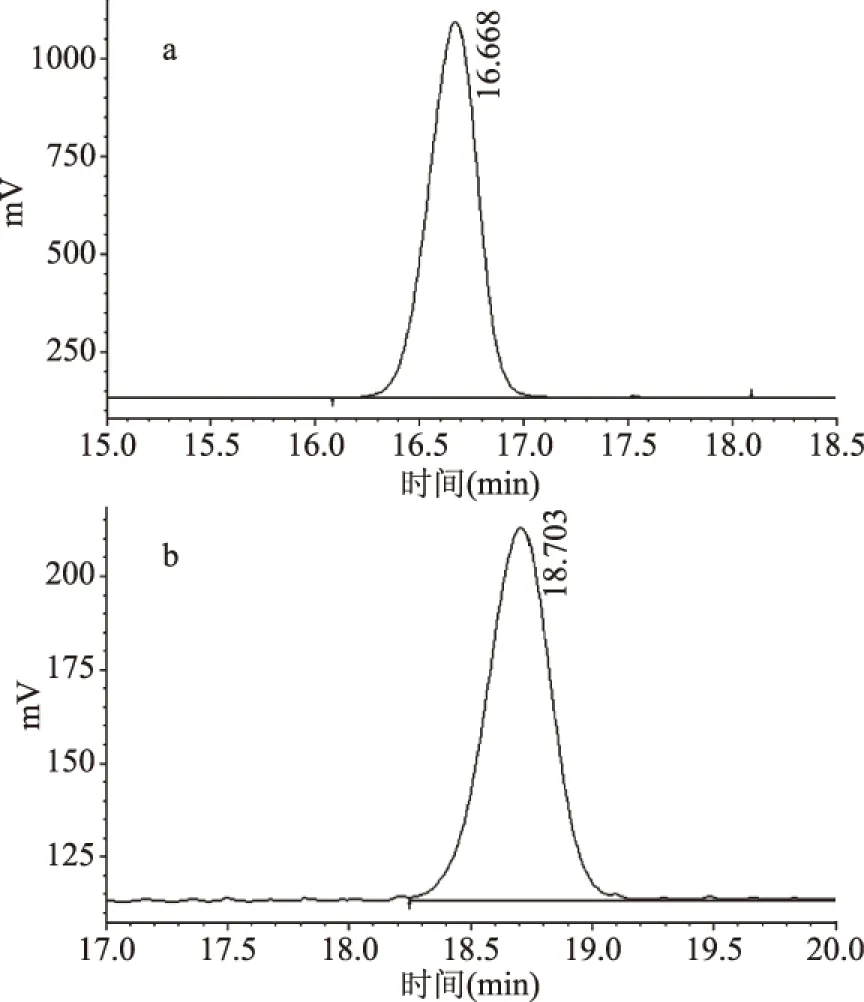
图1 kudinoside L、kudinoside N液相色谱图Fig.1 Liquid chromatogram of kudinoside L,kudinoside N注:a:kudinoside L,b:kudinoside N;图2同。
2.2 荧光光谱
荧光光谱能够提供小分子与蛋白的结合特征,如结合机制、结合模式、结合常数和结合位点数等参数。BSA中有三种内源荧光团,分别是色氨酸、酪氨酸和苯丙氨酸,但是BSA的荧光强度主要来源于色氨酸残基,而当激发波长为280 nm时,此时BSA的发射波长会在340 nm左右[16];而当小分子与BSA相互作用时,蛋白质的荧光可能会被猝灭。如图2所示,随着两种化合物的加入,BSA的荧光强度有规律地减少,在不同温度下(298、310 K),kudinoside L分别猝灭28.19%、33.23%,kudinoside N分别猝灭16.99%、19.93%,同时kudinoside L导致BSA的发射波长发生了微弱的蓝移,而kudinoside N的发射波长没有改变,提示kudinoside L与BSA相互作用后蛋白的生色基团疏水结构更紧密,肽链的伸展程度减少,疏水性增加[17]。
2.2.1 猝灭类型 根据Stern-Volmer方程可知,曲线如果呈线性,则说明猝灭过程为静态猝灭或动态猝灭。然而,当猝灭过程同时发生静态猝灭和动态猝灭时,Stern-Volmer的图将会呈现出一条向上弯曲的曲线。图5为不同温度下(298和310 K),由Stern-Volmer方程作出的关于kudinoside L、kudinoside N对BSA的猝灭图。表1列出了相互作用过程中的Stern-Volmer猝灭常数(Ksv)和双分子荧光猝灭常数(Kq)。依据文献[18],BSA的平均荧光寿命值为6.0×l0-9s。不同温度下,kudinoside L、kudinoside N对BSA的Stern-Volmer猝灭曲线如图5所示,Ksv、Kq值列于表1。

表1 不同温度(298、310 K)下的猝灭常数及猝灭速率常数Table 1 Quenching constant and quenching rate constant at different temperatures(298,310 K)

图5 不同温度下(298、310 K)kudinoside L、kudinoside N对BSA的Stern-Volmer猝灭曲线Fig.5 Stern-Volmer quenching curve of kdinoside L andkudinoside N to BSA at different temperatures(298,310 K)注:Q为猝灭剂的浓度;CBSA=2×10-5 mol/L。
由图3可知,kudinoside L、kudinoside N对BSA的Stern-Volmer猝灭曲线均为一条直线,说明两种药物分子与BSA相互作用存在单一猝灭类型,且随着温度的升高,速率常数Ksv上升,说明猝灭类型为动态猝灭[19]。在相同温度下,kudinoside L的Ksv值均比kudinoside N要大,因此kudinoside N比kudinoside L对BSA的荧光猝灭的程度要小。

图3 kudinoside L、kudinoside N分子结构图Fig.3 Molecular structure of kudinoside L,kudinoside N
2.2.2 结合常数及结合位点数的计算由log[(F0-F)/F]对log[Q]作图所得直线的截距和斜率可求得Ka和n。不同温度下,kudinoside L、kudinoside N的结合常数及结合位点数见表2。

图4 不同温度下(298、310 K)kudinoside L、kudinoside N对BSA荧光光谱的影响Fig.4 Effects of kudinoside L and kudinoside N on the fluorescence spectra of BSA at different temperatures(298,310 K)注:a→k:kudinoside L,kudinoside的体积=0、2、4、5、6、8、10、12、14、16、20 μL。
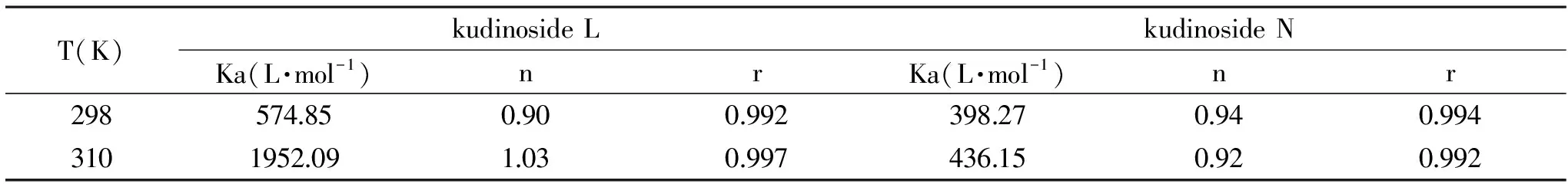
表2 不同温度(298,310 K)下的结合常数及结合位点数Table 2 Binding constants and number of binding sites at different temperatures(298,310 K)
从表2可以看出,kudinoside L、kudinoside N在与BSA的作用过程中,随着温度的升高,结合常数Ka均变大,再结合荧光分析的结果可知,kudinoside L、kudinoside N对BSA的猝灭类型是以动态猝灭为主,两个化合物分别与BSA各形成1个结合位点。
2.2.3 作用力类型 kudinoside L、kudinoside N在不同温度下,焓变(ΔH)、熵变(ΔS)和吉布斯自由能变化(ΔG)的相关参数见表3。
由表3可知,在kudinoside L、kudinoside N与BSA的相互作用过程中,ΔG<0,说明kudinoside L、kudinoside N与BSA的相互作用过程均是一个吉布斯自由能降低的自发的过程,而ΔH、ΔS均大于0,表明反应为熵驱动过程[20-21],由于小分子与BSA结合的过程中会发生去水化,同时BSA结合位点附近的水化层也会受到相应地破坏,这是吸热熵增明显的过程,该过程TΔS>ΔH,ΔG<0,吸热过程要强于放热过程,故两个化合物与BSA的主要作用力为疏水作用[22-23]。

表3 相关热力学参数Table 3 Related thermodynamic parameters
2.3 对BSA构象的影响
通过圆二色谱仪测定蛋白溶液的圆二色谱,可以了解蛋白质在溶液状态下的各种二级结构变化信息。蛋白质二级结构中的α-螺旋在圆二色谱中一般含有两个负峰,在222 nm处的负峰是由肽键中的n→π*所导致的,而在208 nm处的负峰则是由肽键中的π→π*所形成的[24]。β-折叠和无规卷曲分别在215和198 nm出现一个负峰。在测量蛋白圆二色谱时,常用平均残基摩尔椭圆率MRE来计算蛋白二级结构含量。圆二色谱曲线图以波长为横坐标,以椭圆度observed CD(mdeg)为纵坐标。kudinoside L、kudinoside N与BSA相互作用圆二色谱图如图6。

图6 不同浓度的kudinoside L、kudinoside N对BSA圆二色谱谱图的影响Fig.6 Effects of different concentrations of kudinoside Land kudinoside N on circular dichroism chromatograms of BSA
结合图6和表4可知,随着药物小分子浓度的增加,kudinoside L使得BSA的α-螺旋结构从60.80%增加到74.0%,β-折叠的含量从3.8%增加到13.9%,BSA内部二级结构正在发生从无规卷曲向α-螺旋结构和β-折叠含量增加的过程;kudinoside N使得BSA的α-螺旋结构从71.1%降低到64.8%,β-折叠的含量从0.6%增加到7.8%,β-转角的含量从6.3%增加到14.7%,无规卷曲含量从22.0%降低到11.3%,说明α-螺旋结构和无规卷曲向β-折叠和β-转角转变。

表4 BSA二级结构在不同浓度药物小分子作用下的变化Table 4 Changes of secondary structure of BSA under the action of small molecules of different concentrations of drugs
3 结论
荧光光谱法研究表明,kudinoside L、kudinoside N对BSA的猝灭类型为动态猝灭,作用力类型是疏水作用力。kudinoside N对BSA的荧光猝灭的程度和结合常数均比kudinoside L小,这可能与两者的结构差异有关。kudinoside N与kudinoside L母核结构一致,仅在C-28上多了一个鼠李糖基,糖链比kudinoside L长,药物分子更难插入到BSA内部的疏水腔中,增加了与BSA结合的难度。从药代动力学角度来说,结合常数小更有利于kudinoside N在的体内释放并缩短药物体内半衰期[25]。圆二色谱研究表明,随着kudinoside L浓度的增加,BSA二级结构中α-螺旋和β-折叠含量增加;随着kudinoside N浓度的增加,BSA二级结构中α-螺旋结构含量减少,β-折叠和β-转角含量则呈增加趋势。说明由于药物小分子各种作用力的作用,导致了BSA的二级结构发生改变。本文结果可为深入研究苦丁茶冬青中五环三萜类化合物与BSA的作用机理、探索药物分子构效关系提供有价值的信息,为设计和筛选药用效果更优的苦丁茶皂苷类成分药物提供实验依据。
