肠炎沙门氏菌yjeA基因缺失株的构建及其生物学功能测定
2020-05-18孔梓安吴竹青别鹏飞
曹 莉,孙 路,孔梓安,吴竹青,别鹏飞,王 真*
(1.北京农学院 动物科学技术学院,兽医学(中兽医)北京市重点实验室,北京 102206; 2.中国农业大学 动物医学院,北京 100193)
沙门氏菌属于革兰氏阴性菌兼胞内寄生菌,能够感染人与动物,肠炎沙门氏菌亚种鼠伤寒沙门氏菌(Salmonellaentericasubsp.entericaserovarTyphimurium)简称鼠伤寒沙门氏菌(S.Typhimurium)是一种肠道致病菌,具有广泛的宿主,是目前分离率最高的菌型之一,哺乳动物以及人类容易感染该沙门氏菌,容易引发全身性感染,在公共卫生方面有着重要意义[1]。
目前为止抗生素相关的抗菌药物的使用,使得沙门氏菌耐药性增加,构建沙门氏菌减毒疫苗成为了沙门氏菌主要预防和防治手段。沙门氏菌通过基因工程的方法进行减毒,对人和动物的致病力显著降低,并且可以保持良好的免疫原性[2]。目前已经多个与沙门氏菌毒力相关基因被检测出来,可以构建一系列毒力突变的减毒活疫苗。在S.Typhimurium中,20种氨基酸中除赖氨酸外的每一种都需要特异性的同源氨基酰基-tRNA合成酶。S.Typhimurium中yjeA基因编码沙门氏菌中第二种赖氨酰-tRNA合成酶。Kaniga[3-4]首次报道了yjeA基因突变对细菌毒力有影响,但未见系统关于S.TyphimuriumyjeA基因缺失作为疫苗候选株的报道,本研究以yjeA基因为目标基因,采用Red重组系统构建了基因缺失突变株,研究了其生长特性、细胞粘附力、侵袭力小鼠载菌量与免疫原性等,进而为开发更加安全有效的S.typhimurium弱毒疫苗奠定基础。
1 材料和方法
1.1 材 料
1.1.1 菌株和质粒 广东菌种保藏中心购入并由兽医学(中兽医)北京市重点实验室保存的沙门氏菌S.TyphimuriumATCC 14028s、大肠杆菌;由该实验室保存的质粒pKD46,pKD3,pCP20,以及互补质粒pBR322 。
1.1.2 细 胞 小鼠腹腔巨噬细胞J774A.1由中国农业大学吴清民教授实验室保存。
1.1.3 培养基、试剂和试验动物 北京擎科生物技术有限公司购买DNA凝胶回收试剂盒;在Biowest公司购买胎牛血清(FBS)。在维通利华有限公司购买的 SPF级 BALB/c小鼠,雌性,6~8周龄。
1.2 方 法
1.2.1 引物设计 沙门氏菌基因缺失株及互补株引物详见表1。
根据序列设计引物,详见表1。
1.2.2 沙门氏菌yjeA基因缺失株的构建 以pKD3为模板,F1、F2为引物扩增打靶基因片段,长度约为1 100 bp。用北京艾德莱有限公司质粒提取试剂盒提取质粒pKD46和pCP20。将提取的pKD46质粒电转入沙门氏菌S.typhimuriumATCC14028(ST)中(电压为1.8 kV)。电转后于复苏,将复苏菌液涂布于LB/Amp(LB培养基中加入浓度为100 μg/mL的氨苄青霉素)平板上,恒温培养挑取单菌落于液体培养基中,以该菌液为模板,F1、F2为引物进行PCR鉴定,选择阳性菌落保存。制备含有pKD46质粒的感受态细胞[5],将目的基因片段电转入上述感受态细胞,电转后复苏菌液涂布于LB/Cm(氯霉素浓度为34 μg/mL)平板上,恒温培养后挑取单菌落于进行培养,以该菌液为模板,以F3、F4为引物进行鉴定,选择阳性菌落进行保存。整合氯霉素抗性基因的阳性菌落于LB/Cm液体培养基中,进行pKD46质粒消除,使用整合自子制备感受态细胞,电转pCP20质粒,菌液涂布LB/Amp平板于过夜培养;挑取单菌落加入LB液体培养基中,进行pCP20质粒消除。用引物F3、F4检测氯霉素抗性基因是否消除,目标基因是否缺失,构建成功的yjeA基因缺失株命名为SMΔyjeA。

表1 PCR扩增所用引物Tab.1 The primer sequences for PCR amplification
1.2.3SMΔyjeA互补菌株的构建 以亲本菌株为模板,F5、F6为引物进行yjeA基因序列扩增,提取pBR322质粒,将纯化的基因产物以及质粒进行酶切连接转化,选取LB/Amp平板上生长的单菌落增殖后鉴定阳性互补质粒。制备沙门氏菌yjeA基因缺失株感受态细胞,电转互补质粒,挑取LB/Amp平板上生长的单菌落,PCR鉴定,将阳性菌命名为SMCyjeA。
1.2.4SMΔyjeA生长特性测定 为测定沙门氏菌SM、SMΔyjeA生长特征,取单菌落于10 mL LPM液体培养基中,37 ℃ 200 r/min震荡培养,每隔2 h取样,检测OD600值,绘制生长曲线。
1.2.5 细胞感染试验 将过夜培养的SM、SMΔyjeA、SMCyjeA滴板计数,感染巨噬细胞,室温离心培养20 min;弃掉培养液,加入含50 μg/mL庆大霉素的2%维持培养液继续培养,分别于不同时间点取样,裂解细胞,测定各菌株侵染细胞和在细胞内的生存能力。
1.2.6 SMΔyjeA小鼠体内毒力测定 胞内寄生病原菌,在机体内脏器载菌量及体内增值存留时间,是评价毒力的一个重要标准,详见文献[6]。选购BALB/c小鼠分别腹腔注射SM、SMΔyjeA,SMCΔyjeA,注射后记录小鼠死亡情况并分别于7 d、14 d和21 d选取小鼠处死,进行脏器载菌量测定。
1.2.7 SMΔyjeA免疫原性检测 挑取SMΔyjeA菌液超声破碎离心上清液为包被抗原,测定其浓度;将制备好的抗原用包被液的倍比稀释,放置于4 ℃包被过夜进行酶联免疫吸附试验。阳性血清和阴性血清倍比稀释加入到反应板中,确定抗原最佳包被浓度和血清最佳稀释度。
将BALB/c小鼠随机分为2组,免疫组将SMΔyjeA腹腔注射小鼠,对照组腹腔注射灭菌PBS,取血并分离血清,免疫组和对照组分离的血清为一抗,兔抗鼠二抗购于北京博奥龙免疫技术有限公司,用间接ELISA对血样进行检测,记录血液抗体的动态变化。
2 结果与分析
2.1 沙门氏菌yjeA基因缺失株筛选与鉴定的结果
以F3、F4作为引物,扩增氯霉素抗性基因替换株、目标基因缺失株和野生菌株,分别观察到不同大小的条带∶氯霉素抗性基因条带为1 100 bp、基因缺失株SMΔyjeA条带为160 bp,SM条带为980 bp。如图1,结果表明成功构建出沙门氏菌基因缺失株SMΔyjeA。
2.2 沙门氏菌SMΔyjeA互补菌株筛选与鉴定的结果
用F5、F6为引物,以野生菌株、基因缺失株、互补菌株为模板,检测目标基因缺失株、亲本株和互补菌株,分别观察到条带如图(图2):亲本菌株条带为980 bp、基因缺失株条带为160 bp、互补菌株条带分别为980 bp与160 bp,结果表明成功构建出沙门氏菌yjeA基因缺失株互补菌株即SMCyjeA。
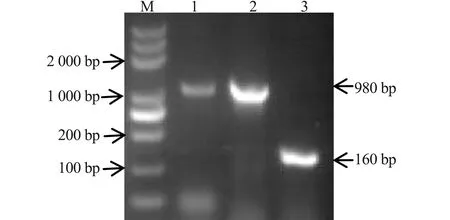
M.DL5000;1.氯霉素抗性基因替换株;2.yje A基因缺失株;3.野生菌株图1 缺失株SMΔyjeA株PCR鉴定 M.DL5000;1.Chloramphenicol-resistant gene substitutes;2.yjeA gene deleted strain;3.Wild strainsFig.1 Identification of deleted SM yjeA strain by PCR
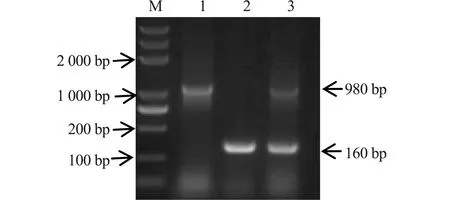
M.DL5000;1.亲本菌株;2.yjeA基因缺失株;3.yjeA基因缺失株互补菌株图2 缺失株SMΔyjeA株PCR鉴定 M.DL5000;1.Parent strains;2.yjeA gene deleted strain;Complementary strains with 3.yjeA gene deletionFig.2 Identification of deleted SM yjeA strain by PCR
2.3 生长特性观察结果
将SM、SMΔyjeA经LPM培养基37 ℃震荡培养,在不同时间点分别取样,测定OD值,以时间为横轴,OD600为纵轴绘制生长曲线如图3所示,培养6 h后,基因缺失株SMΔyjeA培养液OD值略低于亲本菌株SM,差异略显著。说明,yjeA基因的缺失对沙门氏菌SMΔyjeA的正常生长略有影响。
2.4 细胞侵袭试验和黏附试验结果
将SM、SMΔyjeA、SMCyjeA以MOI为10的剂量感染巨噬细胞,感染后在不同时间点取样,进行胞内活菌计数,如图4-5所示,感染1 h时,3株菌胞内载量分别为1.9×105、6.25×104、1.45×105(LOG10为5、4、5)。SMΔyjeA与SM相比降低0.5个数量级;感染4 h开始,SM和SMCyjeA在胞内大量增殖,16 h后胞内细菌量达到4×106(LOG10为6),而SMΔyieA增殖速度缓慢,12 h时胞内细菌数量逐渐减少,比SM降低1.5个数量级。由此表明,yjeA基因的缺失影响了沙门氏菌胞内生存能力,对侵袭力影响不大,并不影响粘附力,沙门氏菌基因缺失株SMΔyjeA会在胞内被缓慢的杀死。
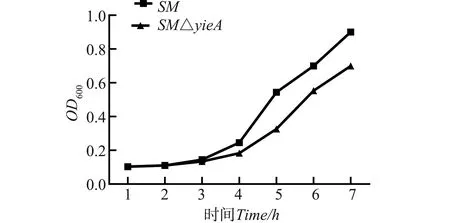
图3 基因缺失株SMΔyjeA与亲本株SM的生长特性Fig.3 Growth of SMΔyjeA and its parent SM
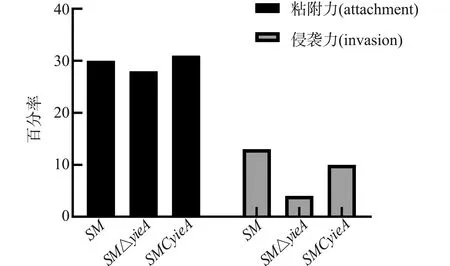
图5 细胞黏附力和侵袭力测定结果Fig.5 Results of cell adhesion and invasiveness
2.5 小鼠体内毒力试验结果
为了研究yjeA基因对沙门氏菌毒力的影响,将SM、SMΔyjeA、SMCyjeA以相同剂量接种小鼠,观察小鼠死亡情况,同时测定了感染不同时间点的脏器载菌量。结果如图6所示,接种SM和SMCΔyjeA的小鼠在14 d内全部死亡,接种SMCyjeA的小鼠21 d的存活率为100%;接种7 d后脾脏与肝脏载菌试验结果表明,接种SM的小鼠肝脏脾脏载菌量均高于接种SMΔyjeA的小鼠近2个数量级;14 d时,与SM相比,基因缺失株SMΔyjeA在肝脏、脾脏的菌量分别为105和104CFU(LOG10为4和5),低于接种SM的小鼠近4个数量级;接种14 d后,基因缺失株SMΔyjeA的肝脏和脾脏的载菌量在缓慢降低,在第21天降低为102CFU(LOG10为2 )。以上结果表明,yjeA基因与沙门氏菌毒力相关,敲除yjeA基因使得沙门氏菌毒力降低。
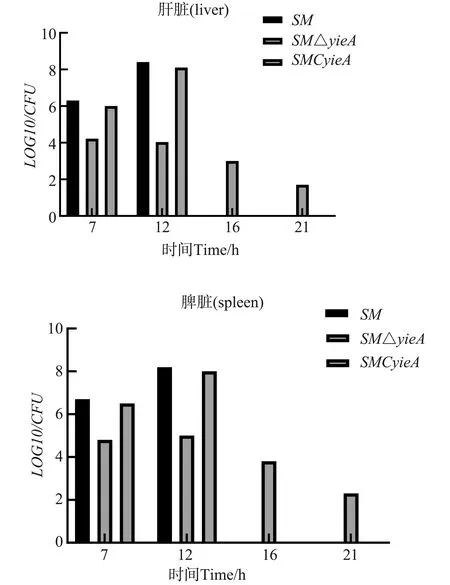
图6 小鼠肝脏和脾脏内载菌量Fig.6 bacterial load in mouse liver and spleen
2.6 免疫原性测定结果
将基因缺失株SMΔyjeA以5×103CFU/只接种小鼠,不同时间点采集血液分离血清测定特异性抗体,结果如图7所示,基因缺失株接种后7 d,血清中即可检测到特异性抗体,随着接种时间延长,血清效价逐渐升高,16 d时达到峰值,随后逐渐下降,免疫组明显高于对照组。
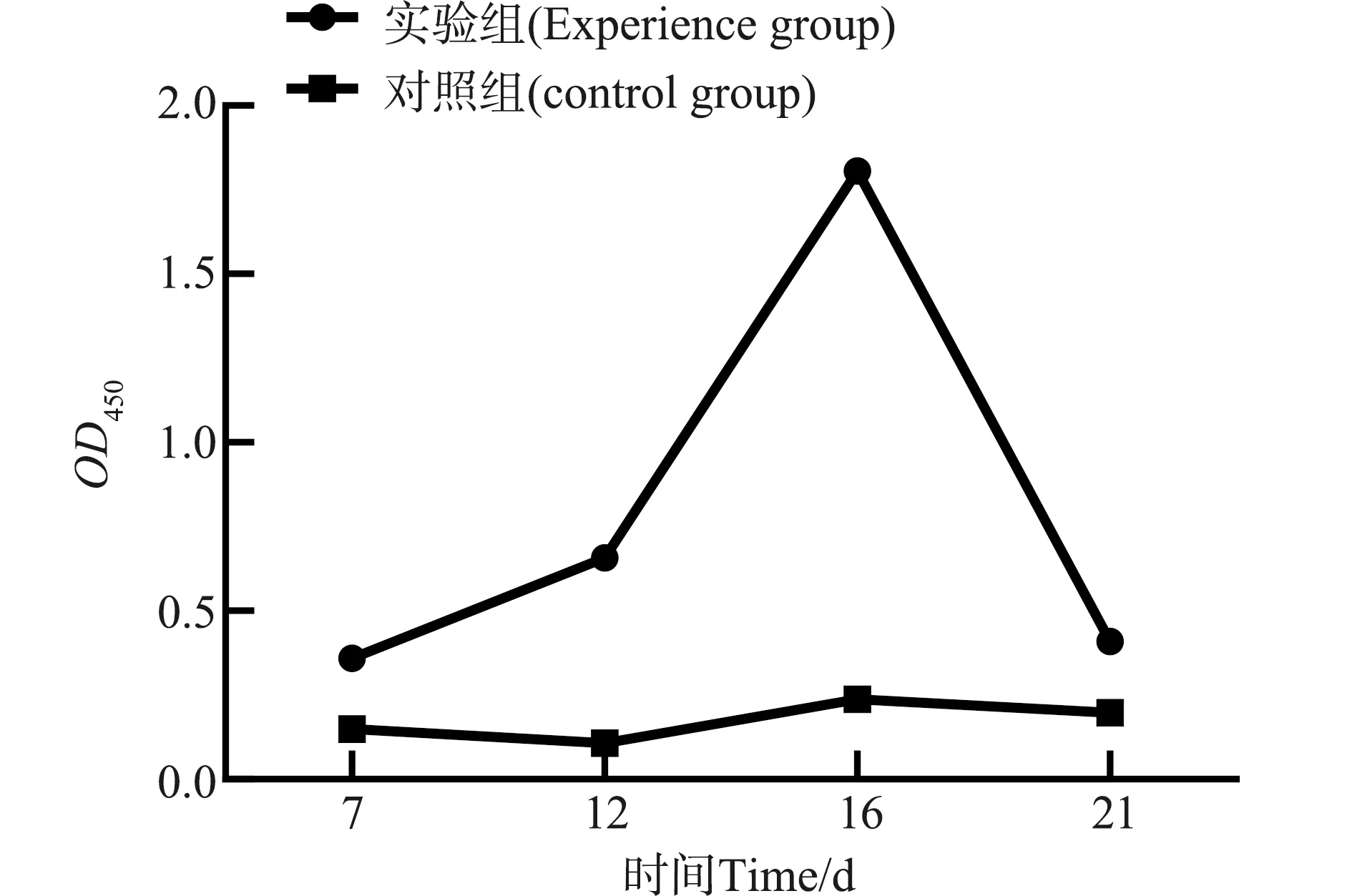
图7 小鼠体内IgG检测结果Fig.7 IgG detection results in mice
3 讨 论
S.Typhimurium是一种可以导致局部或全身感染的胞内病原体,通过基因工程的方法进行减毒可以降低其对宿主的致病性,且仍然保持良好的侵袭力[7]。近年来,通过基因工程方法构建减毒沙门氏作为疫苗载体表达外源抗原已经成为研究热点[8]。在S.Typhimurium的必需氨基酸中,除了赖氨酸外以外都需要特异性的同源氨基酰基-tRNA合成酶。氨酰基-tRNA(aaRSs)合成酶家族包括20种经典酶,其在翻译过程中将氨基酸与相应的tRNA匹配。yjeA基因是一种赖氨酸-tRNA合成酶的旁系同源物,它不识别tRNA,而是在翻译后修饰延伸因子P(EF-P),这是一种在形状和大小上模拟tRNA的蛋白质。EF-P修饰导致蛋白质组的特异性改变,并且这是沙门氏菌毒力必须的[9]。随着对沙门氏菌毒力相关的DNA的了解,已经发现许多与沙门氏菌毒力相关的基因,例如cya/crp缺失株沙门氏菌突变株不仅毒力减毒,并且保留了良好的免疫原性[10-12]。这与本研究结果一致,表明yjeA基因有望成为沙门氏菌疫苗候选基因。
与传统的基因敲除方法相比,Red重组系统进行的基因敲除重组效率明显提高,利用此方法直接线性打靶DNA,不需要构建打靶质粒,因此试验周期大大缩短[13-14]。本研究利用Red重组系统缺失yjeA基因,成功构建了沙门氏菌yjeA基因缺失株。通过生物学特性研究发现,SMΔyjeA生长较为稳定。细胞感染试验结果显示,yjeA基因的缺失不影响细菌粘附力和侵袭力,但是对于影响胞内定殖有显著地影响,由此可见基因缺失株SMΔyjeA在细胞内生长受到限制,表明SMΔyjeA毒力降低。小鼠试验结果显示,注射亲本菌株的小鼠在第14 d内全部死亡,而注射SMΔyjeA的小鼠存活率为100%,且体内肝脏和脾脏的细菌数量明显低于亲本菌。由此推测,yjeA基因缺失沙门氏菌毒力显著降低。此外,SMΔyjeA接种小鼠后7 d 产生抗体,具有良好的免疫原性。
综上所述,本研究构建了沙门氏菌yjeA基因缺失株,该缺失株生长速率稳定,体内外毒力降低,且具有良好的免疫原性。由此表明,SMΔyjeA有望用于肠炎沙门氏菌减毒活疫苗的研发。
