八宝叶片对干旱胁迫的生理响应
2020-05-15赵雪琦陈志新冷平生胡增辉
赵雪琦,陈志新,冷平生,胡增辉
(北京农学院 园林学院,北京 102206/北京农学院林木分子设计育种高精尖创新中心,北京 102206)
干旱是农林业生产面临的一个巨大难题,严重威胁着农林业的可持续发展。典型的景天科植物因其特殊的景天酸代谢(Crassulacean acid metabolism, CAM)模式,均具有较强的耐旱能力。CAM植物每固定1 g CO2或生产1 g干物质,水分的消耗量均比传统的C3或C4植物小[1,2],并且通过CAM途径固定的CO2能让植物在碳获取量最大的同时消耗更少的水分[3],这帮助一些植物能在干旱环境下能更高效的利用水分,更好的适应逆境条件。
八宝(Hylotelephiumerythrostictum(Miq.) H. Ohba)为景天科八宝属多年生肉质草本植物,也是典型的兼性CAM植物。因其管理粗放,但景观效果好并且抗旱性强的特点,近年来已经成为城市园林绿化与生态建设中不可缺少的地被植物。目前国内外对八宝的研究主要集中在繁育技术[4-5]、园林应用[6-7]、化学成分方面[8-9];对其抗性的研究主要集中在耐盐胁迫[10]、重金属胁迫[11]等。虽然也有关于八宝耐旱性的相关报道[12],但只是对八宝一天中白天和夜晚的生理变化进行了研究,缺乏长时间、胁迫程度更高的观察研究,对其耐旱机制了解不够。通过控制土壤水分的方式来进行干旱胁迫容易造成土壤湿度不均匀的问题,使用类似甘露醇等的渗透调节剂又易对植物产生离子毒害,而PEG6000(聚乙二醇6000)因较高的分子量导致其不能自由的通过植物细胞壁,从而不会的对植物细胞造成离子毒害,同时又能引起渗透胁迫,因此使用PEG模拟干旱胁迫是一个较好的选择。
本试验使用PEG6000模拟干旱胁迫处理八宝水培苗,测定叶片相关生理指标,研究八宝叶片对干旱胁迫的生理响应,为揭示八宝的抗旱机理及其应用推广提供依据。
1 材料与方法
1.1 植物材料
植物材料采自北京农学院东大地,剪取健康且长势一致的八宝幼苗进行水培扦插,培养液为1/4Hoagland营养液,每3 d更换1次。光周期为14 h光照/10 h黑暗,昼夜温度为24 ℃/20 ℃,相对湿度30 %。待生长25 d长出6~8片功能叶时,选取长势一致的幼苗进行胁迫处理。试验于2019年4月至7月在北京农学院园林学院进行。
1.2 试验方法
1.2.1 PEG处理 试验共设置5个处理,分别为:CK(1/4Hoagland营养液)、10%PEG、20%PEG、30%PEG、40%PEG,每个处理设置3次重复。所有处理溶液均用1/4Hoagland营养液配制,为保证处理溶液浓度的稳定性,每隔3 d更换1次处理液。分别于处理后的第0、3、6、9、15、20、25、30 天进行采样。采样后立即放入液氮中淬冷,之后贮存于-80 ℃超低温冰箱备用。
1.2.2 相对含水量测定 叶片的相对含水量(RWC)采用烘干法[13]测定。剪取植物成熟叶片立即称质量(记为鲜质量),然后将叶片放入加有蒸馏水的锥形瓶中,静置24 h后取出叶片,用滤纸吸干叶片表面水分并称质量(记为饱和鲜质量),最后将叶片放入烘箱中,105 ℃杀青30 min,80 ℃烘干至恒质量(记为干质量)。每组处理重复3次。相对含水量%=[(鲜质量-干质量)/(饱和-干质量)]×100%。
1.2.3 相对电导率测定 相对电导率(REC)的测定参考陈志新[10]的方法,选取成熟叶片用打孔器打10个圆形叶片,加5 mL蒸馏水,用真空抽气泵抽气30 min,震荡后室温静置30 min测溶液电导率;随后沸水浴10 min并迅速冷却至室温,测煮沸后的电导率。相对电导率(%)=(未煮沸电导率/煮沸电导率)×100%。
1.2.4 丙二醛含量测定 丙二醛(MDA)含量的测定采用硫代巴比妥酸比色法[14]。称取0.2 g叶片,加入10 mL10%三氯乙酸和少量石英砂,研磨至匀浆,转移匀浆到试管中,4 000 r/min离心10 min,上清液即丙二醛提取液。取2 mL提取液(对照管加2 mL蒸馏水)加2 mL 0.6%硫代巴比妥酸摇匀。混合液在沸水浴中反应10 min,取出试管迅速冷却,4 000 r/min离心10 min,取上清分别在532、450、600 nm处测吸光值。
CMDA=6.45(A532-A600)-0.56A450(μmol/L);MDA含量(μmol/g)=(CMDA×提取液总体积)/样品质量。CMDA为MDA的浓度,A532、A450、A600分别代表450 nm、532 nm和600 nm波长下的吸光度值。
1.2.5 可溶性糖含量测定 可溶性糖含量的测定采用蒽酮比色法[15]。称取0.2 g叶片,加入10 mL蒸馏水研磨至匀浆,转到10 mL离心管中,于沸水中提取30 min,过滤至25 mL容量瓶中定容,即样本提取液。吸取样品提取液0.5 mL于10 mL离心管中,加1.5 mL蒸馏水、0.5 mL蒽酮乙酸乙酯和5 mL浓硫酸,沸水浴中精确保温1 min,自然冷却至室温后摇匀,在630 nm波长下测吸光度。
可溶性糖含量(%)=[(C×VT×n)/(W×VS×106)]×100。C:从标准曲线查得的含糖量;VT:提取液总体积(mL);VS:测定时取用的样品提取液体积(mL);n:稀释倍数;W:样品质量(g) 。
1.2.6 脯氨酸含量测定 称取0.2 g叶片,加5 mL 3%的磺基水杨酸溶液研磨至匀浆,转移到试管中,沸水浴提取10 min,冷却后过滤,滤液即为脯氨酸提取液[15]。吸取2 mL提取液于试管中,加入2 mL冰醋酸和2 mL 2.5%酸性茚三酮溶液,沸水浴加热30 min。冷却后加入4 mL甲苯,震荡30 s,静置片刻,用移液枪吸取脯氨酸红色甲苯溶液于比色杯中,在波长520 nm处测吸光度值。
脯氨酸含量(μg/g)=(X×提取液总量)/(样品鲜质量×测定时提取液量)。式中X为从标准曲线查得的脯氨酸含量(μg)。
试验数据采用Excel软件进行处理作图,用SPSS22.0软件进行单因素方差分析,并采用Duncan法检验进行差异比较(P<0.05)。
2 结果与分析
2.1 干旱胁迫对八宝叶片相对含水量的影响
干旱胁迫第0天处理组与对照组叶片相对含水量无差异,但随着处理浓度的增加和时间的延长,八宝叶片的相对含水量基本呈现下降的趋势(图1)。第3天开始,10%PEG胁迫下的八宝叶片相对含水量始终高于对照,但除了3 d外无显著差异。20%PEG胁迫下,第6天相对含水量开始有明显下降,下降了13%,到胁迫第30 d时下降了39.5%。在30%、40%PEG的胁迫下,第3天叶片相对含水量开始就有显著下降,分别下降了25.7%和36%;之后胁迫的第6 天到30天,30%和40%PEG胁迫之间基本无显著差异,第30天时,仅为对照的45.2%和41.6%。
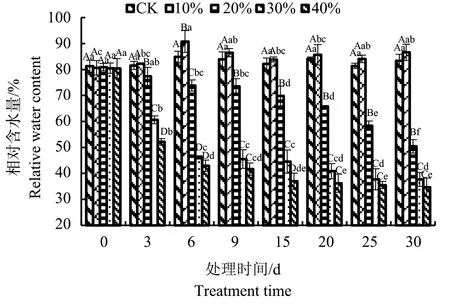
注:不同大写字母表示相同时间不同处理之间的差异显著水平(P<0.05),不同小写字母表示相同处理不同时间之间的差异显著水平(P<0.05);图2,表1,表2,表3相同Note:Different capital letters indicate significant difference among different treatmentsat the same time point (P<0.05). Different small letters indicate significant difference among different time points under the same treatment(P<0.05);The same as Fig.2,Table 1,Table 2,Table 3图1 干旱胁迫对八宝叶片相对含水量的影响Fig.1 Effect of drought stress on the relative water contents of H. erythrostictum leaves
2.2 干旱胁迫对八宝叶片相对电导率的影响
随着干旱程度的增加和时间的延长,八宝叶片的相对电导率呈现逐渐增加的趋势(图2),并且与对照相比都有显著差异(P<0.05)。10%PEG胁迫的第3天和6天相对电导率仅增加了1.04倍和1.09倍;到第30天时,与对照相比增加了1.4倍。20%和30%PEG胁迫之间对八宝叶片相对电导率的影响差异不大。40%PEG胁迫在第30天最高,是对照的1.56倍。
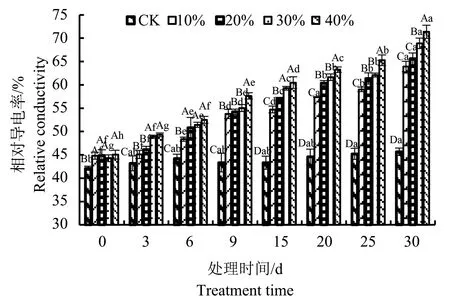
图2 干旱胁迫对八宝叶片相对电导率的影响Fig.2 Effect of drought stress on the relative electric conductivities of H. erythrostictum leaves
2.3 干旱胁迫对八宝叶片丙二醛含量的影响
如表1所示,八宝叶片丙二醛的含量随着处理程度的增加和处理时间的延长而增加。10%PEG胁迫对叶片丙二醛含量的影响虽与对照有显著差异,但增幅较小;第30天时与对照相比增加了2.44倍。20%和30%PEG胁迫的浓度之间只有第6天和15天有显著差异,分别为对照的1.8倍、2.05倍和2.3倍、2.94倍。40%PEG胁迫30 d时的叶片丙二醛含量最高,为对照的4.88倍。
2.4 干旱胁迫对八宝叶片可溶性糖含量的影响
八宝叶片的可溶性糖含量随着胁迫时间的延长和胁迫程度的升高而增加(表2)。相同胁迫时间下,不同胁迫浓度对叶片可溶性糖含量的影响基本均与对照有显著差异(P<0.05)。10%和20%两个浓度的胁迫之间基本无显著差异;10%PEG胁迫的第20天和第30天与对照相比分别增加了1.28倍和1.43倍。20%PEG胁迫的第3天和15天分别与对照相比增加了1.15倍和1.34倍;胁迫20、25、30 d三个时间点之间无显著差异,与对照相比分别增加了1.36倍、1.43倍和1.5倍。40%PEG胁迫第30天时,叶片的可溶性糖含量增幅最大,为对照的1.99倍。
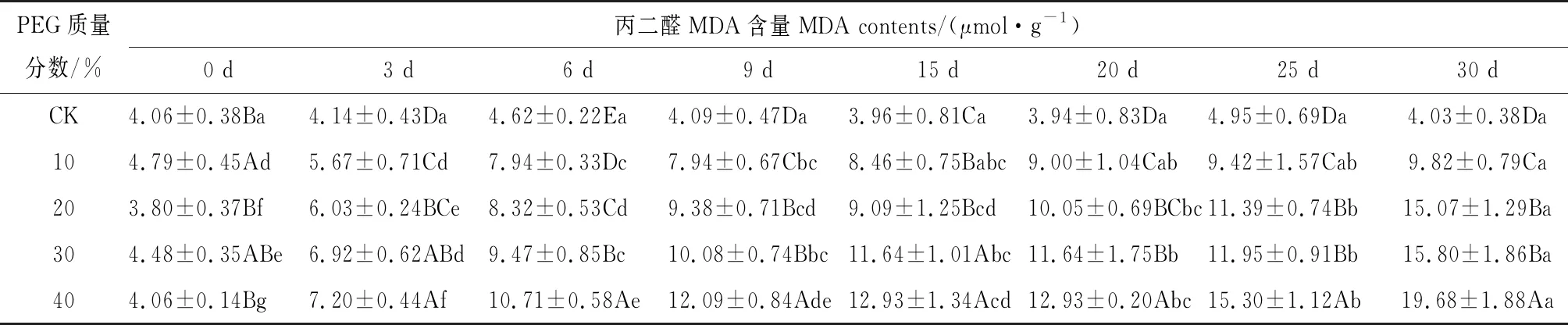
表1 干旱胁迫对八宝叶片丙二醛含量的影响Tab.1 Effect ofdrought stress on the MDA contents of H. erythrostictum leaves
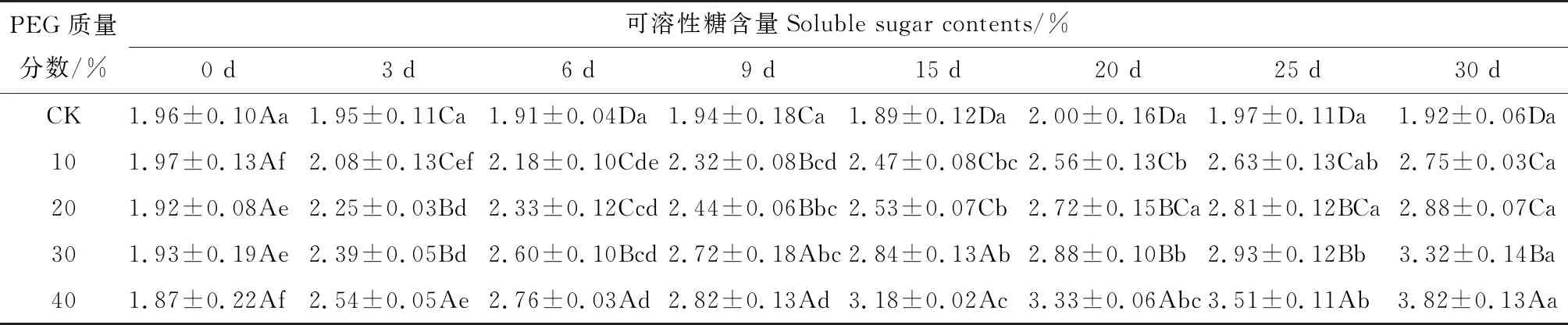
表2 干旱胁迫对八宝叶片可溶性糖含量的影响Tab.2 Effect of drought stress on the soluble sugar contents of H. erythrostictum leaves
2.5 干旱胁迫对八宝叶片脯氨酸含量的影响
如表3所示,干旱胁迫下八宝叶片的脯氨酸含量同样随着时间的延长和胁迫程度的增加而增加。10%、20%和30%PEG在胁迫的第3天和第6天的增幅不明显,但在第9天时均急剧上升,分别为对照的3.31倍、3.5倍和3.86倍。40%PEG胁迫下,八宝叶片脯氨酸含量则在第6天就显著上升,为对照的3.28倍;在胁迫第30天时,叶片脯氨酸含量最高为对照的13.99倍;与胁迫第0天相比,叶片脯氨酸含量增加了13.28倍。
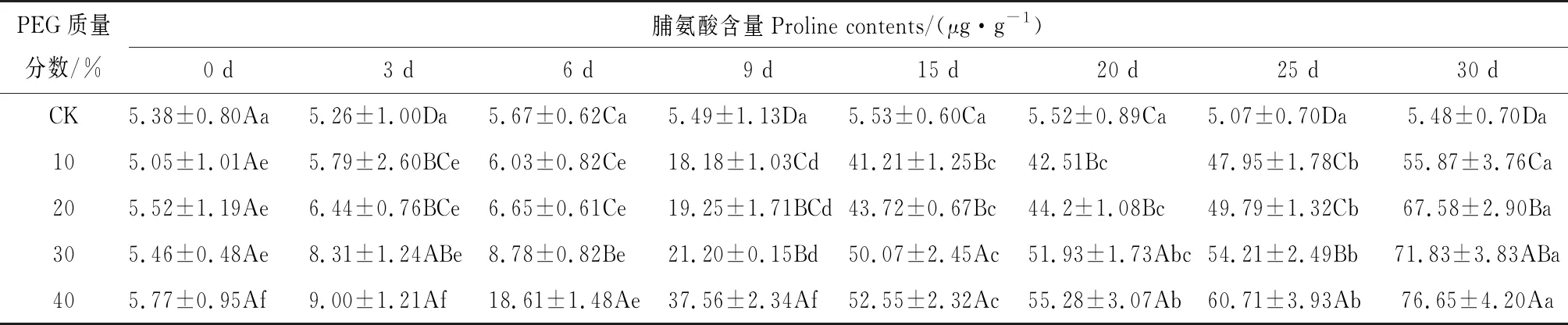
表3 干旱胁迫对八宝叶片脯氨酸含量的影响Tab.3 Effect ofdrought stress on the proline contents of H. erythrostictum leaves
3 讨 论
植物在受到干旱胁迫时能产生很多抗逆性的反应,包括脱水反应、渗透调节等。在逆境条件下,植物通过对干旱信号的感知、传导,从而能引发一系列复杂的生理变化,各个变化是紧密联系的综合性反应。因此本研究对PEG模拟干旱胁迫下的八宝叶片进行了相关生理指标的测定。
相对含水量是可以反映植物抗旱能力强弱的有效指标之一。植物叶片含水量高、水分流失慢,则植物的抗旱性较强[14]。本试验中10%PEG胁迫处理下的八宝叶片相对含水量在整个处理周期都维持在较高的水平,说明轻度胁迫能使八宝叶片有更强的保水能力。20%PEG胁迫的第0~20天叶片相对含水量下降不明显,说明该程度的胁迫前期并未对八宝造成显著的影响。但是30%、40%PEG胁迫下,随着胁迫浓度的升高和胁迫时间的延长,八宝叶片的相对含水量逐渐下降,这与景天科的长药景天(H.spectabile)、德国景天(Sedumhybridum)等植物结果相似[16-17]。
植物组织在感受到干旱胁迫的危害时,细胞膜的功能和结构最先受到损害,其中质膜的相对透性和膜脂过氧化则反映了细胞膜的受损过程[18]。叶片相对电导率的大小可以作为衡量植物在胁迫下的受伤害程度。在干旱胁迫下,植物细胞膜的通透性增加,电解质大量外渗,相对电导率增加。从图2可以看出,在胁迫0~6 d期间八宝叶片的相对电导率增加幅度较小,到胁迫第9天时开始相对电导率增幅显著,说明此时干旱胁迫已经对八宝叶片的细胞膜造成了较明显的损伤。MDA是膜脂过氧化的终产物也是重要产物之一,他的产生可以加剧细胞膜的损伤,其含量的高低一定程度上可以反映植物抗逆性的强弱。本试验中,10%PEG胁迫下八宝叶片的MDA含量增幅较为平缓;而20%、30%、40%PEG胁迫下,20~30 d时叶片MDA含量明显提高,说明轻度干旱胁迫以及短期内的中度或重度干旱胁迫对八宝叶片细胞膜造成的损伤较小,表现出较强的抗旱性,而胁迫20 d之后中度、重度干旱造成叶片膜脂过氧化程度较高,损伤较大。
渗透调节是植物在逆境条件下降低渗透势,忍耐和抵御逆境胁迫的一种重要方式[19]。其中可溶性糖和脯氨酸是一类重要的参与渗透调节的有机溶质,其含量的增加对提高细胞液浓度、植物吸水能力,降低植物细胞水势十分有利[20]。在本试验中,随着胁迫浓度的增加以及胁迫时间的延长,八宝叶片中可溶性糖含量和脯氨酸含量均不断增加,这与其它试验结果一致[21]。说明在干旱胁迫下八宝启动了防御机制,通过提高可溶性糖和脯氨酸含量来调节细胞的渗透压,增强植物抗旱性,维持正常的生长发育。但是脯氨酸的增加程度远高于可溶性糖含量的增幅,也表明八宝主要是通过增加脯氨酸的含量来缓解干旱胁迫带来的损伤。
