螨ace/S154G突变型原核表达载体的构建及其蛋白纯化
2020-05-15卜春亚
杨 金,李 超,李 博,卜春亚
(农业农村部华北都市农业重点实验室/北京农学院 生物与资源环境学院,北京 102206)
朱砂叶螨(Tetranychuscinnabarinus)是世界性害螨,它具有繁殖快、世代周期短等特点[1-4]。此外,朱砂叶螨吸食农作物叶片的汁液,对植株造成不同程度上的伤害,且能寄生在杂草上[5-6],因此给防治害螨造成困难。随着大量杀螨剂的使用致使害螨产生抗药性,对环境也造成很大的危害,有研究报道农药的大量使用会对人畜产生一定的危害[7-10]。因此研究开发更具选择性的杀螨剂有重要的意义。
乙酰胆碱酯酶(Acetylcholinesterase,AChE)是神经传导过程中的一种关键水解酶,通过水解神经递质乙酰胆碱(ACh)而终止神经冲动的传导[9-15]。在神经传导过程中,神经递质ACh与突触后膜的胆碱受体结合,将神经兴奋传递下去。若AChE活性受抑制,会致使突触后膜持续兴奋,最终导致生物死亡。有机磷(OP)和氨基甲酸酯类(CD)农药是以AChE为靶标[11-20],这类农药与AChE的催化位点丝氨酸残基发生反应,从而阻断AChE的功能[18-22]。昆虫抗药性调查研究发现丝氨酸残基位点易发生点突变,致使昆虫产生抗药性[23-24]。
本研究以克隆的朱砂叶螨AChE基因为基础,通过分析比对找到螨潜在的特有位点S154,进行定点突变并插入pET-30a载体上进行体外表达,用镍柱纯化蛋白,后进行Western Blot鉴定。这为确定朱砂叶螨AChE功能位点的研究和选择性抑制剂的筛选奠定基础。
1 材料与方法
1.1 材 料
菌株和载体:T1感受态菌株、菌株DH5α从全式金公司购置;BL21购自北京索莱宝科技有限公司;pET-30a原核表达载体由农业农村部华北都市农业重点实验室保存。
主要试剂:一步法Western Blot试剂盒和Cocktail蛋白酶抑制剂从北京酷来搏科技有限公司购置;T4连接酶从全式金公司购置;2X Taq Mix、胶回收试剂盒和质粒提取试剂盒从擎科公司购置;限制性内切酶(XhoⅠ和EcoRⅠ)、dNTP Mix、DNA Marker Ⅲ和EX Taq酶从Takara公司购置。
1.2 方 法
1.2.1 突变型目的基因的扩增 通过将螨AChE和人AChE功能位点进行比对分析找出潜在的功能位点,在已经克隆的朱砂叶螨ace基因的基础上,通过闪电突变试剂盒步骤进行定点突变引物的设计。
引物1为5′-GCTTCCAGACCAAAAGCCTCCTCCATAGATCCATAATAAA-3′,
引物2为5′-TTTATTATGGATCTATGGAGGAGGCTTTGGTCTGGAAGC-3′。
以朱砂叶螨AChE突变型基因为基础,利用Primer Premier 6.0,设计分别带有EcoR Ⅰ和XhoⅠ酶切位点的上、下游引物,用于扩增。ace/S154G突变型基因的引物如下:ace/S154G-F为5′-CGGAATTCAATGTTTTCTCCTCCGCCGCCTT-3′,ace/S154G-R为5′-CGCCTCGAGATTTGATGATCC-3′。
以朱砂叶螨ace突变型基因为模板,以ace/S154G-F和ace/S154G-R为扩增引物,进行突变型目的基因的扩增。PCR扩增程序为:95 ℃ 预变性2 min;95 ℃ 20 s,60 ℃ 10 s,68 ℃ 5 min,共35个循环:68 ℃ 延伸5 min。取出5 μL PCR产物进行琼脂糖凝胶电泳。选用DNA Mark Ⅲ,目的基因条带在1 782 bp左右。将目的条带在紫外分析仪中切下,回收目的基因条带。将胶回收产物与克隆载体T1连接后转化至Trans-T1感受态细胞,得到阳性克隆菌落。挑取单菌落,进行菌液PCR鉴定和双酶切鉴定,把鉴定为阳性的菌提取质粒。将质粒送至北京擎科生物技术有限公司测序。
1.2.2 原核表达载体pET-30a/ace/S154G的构建 用EcoR Ⅰ和XhoⅠ限制性内切酶,将载体pET-30a质粒和测序正确的质粒酶切,回收目的条带,再把载体片段和目的片段用T4 DNA Ligase在 25 ℃下连接 10 min,转化到E.coliDH5α感受态细胞中,得到阳性克隆菌落。随后进行PCR鉴定和双酶切鉴定,把鉴定成功的质粒送到北京擎科生物技术有限公司测序。
把测序成功的 pET-30a/ace/S154G 质粒转化E.coliBL21(DE3)感受态细胞,挑取单菌落,进行菌液PCR验证,将验证正确的菌液继续扩大培养后提取质粒并进行双酶切验证。将验证正确的菌株保存。
1.2.3 AChE/S154G重组蛋白诱导表达 将带有pET-30a/ace/S154G质粒的E.coliBL21(DE3)阳性菌株划线培养,挑取单菌落,于3 mL含卡那霉素的LB培养基中37 ℃、180 r/min培养至OD600nm=0.6,接入新LB培养基扩大培养,至对数生长期时加入IPTG至终浓度为1 mM,28 ℃、180 r/min 诱导培养8 h,离心收集菌体。
1.2.4 AChE /S154G重组蛋白的纯化 向上一步收集的菌体中加入20 mL PBSA结合缓冲液,200 μL 100×Cocktail,吹打悬浮菌体,放置垂直混合器中,4 ℃结合1 h。用超声波破碎仪进行破碎,随后 4 ℃、7 800 r/min,离心15 min,收集菌体沉淀与上清。将上清和已平衡的5 mL Ni-NTA在4 ℃垂直混合仪上孵育2 h。将结合好的柱料转移至柱子中,用30 mL的50 mmol/L咪唑缓冲液洗脱杂蛋白,再用200 mmol/L咪唑缓冲液洗脱目的蛋白并收集到1.5 mL离心管中,最后用30 mL的500 mmol/L咪唑缓冲液洗脱。SDS-PAGE电泳鉴定。使用Amicon© Ultra-15把纯化的收集峰进行超滤浓缩置换缓冲液,保存于-80 ℃ 冰箱。
1.2.5 AChE/S154G重组蛋白的Western Blotting鉴定 将纯化的蛋白跑SDS-PAGE胶,按照Western Blot试剂盒进行试验,来验证目的蛋白的特异性。将蛋白从聚丙烯酰胺凝胶上转移到PVDF膜上,用兔源抗His-tag抗体为一抗,加入抗体孵育45 min,再洗膜并浸入ECL染液,最后将膜置于照胶仪中进行照胶。
2 试验结果
2.1 目的基因的扩增
用引物1和引物2扩增出突变目的基因,测序验证正确后,以此为模板,利用引物ace/S154G-F和ace/S154G-R扩增出目的基因,经琼脂糖凝胶电泳鉴定,样品的条带在2 000 bp至1 200 bp之中,大小正确,证明目的基因扩增成功。再把目的条带进行胶回收(图1)。

注:M: DNA MarkerⅢ,1-2:ace/S154G Note: M indicates DNA MarkerⅢ, and 1-2 indicatesace/S154G图1 目的片段的扩增Fig.1 PCR amplification of the target gene
2.2 重组载体的双酶切验证
将PCR回收产物与pET-30a空载体分别双酶切,用T4连接酶连接后,转化E.coliDH5α感受态细胞中,经双酶切鉴定出现两条条带,上面的条带在4 500 bp以上,大小与空载体相符,下面的条带在2 000 bp至1 200 bp之间,大小与目的片段相符(图2),测序结果正确,表明成功构建pET-30a/ace/S154G原核表达载体。
2.3 目的蛋白的可溶性分析
将pET-30a/ace/S154G 阳性质粒转化E.coliBL21(DE3)感受态细胞,挑取单菌落,进行菌液PCR验证,将验证正确的菌液继续扩大培养后提取质粒并进行双酶切验证。将验证成功的阳性菌株进行平板画线活化,在1 mM IPTG、28 ℃、180 r/min 诱导培养8 h,离心收集诱导表达后的菌体沉淀,向收集的菌体中加入20 mL PBSA结合缓冲液,200μL 100×Cocktail,用移液枪吹打悬浮菌体,用超声波破碎仪进行破碎后离心,将上清液和沉淀进行上样处理后,进行SDS-PAGE鉴定。结果目的蛋白大量位于上清中,证明目的蛋白大部分为可溶性表达(图3)。

注:M:DNAMarkerⅢ,1-2:重组载体pET-30a/ace/S154G Note: M indicates DNA MarkerⅢ, and 1-2 indicates recombinant vectors pET-30a/ace/S154G图2 重组载体双酶切验证Fig.2 Restriction enzyme analysis of recombinant vectors

注:M:蛋白Marker 1:破碎后的上清液2:破碎后的沉淀 Note: M indicates protei n Marker, and 1 indicates supernatant after ultrasonic disruption, and 2 indicates pellet after ultrasonic disruption图3 SDS-PAGE电泳分析表达的AChE突变型蛋白的可溶性Fig.3 SDS-PAGE analysis of solubility of expressed AChE mutant protein
2.4 目的蛋白的纯化
对表达后的菌体进行离心沉淀。加入PBS缓冲液重悬,经超声破碎后离心,把上清液与Ni-NTA柱料结合,在4 ℃垂直混合仪上孵育2 h,再用不同浓度咪唑缓冲液进行洗脱,将纯化蛋白的样品进行处理,进行SDS-PAGE鉴定。结果条带在63 kDa至75 kDa之间,而目的条带大小为68 kDa,鉴定成功,说明得到一定纯度的目的蛋白(图4)。
2.5 目的蛋白的Western Blot分析
按照Western Blot试剂盒进行试验,来验证目的蛋白的特异性。结果得到一条特异性条带,大小在55 kDa至72 kDa之间,而目的条带大小为68 kDa,鉴定结果正确,说明获得特异性的目的蛋白(图5)。
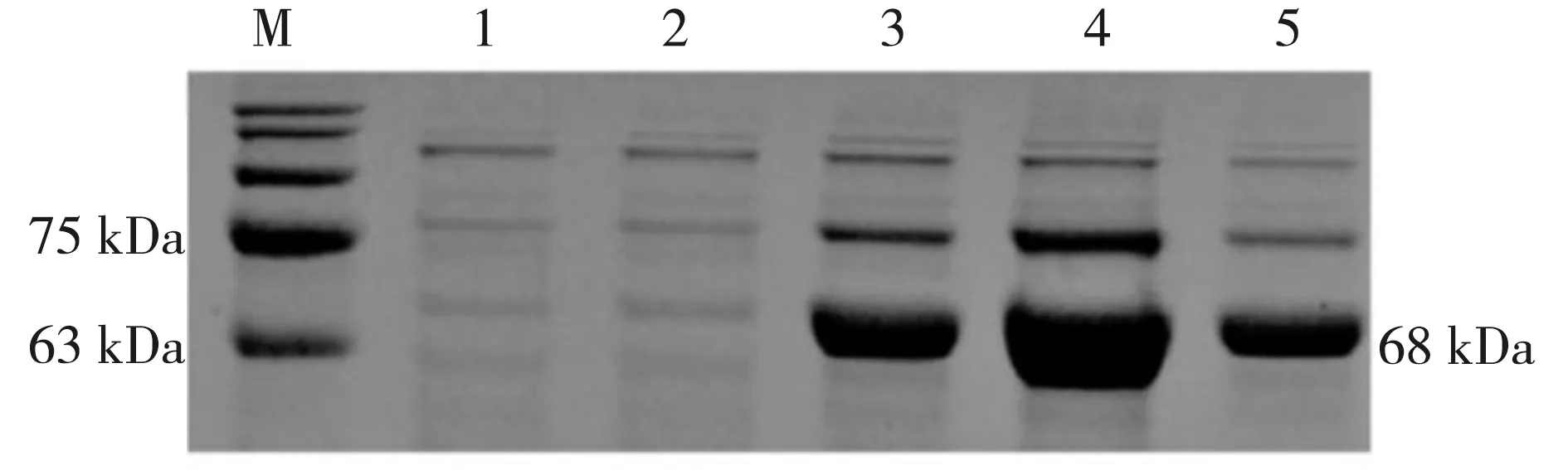
注:M:蛋白Marker 1-5:纯化后的目的蛋白 Note: M indicates protein Marker, and 1-5 indicates purified AChE mutant protein图4 纯化后的AChE突变型蛋白的SDS-PAGE分析Fig.4 SDS-PAGE analysis of purified AChE mutant protein

注:M:蛋白Marker 1:纯化后的目的蛋白 Note: M indicates protein Marker, and 1 indicates purifiedAChE mutant protein图5 纯化后的AChE突变体蛋白的western blot分析Fig.5 Western blot analysis of purified AChE mutant protein
3 分析与讨论
长久以来,朱砂叶螨是危害植物生长的主要害虫之一,给农业、园艺等造成了巨大的经济损失,人们主要采用化学防治方法[3-6],但使生态环境遭到了破坏,严重影响生态的平衡。同时,大量农药的使用使害螨逐渐产生了抗性,更为严重的是研究发现以AChE为靶标的有机磷和氨基甲酸酯类农药会对人畜和其他的有益生物产生影响。找到更加高效、合理,对环境少污染的害螨防治方法具有重要价值。通过在农业防治的基础上配合使用生物农药将能有效的控制害螨,同时可以减少农药对生态环境的破坏。而乙酰胆碱酯酶作为农药的作用靶标,因此,选择性乙酰胆碱酯酶抑制剂的研究具有重要的理论和实践意义。
目前,至少30种昆虫的AChE基因已被克隆,有的进行了体外表达[12-16]。而通过定点突变的方式来研究酶活性也有不断地尝试[17-22]。如陈艳霞通过构建家蝇乙酰胆碱酯酶基因真核表达载体,并对抗性位点进行了定点突变来研究其酶活及对杀虫剂的敏感性[16]。施明安则通过调查家蝇乙酰胆碱酯酶突变点,运用分子和酶学方法来研究家蝇对有机磷和氨基甲酸酯类农药的抗药性[17]。朱砂叶螨乙酰胆碱酯酶的克隆和表达也取得了一定的进展。2014年冯晓姣等[25]对朱砂叶螨ace基因进行了克隆。2015彭博等[12]对朱砂叶螨AChE进行了原核表达,得到了高纯度的重组蛋白。
本研究是在朱砂叶螨乙酰胆碱酯酶基因的基础上,首先根据AChE基因序列推导出其氨基酸序列,进行朱砂叶螨AChE同源性结构建模。分析预测结构与已有乙酰胆碱酯酶的结构差异性,并进行可靠性预测。最后进一步比对分析朱砂叶螨AChE与其他生物AChE活性位点及周围区域的差异性,找到潜在的螨AChE特有的作用靶点。将朱砂叶螨AChE基因通过定点突变的方法得到突变基因序列,并以大肠杆菌为载体进行体外表达和纯化。为今后进行突变体与野生型活性比对,来确定该突变位点的功能奠定了坚实基础,为选择性杀螨剂的研究奠定了基础。
