基于荧光分子开关和核酸适配体的镉离子快速检测方法
2020-05-11涂东堃郑晓亮黄敏丽王奕婧曾绍校
涂东堃 - 鲁 悦 郑晓亮 - 黄敏丽 - 王奕婧 - 曾绍校,2,3 -,2,3 徐 晖,2,3 ,2,3
(1.福建农林大学食品科学学院,福建 福州 350002;2.闽台特色海洋食品加工及营养健康教育部工程研究中心,福建 福州 350002;3.福建省特种淀粉品质科学与加工技术重点实验室,福建 福州 350002)
镉是一种有毒的重金属元素,长期暴露在镉污染的环境中会对人的肾脏、肺、骨骼造成损伤,严重的还会致癌[1-3]。中国镉离子在环境、粮食乃至食品的污染情况也不容乐观,Wei等[4]对北京人口密度高的交通区、居民区的街道粉尘进行采样,测定结果表明镉的含量处于重度污染。陆素芬等[5]研究了南丹县粮食作物玉米中重金属离子的含量,结果表明镉离子的超标率为8.4%,在镉的影响下玉米中蛋白质、淀粉、脂肪含量均会发生变化。李颖等[6]对邯郸市某冶炼厂周边的小麦进行检测,结果表明小麦中镉离子和铅离子的含量均有超标的情况。世界卫生组织国际癌症研究机构(IARC)已将镉离子分类为第一类致癌物质[7],中国生活饮用水卫生标准中规定饮用水中镉的限量标准为5 ng/kg,食品污染物限量标准中大米中镉的限量标准为0.2 mg/kg。综合以上原因,对环境和食品中的镉离子进行监测和控制具有十分重要的意义。
传统的镉离子检测方法有原子吸收光谱法[8]、电感耦合等离子体质谱法[9]、电感耦合等离子体原子发射光谱分析[10]、原子荧光光谱法[11]。这些检测方法是相对较为成熟的方法,能够对环境中的镉离子进行有效的分析,灵敏度、准确性、选择性都比较好,但这些方法一般都要求有大型的仪器设备,专业的操作人员,检测成本高,检测过程繁琐。
近些年,许多学者对环境和食品中重金属残留快速检测技术进行了研究,其中主要有电化学法[12]、比色法[13]、试纸条方法[14]等。Si等[12]研制了一种基于还原氧化石墨烯(rGO)/金纳米颗粒(AuNPs)/四苯基卟啉(TPP)(rGO/AuNPs/TPP)纳米共轭物的电化学传感器,通过TPP对Cd2+的选择性富集,以及rGO对Cd2+与卟啉衍生物配位作用的加强,对镉离子进行定量检测。Guo等[13]利用Cd2+与四分子的谷胱甘肽(GSH)形成球形复合物的原理,研制出了一种基于GSH保护的纳米金比色传感器,并对水样和消化后的大米样品中的Cd2+进行检测。Xiao等[14]研制了一种基于金纳米星和量子点的集成免疫层析试纸条,对Cd2+进行检测,检测线达到0.18 ng/mL,线性范围为0.25~8.00 ng/mL。这些方法具有方便、简单、快捷等特点,但部分方法准确性和稳定性较差,需要对其进行优化和改进。
核酸适配体是能够特异性识别靶标分子具有较高亲和力的一类RNA或DNA分子,其识别靶分子的机理与抗原抗体相似,具有稳定性好、易于合成和修饰等优点[15]。近年发展起来的基于核酸适配体的检测方法食源性致病菌、生物毒素、重金属、药物残留检测等领域显示了良好的应用前景[16]。Bayramoglu等[17]通过磁捕获和基于适配体的亲和力对牛奶样品中沙门氏菌的病原体细胞进行快速检测,在没有任何培养的情况下,在低至103CFU/mL的牛奶样品中实现了沙门氏菌的检测。核酸适配体能对一些小分子物质进行识别,如重金属等。Wu等[18]通过固定寡核苷酸链库,建立了一种新方法进而筛选出了镉离子核酸适配体。目前,用该核酸适配体对镉离子进行检测的研究比较少[19]。
噻唑橙(TO)是一种不对称的花菁类阳离子染料,用作荧光检测时可消除染料自身的背景干扰,提高荧光检测灵敏度,是一种流行的核酸荧光探针,广泛运用于检测不同的DNA和RNA结构[20]。Kang等[21]研制了一种基于噻唑橙和i-motif DNA构象改变的传感器,用于检测Ag+。
试验拟基于镉离子核酸适配体和噻唑橙染料构建一种镉离子检测的荧光方法,以期为核酸适配体在镉离子快速检测应用提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
噻唑橙:90%,上海阿拉丁生化科技股份有限公司;
二甲基亚砜:顶空气相色谱级,上海安谱实验科技股份有限公司;
乙醇、CdCl2·H2O、FeCl3·H2O、BaCl2·H2O、CaCl2等:分析纯,国药集团化学试剂有限公司;
HEPES:1 mol/L,北京索莱宝生物科技有限公司;
磷酸盐缓冲溶液:1 mol/L,上海阿拉丁生化科技股份有限公司;
超纯水:18.2 mΩ,由Millipore净水系统制备;
镉离子适配体:5’-GGACTGTTGTGGTATTATTTTTGGTTGTGC-SH-3’,上海生工生物工程技术服务有限公司。
1.1.2 主要仪器设备
电子天平:SQP型,赛多利斯科学仪器(北京)有限公司;
涡旋振荡器:MS 3 basic型,厦门精艺兴业科技有限公司;
pH计:ST3100型,奥豪斯仪器(常州)有限公司;
超纯水机:UV 24型,厦门精艺兴业科技有限公司;
冷冻离心机:UNIVERSAL 320R型,德国Hettich科学仪器公司;
超声波清洗机:KQ5200E型,昆山舒美超声仪器有限公司;
荧光分光光度计:RF-5301PC型,日本岛津公司;
石墨炉原子吸收分光光度计:AA-6300C型,日本岛津公司。
1.2 方法
1.2.1 镉离子荧光检测 在EP管中加入35 μL的100 mmol/L HEPES溶液,同时加入25 μL 2 μmol/L的核酸适配体,再加入镉离子标准溶液,控制反应体系酸度pH=7.0,充分混合,室温下反应80 min;在上一步的混合溶液中加入60 μL 4 μmol/L 噻唑橙溶液充分振荡,用超纯水定容至200 μL,继续在室温下反应25 min,同时配制空白。将混合的溶液转移至超微量荧光比色皿中,用分光光度计记录500~630 nm内的荧光光谱,分别测定溶液荧光强度F和空白值F0。
1.2.2 体系pH值优化 在EP管中加入核酸适配体和噻唑橙溶液充分振荡,加入相同量的不同pH的磷酸盐缓冲溶液(0.1 mol/L),控制pH为3~9,加超纯水至总体积为200 μL,室温下反应25 min,测定不同pH下的荧光强度。
1.2.3 噻唑橙—适配体浓度比的优化 固定噻唑橙与适配体混合物的总体积,加入不同体积的噻唑橙与适配体,使其摩尔比分别为9∶1,8∶2,7∶3,6∶4,5∶5,4∶6,3∶7,2∶8,1∶9,加入35 μL 100 mmol/L的HEPES溶液,定容,pH值控制为7,室温下反应25 min,测定体系荧光强度。
1.2.4 噻唑橙与适配体结合时间的优化 在EP管中加入相同核酸适配体,加入适当的噻唑橙溶液使其摩尔比为7∶3,加入35 μL 100 mmol/L的HEPES溶液,控制溶液pH为7,加超纯水至总体积200 μL,选择不同的时间点测体系的荧光强度。
1.2.5 适配体与镉离子结合时间的优化 向一系列EP管中加入相同的核酸适配体和镉离子标准溶液,常温下分别反应0,10,20,30,40,50,60 min,加入相同量的噻唑橙溶液,使噻唑橙与适配体浓度比为7∶3,加入35 μL 100 mmol/L的HEPES溶液,定容,室温下反应25 min,测定体系荧光强度。
1.2.6 荧光检测的特异性 向不同的EP管中加入等量的核酸适配体,加入35 μL HEPES溶液使体系pH为7,分别加入50 ng/mL的8种不同的金属离子(钾、钙、镁、锌、铁、铜、铅、铬)和镉离子混合均匀,常温下反应20 min,再加入等量噻唑橙溶液使噻唑橙与适配体浓度比为7∶3,继续反应15 min,测定荧光强度,并与空白相比较。
1.2.7 实际样品前处理 用试验建立的方法对水样A、B、C中的重金属镉离子含量进行检测分析。将水样用0.2 mm注射过滤器对水样品进行过滤,添加2 ng/mL浓度的镉离子标品,用试验建立的方法检测,测得镉离子的浓度值并计算回收率,与石墨炉原子吸收光谱进行比较。
1.2.8 石墨炉原子吸收光谱法检测 将水样放置于自动进样器中,调整自动进样器与石墨管的距离,设置试验参数分别为进样体积10 μL,波长228.8 nm,电流4 mA等,随后开始进行水样中镉的检测。
2 结果与分析
2.1 镉离子荧光检测设计原理
如图1所示,当噻唑橙溶液在485 nm的激发光下,在510~610 nm的范围内没有发射峰;当噻唑橙与适配体结合后,荧光强度显著增强,在535 nm处出现峰值;当有镉离子存在时,体系荧光强度降低。噻唑橙在游离状态下,荧光产率低,与适配体结合后,通过插入碱基对、与带负电的磷酸骨架结合或与小沟槽结合而产生荧光效应[22],当有Cd2+存在时,适配体优先与Cd2+结合,阻碍噻唑橙与适配体的结合,荧光强度降低。
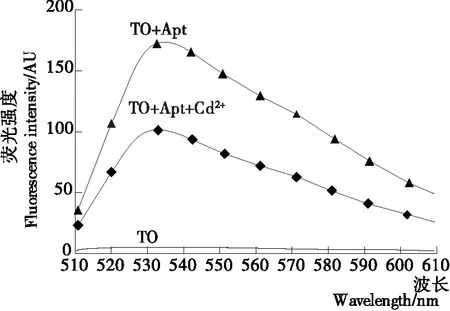
图1 镉离子检测荧光光谱图
Figure 1 Fluorescence spectrogram of cadmium ion detection
2.2 体系pH对荧光强度的影响
由图2可知,pH在3~4时检测体系的荧光值随pH的升高而升高,当pH>4时,随着pH的升高而降低,当pH=4时荧光值最大。该结果与Kang等[21]的试验结果一致,在酸性条件下噻唑橙与适配体结合产生的荧光较中性及碱性条件下大。体系pH>7时,荧光强度变化小,比在酸性条件下更为稳定,因此检测镉离子的最佳pH值为7。
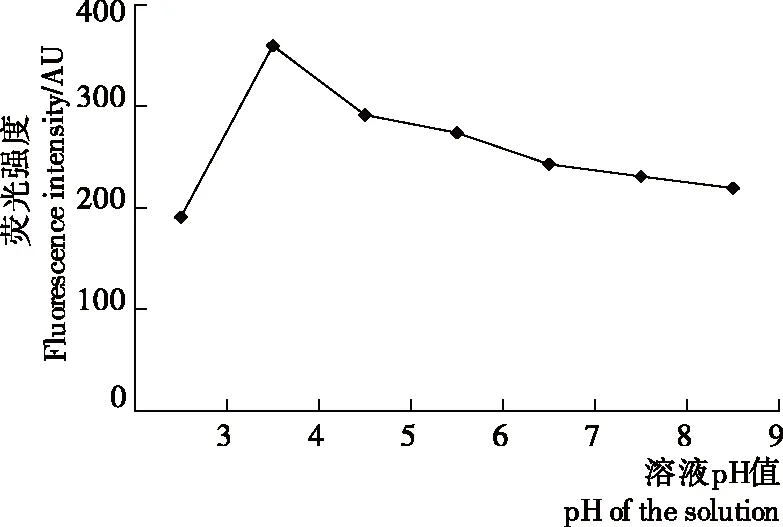
图2 溶液pH对荧光强度的影响
2.3 噻唑橙与适配体浓度比对荧光强度的影响
由图3可知,体系在最大发射波长的荧光强度随噻唑橙与适配体的浓度比增加先升高后降低,当噻唑橙与适配体的比值为7∶3时荧光强度最大。噻唑橙与适配体的浓度比对荧光强度起着重要作用,浓度比太低时,核酸浓度低产生的噻唑橙—适配体复合物浓度低,荧光强度弱;浓度比高时,适配体浓度大,影响荧光检测的灵敏度。当噻唑橙与适配体处于7∶3的比值时,荧光强度最强,适配体浓度约为0.46 μmol/L,与Sun等[23]采用的适配体浓度相近。因此试验中以7∶3作为噻唑橙与适配体的最佳摩尔比。
2.4 噻唑橙与适配体结合时间的优化
如图4所示,体系的荧光强度在10 min以内迅速增加,在10~15 min时荧光增强速度变缓,15 min后混合液的荧光强度基本保持不变,此时适配体与噻唑橙充分反应,荧光强度达最大值。噻唑橙与适配体结合的时间对荧光产率的影响是很重要的因素[24],反应时间太短,噻唑橙与适配体结合不够完全,荧光信号未达到稳定,所以试验中以15 min作为噻唑橙与适配体反应的最佳反应时间。
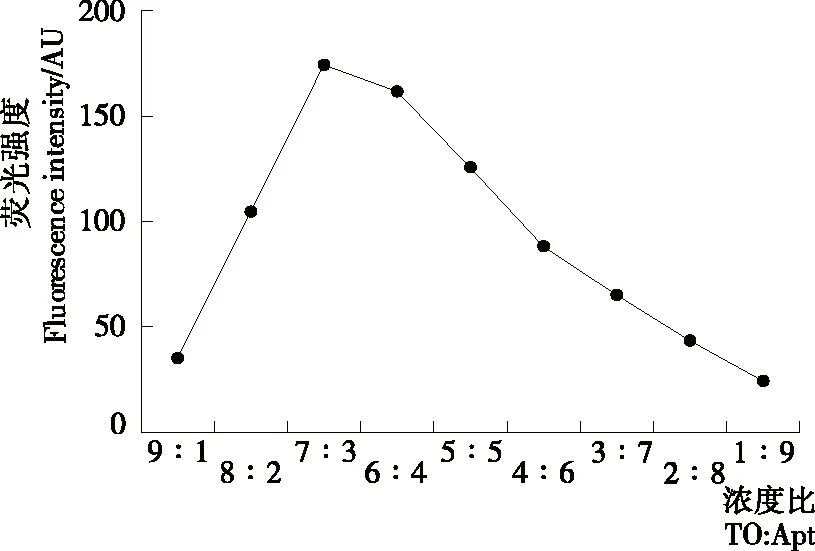
图3 噻唑橙与适配体浓度比对荧光强度的影响
Figure 3 Effect of concentration ratio of TO and Apta-mer on fluorescence intensity
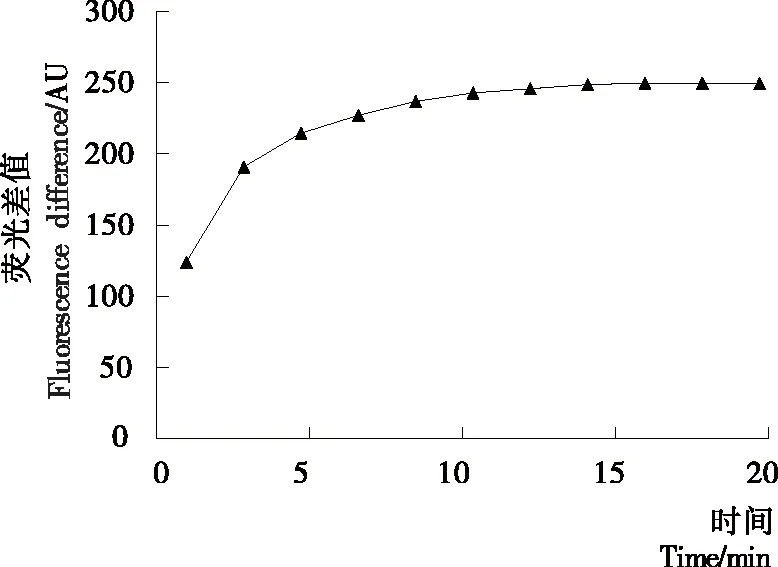
图4 噻唑橙与适配体结合时间的优化
2.5 适配体与镉离子反应时间的优化
如图5所示,随着孵育时间的增加,荧光差值(F-F0)增大,当孵育时间>20 min时,荧光差值保持稳定无变化,此时溶液中镉离子与适配体反应充分,荧光强度不再降低。若适配体与镉离子反应时间不足,体系未达到平衡,将影响检测结果。为此,选择20 min为适配体与靶标物质镉离子的最佳孵育时间。
2.6 检出限与线性范围
在最佳的试验条件下,用试验建立的方法对不同浓度的镉离子标准液进行检测,发现镉离子浓度与体系的荧光强度在2.00~80.00 ng/mL的范围内呈良好的线性(见图6),校正曲线方程y=-2.340 6x+284.73,检出限为0.23 ng/mL,与Zhu等[25]通过对适配体修饰检测的方法相比较,检出限接近,但试验建立的方法不需要对适配体进行修饰,只需简单的混合,操作方便,而且线性范围较广。
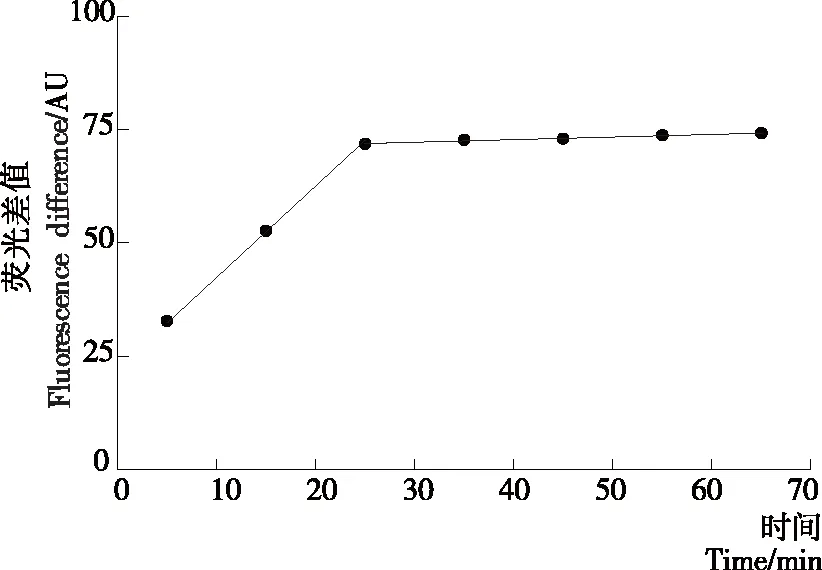
图5 适配体与镉离子反应时间的优化
Figure 5 Optimization of reaction time between Aptamer and cadmium ions
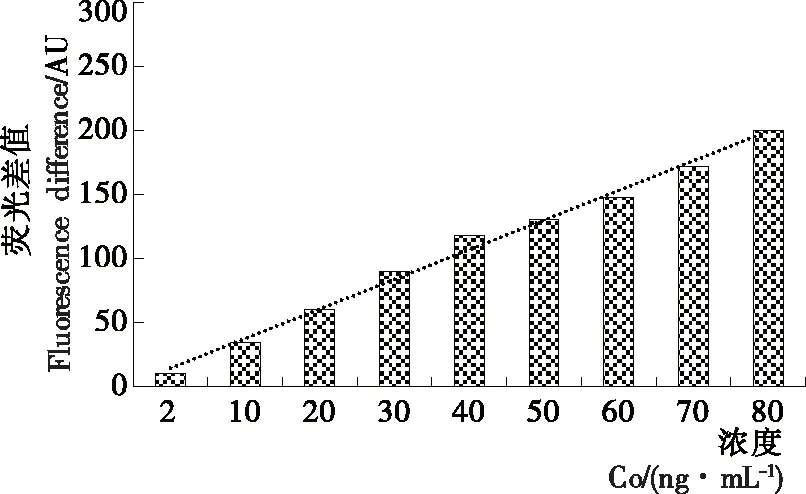
图6 荧光强度与镉离子的线性关系图
Figure 6 Linear relationship between fluorescence intensity and cadmium ion
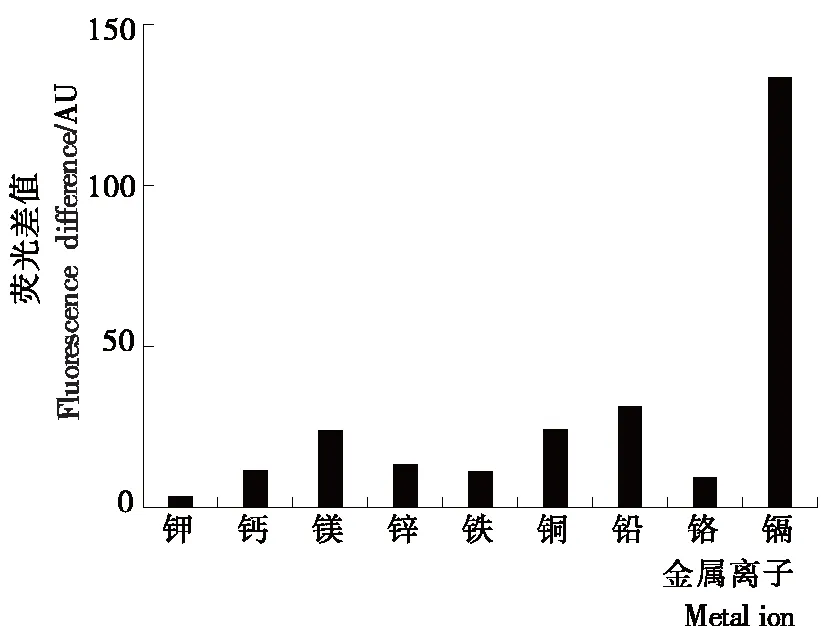
图7 选择性分析
2.7 特异性
选择了8种不同的金属离子(钾、钙、镁、锌、铁铜、铅、铬)与镉离子在最优试验条件下进行检测,结果如图7所示。与其他金属离子相比,加入镉离子的体系荧光差值最大,荧光强度变化(ΔF)明显,Mg2+等对Cd2+的检测有一定的影响,加入Mg2+和Pb2+的检测体系也引起了不可忽视的荧光强度变化,与Wu等[18]的研究结果相似。除Mg2+与Pb2+外,试验建立的方法具有较好的特异性。为了提高方法的选择性,Cao等[26]通过使用螯合剂的策略掩盖部分离子,在后续的研究中可以利用螯合剂(如:PDCA和NTA等)降低Pb2+、Mg2+对荧光检测的影响。
2.8 实际样品检测
用试验建立的方法对3种不同的水样品进行加标回收试验,将所得的结果与石墨炉原子吸收光谱法相比较(GB 5009.15—2014)。经检测未加标的水样品中本底值分别为3.082 2,3.568 4,2.646 4 ng/mL,扣除本底值所得的结果见表1。
由表1可知,试验建立的方法检测实际样品所得结果与原子吸收光谱法相比较差异小,有较好的回收率,且具有较好的准确性和稳定性,表明所建方法可用于镉离子的实际样品检测。
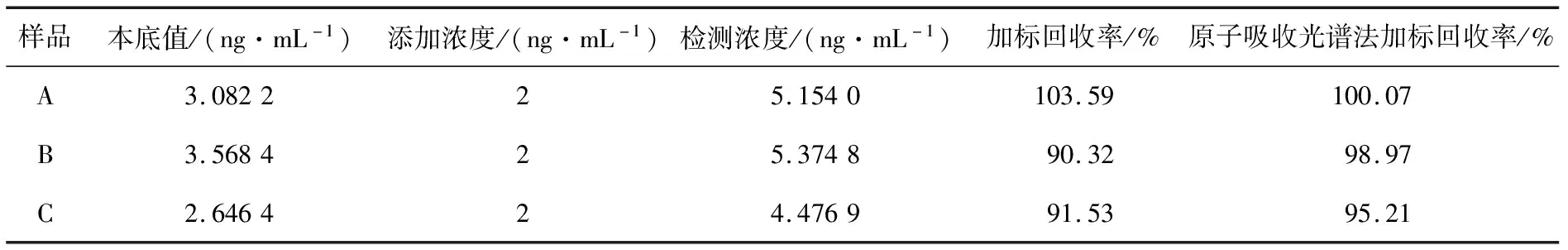
表1 镉离子加标回收率
3 结论
试验建立了一种基于镉离子核酸适配体无标记检测镉离子的荧光方法,其最佳荧光检测条件为:pH值7、噻唑橙—适配体浓度比7∶3、噻唑橙与适配体结合时间15 min、适配体与镉离子结合时间20 min。在此条件下,荧光强度与镉离子浓度表现出良好的线性关系,线性范围为2.00~80.00 ng/mL,检测限为0.23 ng/mL,但对镉离子检测的特异性还有待加强,后续研究可通过对干扰离子进行屏蔽或者信号扩增等方法增强。
