降脂红曲高产Monacolin K 生产工艺优化
2020-05-11邢宏博张薄博许赣荣刘仁春张大永
邢宏博, 张薄博*, 许赣荣, 刘仁春, 张 耀, 江 云, 张大永
(1. 江南大学 生物工程学院 江苏无锡214122;2. 四川新荷花中药饮片股份有限公司 四川 成都610036)
红曲作为一种药食两用丝状真菌,在我国有着悠久的历史。 东汉王粲的《七释》中已有瓜州红曲的记载[1],本草纲目、本草从新及食用本草等均对红曲菌的药用价值进行介绍,这可能与红曲米发酵产生的中的活性物质有着一定关系[2]。
降脂红曲是红曲中药饮片中应用最广的品种之一。 由于Monacolin K(MK)的结构与合成胆固醇的3-羟基-3-甲基戊二酸单酰辅酶A(HMG-COA)结构相似,故MK 能够竞争性抑制胆固醇合成过程中的关键酶HMG-CoA 还原酶,从而可以有效地降低人体中胆固醇的合成量[3]。
目前对于红曲菌固态发酵产MK 的研究,主要集中于通过优化碳源、氮源、无机盐等手段来提高MK 的产量[4],但此法不太适用于红曲中药饮片类红曲的生产。 作者从红曲菌株筛选、生产原料选择、基质加水量等基本条件进行研究,在单因素基础上用Design-Expert 8.0 对红曲菌固态发酵的水分、 变温时间和接种体积分数进行优化,以提高MK 的产量。
1 材料与方法
1.1 红曲菌株
作者所在实验室保存菌株红色红曲菌(9901,9909)、丛毛红曲菌9908,紫色红曲(W1,ZH2,ZH6及SJS-6)。
1.2 培养基
PDA 培养基:200 g 土豆,加水煮沸,过滤,定容至1 L。加20 g 葡萄糖,20 g 琼脂。115 ℃灭菌15 min。
种子培养基: 葡萄糖60 g/L, 蛋白胨25 g/L,NaNO32 g/L,MgSO4·7H2O 1 g/L,K2HPO4·3H2O 1 g/L,玉米浆6 g/L。 121 ℃灭菌20 min.
1.3 发酵方法与操作
1.3.1 孢子悬浮液制备 用无菌水将菌种孢子从斜面洗脱下来,制成孢子浓度为1×106个/mL 的孢子悬液,用于接种。
1.3.2 液态种子培养 上述孢子悬液按一定的比例接种到装有100 mL 种子培养基的500 mL 的三角瓶中,在30 ℃、170 r/min 的旋转式摇床中培养48 h。1.3.3 发酵培养 将培养的液态种子按一定比例(最佳为10%)接种于固态发酵培养基中,并放于生化培养箱培养。
1.4 MK 检测方法
按照轻工行业标准QB/T 2847-2007 功能性红曲米(粉)的方法进行测定[5]。
1.5 红曲菌固态发酵产MK 工艺优化
在单因素的基础上,选取加水体积分数(A)、变温时间(B)和接种体积分数(C) 3 个因素为自变量,以MK 的产量为因变量, 利用Design-Expe 设计三因素三水平实验,响应面实验的因素水平见表1。
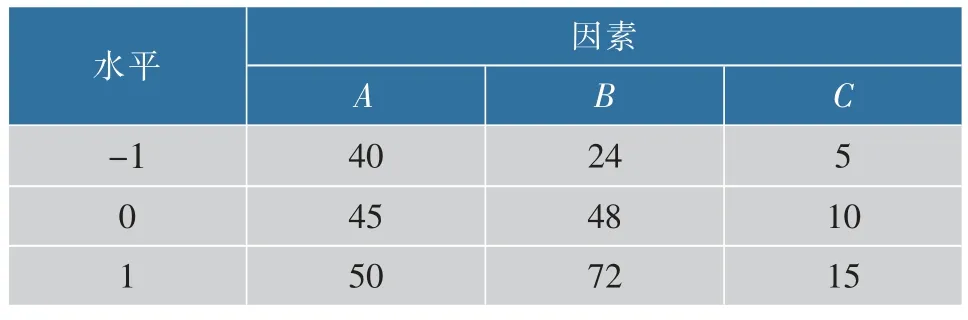
表1 响应面实验因素水平设计Table 1 Response surface experimental factor level design
1.6 直链淀粉质量分数检测方法
按照国家标准方法GB/T 15683-2008 大米直链淀粉的测定进行测定[6]。
1.7 大米糊化特性检测方法
浸泡大米,胶体磨粉碎离心,用0.2 mol/L 的NaOH浸泡,过筛除杂质并用双蒸水洗涤。 用0.1 mol/L 的盐酸调节pH,双蒸水洗涤后于35 ℃烘干,用RVA4500检测[7]。
2 结果与讨论
2.1 固态发酵产MK 红曲菌株筛选
不同红曲菌株固态发酵产MK 的能力不同,故对实验室保藏的 7 株红曲菌固态发酵产MK的能力进行检测,筛选出高产MK 的菌株,结果见图1。
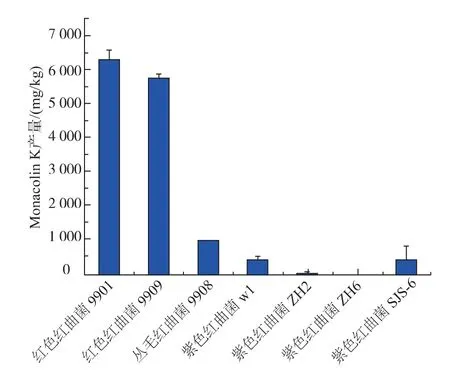
图1 7 株红曲菌固态发酵产MK 的对比Fig. 1 Comparison of MK production by SSF of different Monascus strains
从图1 可知,所选菌株中最适合生产MK 的菌株为红色红曲菌9901,其次为红色红曲菌9909。 目前降脂红曲的生产菌种要求是紫色红曲菌,但所选的4 株紫色红曲菌固态发酵产MK 能力较弱。 实验结果表明,红色红曲菌也可以高产MK。从降脂功能性来看,仅以紫色红曲菌作为生产菌种的合理性就值得商榷了[8]。 另外,国内功能性红曲米(粉)的轻工行业标准QB/T2847-2007 中规定所用菌种为红色红曲霉(Monascus anka Nakazawaet Sato),跟我们的实验结果较为相符[5]。 作者综合考虑,选择红色红曲菌9901 作为后续实验所用菌株。
2.2 红色红曲菌9901 固态发酵产MK 基质选择
传统红曲米均是以大米作为原料。 但大米种类繁多,不同品系、不同产地的大米存在一定差异。 因此选用6 种常见大米作为红曲菌发酵基质,考察不同大米对红曲菌产MK 的影响,结果见图2。
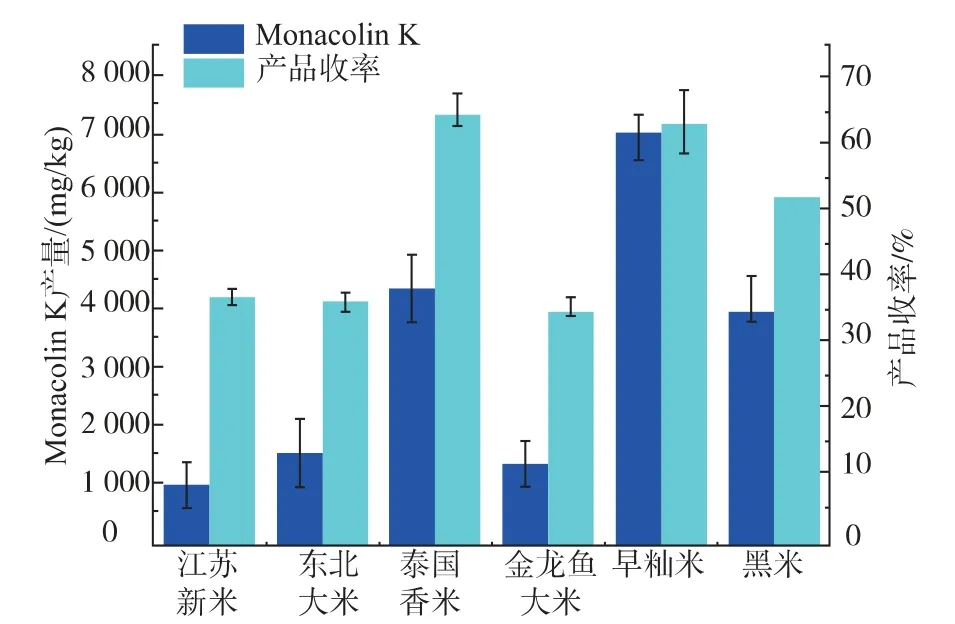
图2 不同大米对红色红曲菌9901 产MK 的影响Fig.2 Effect of different solid substrates on the production of MK of Monascus ruber 9901
从图2 可知,在所选的固态发酵基质中红色红曲菌9901 固态发酵产MK 的产量最高的基质为广西早籼米,其MK 产量可达7 017.00 mg/kg。 以江苏新米作为固态发酵基质时, 红色红曲菌9901 固态发酵产物中MK 产量仅有1 011.33 mg/kg。 用广西早籼米作为固态发酵基质时MK 产量为以江苏粳米作为固态发酵基质时MK 产量的6.94 倍。
可见, 不同大米作为发酵基质对红色红曲菌9901 产固态发酵MK 有较大影响。为了研究不同大米作为基质时MK 产量差异的原因, 我们测定了6种大米的糊化特性及其直链淀粉质量分数, 见图3及表2。 结果表明,6 种大米的直链淀粉质量分数和峰值粘度差异较大。 大米中的直链淀粉质量分数及峰值粘度与大米的粘度之间有紧密联系,直链淀粉质量分数越高,峰值粘度值越大,粘性越差[9]。 籼米的峰值粘度及直链淀粉质量分数均高于粳米,其中广西早籼米的峰值粘度和直连淀粉质量分数相对较高, 分别为2 972 cp 和27.5%, 且其粘度相对较小。 这与实验中观察到的现象一致,因此,选用直链淀粉质量分数和峰值粘度相对较高的广西早籼米作为基质时, 有利于红色红曲菌9901 固态发酵高产MK。
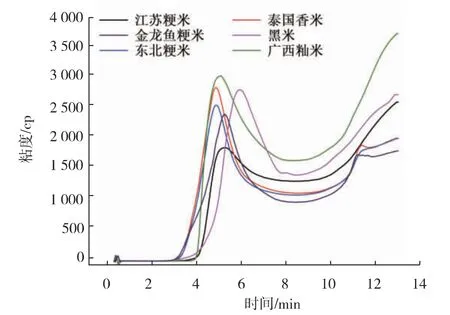
图3 不同大米糊化特性曲线Fig. 3 Curve of gelatinization characteristics of different rice
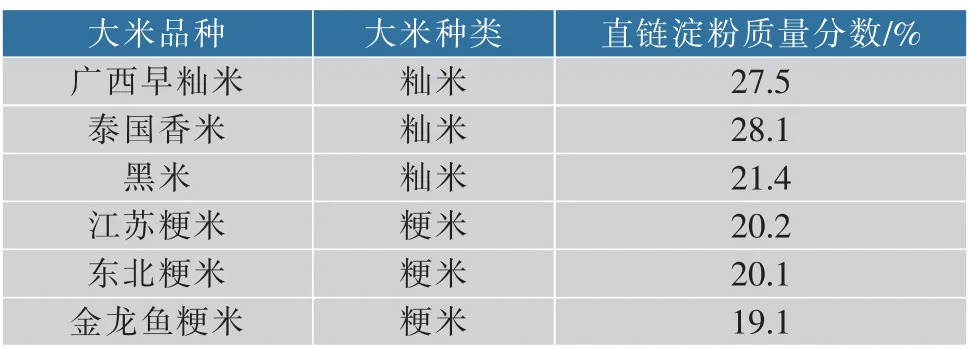
表2 不同大米直链淀粉质量分数Table 2 Amylose content of different rice
2.3 发酵时间对红色红曲菌9901 固态发酵产MK的影响
红曲菌固态发酵产MK 的发酵周期较长,不同菌株、不同培养方式红曲菌固态发酵产MK 的周期不同[10-11],因此有必要研究红色红曲菌9901 的最适发酵周期,结果见图4。
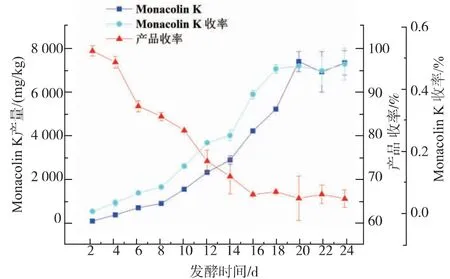
图4 发酵时间对红色红曲菌9901 固态发酵产Monacoln K、Monacoln K 收率及产品收率的影响Fig. 4 Effect of fermentation time on MK production of Monascus ruber 9901
从图4 可以看出, 从第4 天到第16 天底物消耗较快,可能是由于菌体快速生长及次级代谢产物大量生产所造成的。 从第8 天到第18 天MK 的产量及收率迅速增加,MK 大量积累, 发酵20 d 时MK 的产量及收率都达到最大。而到了20 d 后MK 的产量及收率都稍微有所下降,可能是产物有所分解造成的。 因此,红色红曲菌9901 固态发酵产MK 的发酵周期为20 d。
2.4 抖料次数对红色红曲菌固态发酵产MK 的影响
在瓶式发酵过程中,物料易结块,抖料是将块状物料拍散成颗粒状的过程。 作者对是否抖料及抖料次数进行研究,结果见图5。
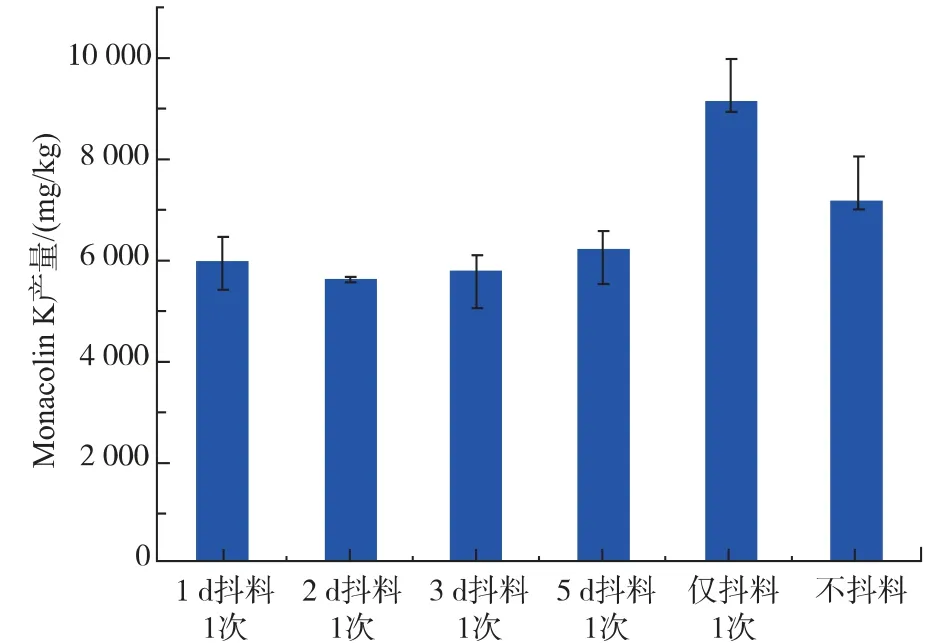
图5 抖料次数对红色红曲菌9901 固态发酵产MK 的影响Fig. 5 Effect of shaking times on MK production in SSF of Monascus ruber 9901
从图5 可知,抖料次数对红色红曲菌9901 固态发酵产MK 有着较大影响。 抖料频率过高或不抖料均不利MK 的生产,可能是由于抖料次数过多对菌丝造成较大损伤,不抖料则会有结团现象,不利于基质利用造成的。当仅抖料一次时红色红曲菌9901固态发酵产MK 的产量达到最高。 因此,仅抖料一次最有利于红色红曲菌9901 固态发酵产MK。
2.5 不同加水量对红色红曲菌9901 固态发酵产MK 的影响
固态发酵基质的水分质量分数一般在40%~60%之间[12],水分过高过低均不利于红曲菌生长。 分别向固态发酵基质中添加30、35、40、45、50 mL 水,研究加水量对红色红曲菌9901 固态发酵产MK 的影响,结果见图6。
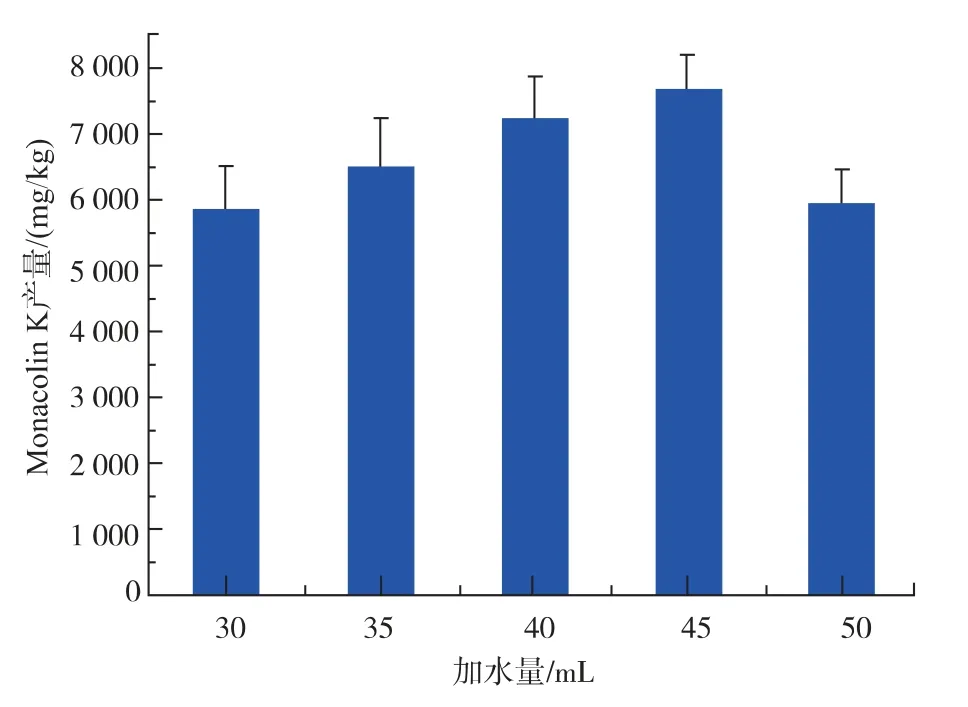
图6 不同加水量对红色红曲菌9901 固态发酵产MK 的影响Fig. 6 Effect of different water addition on MK production of Monascus ruber 9901
从图6 可以看出,随着加水量的增加,红色红曲菌9901 固态发酵产MK 的产量先增加后减少。当加水量为45 mL 时,发酵产物中MK 产量达到最高。 当加水量为30 mL 时,发酵结束后米粒质地较硬,断层稍有白色,可能是由于基质未被水渗透,从而菌体不易生长到米粒内部。 当加水量为50 mL时,发酵基质出现严重结团现象。而加水量为45 mL时,结团现象并不明显。 因此,加45 mL 水最有利于红色红曲菌9901 的生长及MK 的合成。
2.6 接种体积分数对红色红曲菌9901 固态发酵产MK 的影响
接种体积分数直接影响菌体生长进而影响次级代谢产物的合成,因此研究了不同接种体积分数对红色红曲菌9901 固态发酵产MK 的影响,结果见图7。
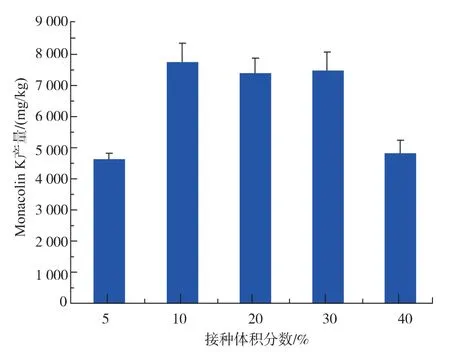
图7 接种体积分数对红色红曲菌9901 固态发酵产MK 的影响Fig. 7 Effect of inoculation amount on production of MK by SSF of Monascus ruber 9901
从图7 可以看出,随接种体积分数的增加,发酵产物中MK 产量先升高后降低。这是因为接种体积分数太少菌体生长较慢,但过大的接种体积分数会使菌体生长过快,营养物质迅速消耗,同样不利于MK的合成。当接种体积分数为10%时,发酵产物中MK产量最高。 因此10%的接种体积分数为红色红曲菌9901 固态发酵产MK 的最适接种体积分数。
2.7 不同变温方式对红曲菌9901 固态发酵产MK的影响
关于红曲菌发酵产MK 的研究大都采用变温培养,但不同菌株变温方式不同[4,10]。因此,作者采用先30 ℃或32 ℃培养然后变温到25 ℃培养,从而确定红色红曲菌9901 固态发酵产MK 的最佳培养方案。
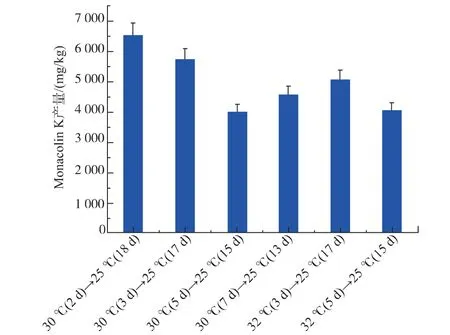
图8 不同变温方式对红色红曲菌9901 固态发酵产MK 的影响Fig. 8 Effect of different temperature on MK production by Monascus ruber 9901
从图8 可以看出,在所选的条件中,最适合红色红曲菌9901 固态发酵产MK 的培养条件为:30 ℃培养2 d,变温到25 ℃继续培养18 d。30 ℃及32 ℃培养时红曲菌体生长较快,营养物消耗也快。 但由于红曲菌固态发酵产MK 发酵周期为20 d,如果在30 ℃或32 ℃培养过久, 可能到了后期生产次级代谢产物时营养物质已经消耗殆尽。 故30 ℃培养2 d,变温到25 ℃继续培养18 d 为红色红曲菌9901 固态发酵产MK 的最适条件。
2.8 红色红曲菌9901 固态发酵产MK 响应面优化结果
根据Box-Behnken 中心组合实验设计原理和单因素试验的结果,选取加水量、变温时间及接种量作为自变量,设计了3 因素3 水平的响应面分析实验。 以MK 产量作为考核指标进行实验,相关的设计与结果见表3。
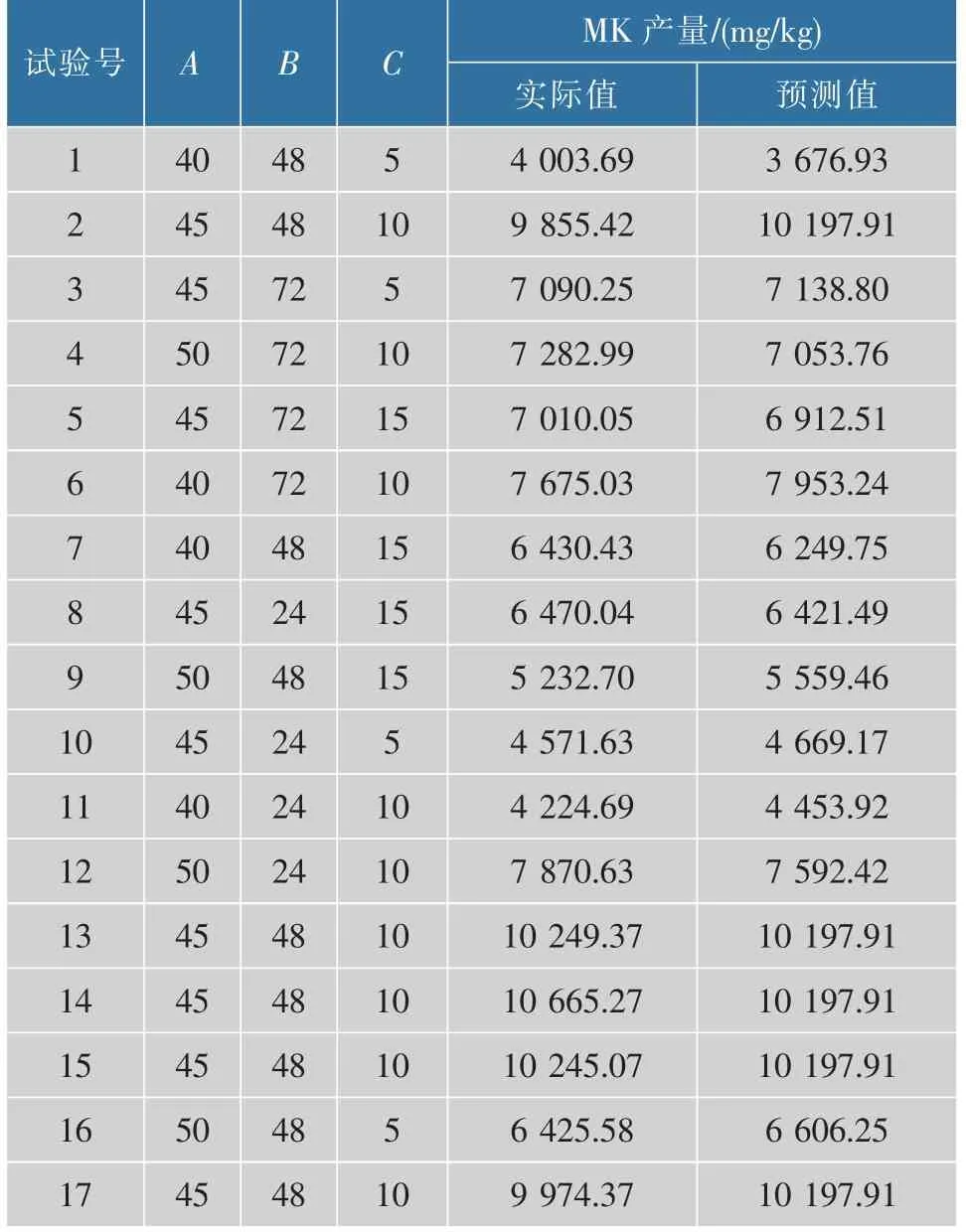
表3 响应面实验设计及结果Table 3 Response surface experimental design and results
采用Design-Expert 8.0.1 对实验结果进行二次回归拟合,得到红色红曲菌固态发酵产MK 的回归方程为:Y=10 197.90+559.76A+740.17B+381.51C-1 009.50AB-904.90AC-494.65BC-2 098.48A2-1 336.09B2-2 576.32C2。 回归模型分析见表4。 模型P值小于0.01 说明该模型极显著; 失拟项为0.267 9, 大于0.05,说明回归方程没有失拟,所以该模型可信度较高。 因变量与自变量之间的线性关系显著R2Adj=0.987 6,模型调整复相关系数R2Adj=0.971 8,说明该模型与实验拟合良好,该回归方程能够用来描述各因素与响应值之间的关系。
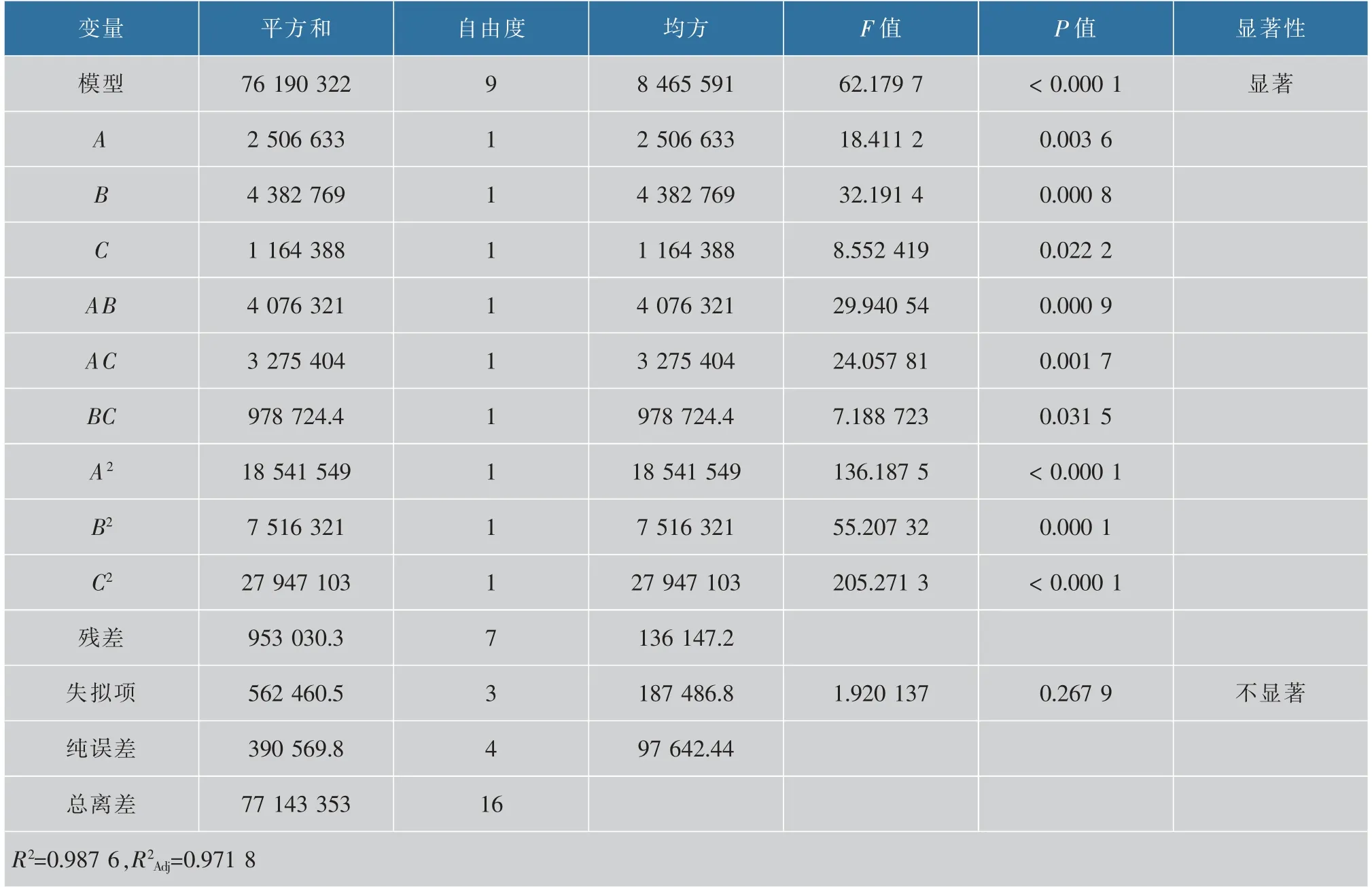
表4 回归模型分析结果Table 4 Regression model analysis results
如图9 所示,从3D 响应面图可以看出曲面最高点均在响应面上,故各因素最优水平在所选范围之内。 各因素对红色红曲菌9901 影响越大,其3D响应面图越为陡峭。 从以上结果可以看出A(加水量)、B(30 ℃培养时间)对红色红曲菌9901 固态发酵产MK 影响较大。 结合表4 可以看出,三者的交互作用AB>AC>BC。
用Design-Expert 以MK 产量最高为目标, 对模型进行优化,当加水量为45.33 mL,30 ℃培养53.86 h,接种体积分数为10.19%时, 红色红曲菌9901 固态发酵产物中MK 产量为10 314.4 mg/kg。 为了方便生产,以初始水分质量分数为10%左右的广西早籼米作为固态发酵基质,加水量为45 mL,接种体积分数10%,先于30 ℃培养50 h,然后变温到25 ℃培养至20 d,在此条件下MK 产量达到10 453.07 mg/kg,与模型预测结果差异不大,说明该模型预测值与实验值具有良好的拟合性。
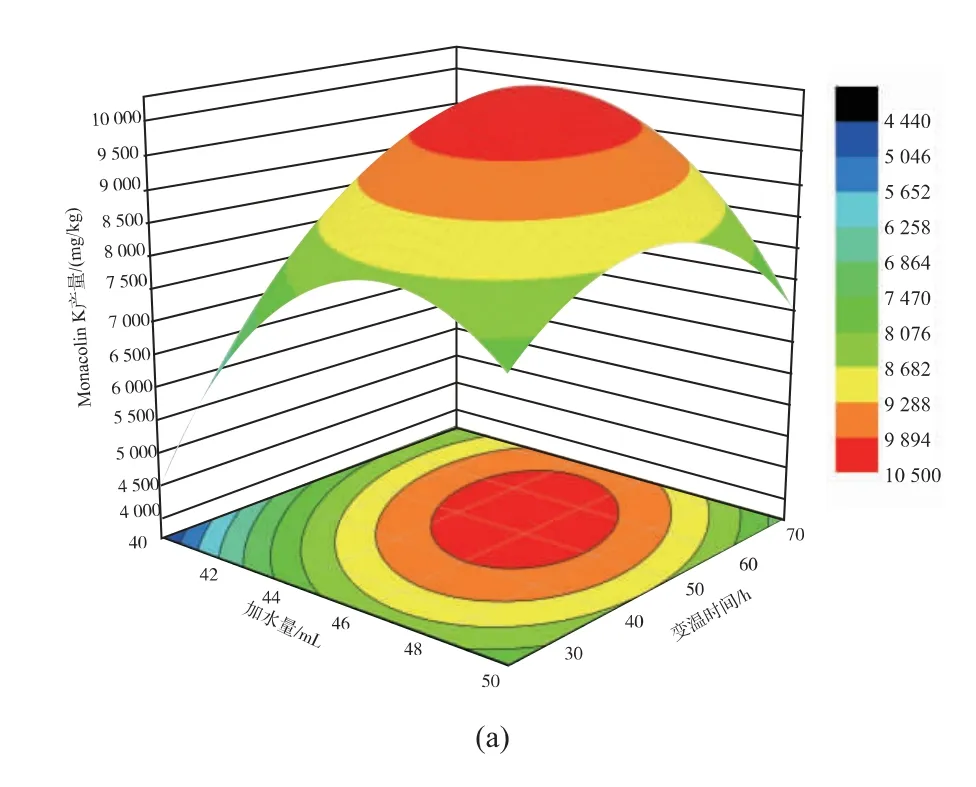
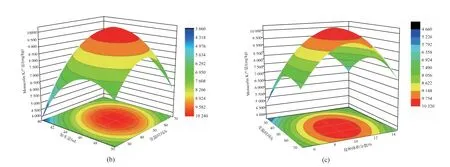
图9 响应面3D 图及平面图Fig. 9 Response 3D surface and contour
3 结 语
通过对实验室保藏的7 株红曲菌进行筛选,从中筛选出一株高产MK 的红色红曲菌9901,通过不同谷物基质筛选,最终选择了粘性较小的广西早籼米作为固态发酵基质。用Box-Behnken Design 对红色红曲菌固态发酵的加水量、 接种体积分数及30 ℃培养时间进行优化,从而确定色红曲菌固态发酵产MK 的最佳发酵条件为: 加水量45 mL,30 ℃培养50 h,然后变温到25 ℃培养20 d,接种体积分数为10 %。 在不添加无机盐及额外碳源、氮源的条件下,红色红曲菌9901 固态发酵产物中MK 的产量可达10 453.07 mg/kg。
