Bacillus stearothermophilus 麦芽糖淀粉酶在Bacillus subtilis 中的重组表达及发酵优化
2020-05-11李雨桐宿玲恰
李雨桐, 宿玲恰, 吴 敬, 吴 丹
(1. 食品科学与技术国家重点实验室, 江南大学, 江苏 无锡214122;2. 江南大学 生物工程学院, 江苏 无锡214122;3. 江南大学 教育部食品安全国际合作联合实验室,江苏 无锡214122)
麦芽糖淀粉酶(Maltogenicamylases,EC3.2.1.133),是糖苷水解酶13 家族中的一员[1],可以催化麦芽三糖、淀粉和糊精中(1→4)-α-D-糖苷键的水解,通常在外部随机水解,也可进行内部水解[2]。 除了水解作用外,麦芽糖淀粉酶还催化转糖基作用的进行[3]。 麦芽糖淀粉酶在淀粉糖化工业、食品烘焙、面粉工业中的应用广泛[4]。 特别是麦芽糖淀粉酶能够减少支链淀粉的老化,在烘培工业中可作为抗老化剂水解淀粉生成麦芽糖和部分糊精,延长烘焙食品的货架期[2,5],减少食品的浪费。
麦芽糖淀粉酶来源众多, 包括地衣芽孢杆菌(Bacillus licheniformis)[6]、嗜热脂肪芽孢杆菌(Bacillus stearothermophilus)[7]、嗜热放线菌(Thermus vulgaris)[8]等。 目前,研究者主要将麦芽糖淀粉酶在大肠杆菌或枯草芽孢杆菌中异源表达[9],但因为大肠杆菌在生长产酶的过程中会产生内毒素等, 是一种致病菌,对人体不利,限制了其应用。 而枯草芽孢杆菌是一种非致病的土壤微生物,已被美国食品药物管理局以及中国相关部门认定为是一种食品安全级菌株GRAS(Generally recognized as safe)。 且其具有良好的蛋白质合成和分泌能力、 清楚的分子遗传背景、较为成熟的发酵工艺,是工业生产酶制剂的典型菌株,因此以枯草芽孢杆菌为宿主进行麦芽糖淀粉酶的生产具有很大优势[10-11]。
目前已有多篇报告研究了不同来源的麦芽糖淀粉酶在枯草芽孢杆菌中的异源表达。 1984 年,位于日本的Outtrap 团队首次以枯草芽孢杆菌为宿主克隆表达了来源于B. stearothermuphilus的麦芽糖淀粉酶,并对其性质和应用都做了初步的探究[12]。更有全球工业酶制剂主导企业诺维信公司,推出了主打产 品“Novamyl”,是B. stearothermuphilus麦芽糖淀粉酶以枯草芽孢杆菌为宿主,经深层发酵以及蛋白质纯化制成[13]。沈微等人在地衣芽孢杆菌麦芽糖淀粉酶5′端添加地衣芽孢杆菌α-淀粉酶基因信号肽后转化枯草芽孢杆菌,最终发酵上清液酶活为5.9 U/mL[14]。2016 年,柳梅梅等人以pHCMCO4-Pglv 为载体,重组构建绿色糖单孢菌麦芽糖淀粉酶基因并转入枯草芽孢杆菌中表达,胞外酶活可达257 U/mL[15]。 杨韵霏等人则实现了地衣芽孢杆菌麦芽糖淀粉酶在枯草芽孢杆菌中的高效异源表达,酶活高达296.64 U/mL[10]。
有研究表明,氮源、碳源的种类和浓度对枯草芽孢杆菌表达目的产物的多少具有很大的影响,在高密度补料分批发酵过程中,补料的碳源、氮源对菌体生长及产物的产生也都有着重要的影响[16-17]。
来源于嗜热脂肪芽孢杆菌的麦芽糖淀粉酶在细菌麦芽糖淀粉酶中其温度稳定性最好,80 ℃保温35 h 后仍有50%的酶活力,在麦芽糖浆制备和抗面包老化中应用性能良好[17-18]。 本研究将嗜热脂肪芽孢杆菌来源的麦芽糖淀粉酶在枯草芽孢杆菌中进行克隆表达;对麦芽糖淀粉酶进行摇瓶发酵的氮源种类、氮源质量浓度、碳源质量浓度等条件进行优化,确定其最佳产酶条件;对其最适温度、最适pH、Km及比活等酶学性质进行了研究。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒 菌株Escherichia coliJM109 和Bacillus subtilisCCTCC M 2016536、质粒pHY300PLK(带有amyE 启动子与YvcE 信号肽)和opt-amyM/T:作者所在实验室保藏。
1.1.2 酶与主要试剂 In-Fusion HD Cloning Plus kit 试剂盒、Primer Star Taq DNA 聚合酶、dNTPs、四环素、氨苄抗生素:均购自Takara 公司;质粒抽提试剂盒、DNA 纯化试剂盒、DNA 回收试剂盒: 均购自北京康为世纪生物科技有限公司;蛋白胨、酵母粉:购自英国Oxiod 公司;其他试剂如氯化钠、甘油等:均购自国药集团;引物:购自上海睿迪生物科技有限公司。
1.1.3 培养基 Luria-Bertani(LB)液体培养基(g/L):酵母粉5.0,蛋白胨10.0,氯化钠10.0。
LB 固体培养基: 在LB 液体培养基中加入1.5~2.0 g/dL 的琼脂糖。
Terrifie Broth(TB)培养基(g/L):酵母粉24.0,蛋白 胨12.0, 甘 油5.0,KH2PO42.31,K2HPO4·3H2O 16.43。
1.2 方法
1.2.1 引物设计 以质粒opt-amyM/T为模板,按照In-Fusion HD Cloning Plus kit 试剂盒要求的同源臂引物设计原则设计引物如下:F1:5’-AAAACT GCATCGGCGTCTTCTTCTGCAAGCGTTAAA-3’,R1:5’-TTTATTACCAAGCTTTTAGTTCTGCCAAGTCAC AGTAATG-3’。 以pHY300PLK 载体质粒为模板,以同源臂引物设计原则为准则,设计引物如下:F2:5’-AAGCTTGGTAATAAAAAAACA-3’,R1:5’-CGCCG ATGCAGTTTTACTTG-3’。
1.2.2 运用PCR 扩增获得目的基因与表达载体 以质粒opt-amyM/T为模板,正反向引物为F1/R1 扩增amyM 基因片段。PCR 的参数为:预变性94 ℃5 min,变性98 ℃10 s,退火55 ℃15 s,延伸72 ℃2 min 10 s,30 个循环;保存:72 ℃10 min,之后存放于4 ℃。
质粒pHY300PLK 作为为模板, 正反向引物为F2/R2 扩增表达载体片段。 进行PCR 的参数为:预变性94 ℃5 min,变性98 ℃10 s,退火55 ℃15 s,延伸72℃6 min,30 个循环; 保存:72 ℃10 min,之后存放于4℃。
1.2.3 连接与鉴定 目的基因与表达载体经过PCR 扩增及核酸胶跑胶回收, 根据In-Fusion@HD Cloning Kit 试剂盒要求, 按照插入片段和载体的摩尔比例为2∶1 进行混合。 连接体系中连接酶5X In-Fusion HD Enzyme Premix 为2 μL,插入片段和载体经回收后测出DNA 浓度,计算加入量,最后用dH2O补齐总体系至10 μL。 连接完毕后将连接产物转入E.coliJM109 感受态细胞。
培养后涂布含100 μg/mL 氨苄抗生素的LB 固体平板,37 ℃培养过夜。 待单菌落长出后,于LB 液体培养基中挑入单菌落培养8~10 h,收集菌体抽提质粒,分别用F1/R1 与F2/R2 为引物并以此质粒为模板进行PCR 验证,验证正确后送至生工生物工程有限公司进行测序, 测序正确后转入表达宿主Bacillus subtilisCCTCC M 2016536 感受态细胞中,培养后涂布含20 μg/mL 四环素抗性的LB 固体培养基中,于37 ℃恒温培养箱中过夜培养8~10 h,待单菌落长出后于液体LB 中挑入单菌落并培养8~10 h,保存至甘油管中(甘油终体积分数15%)并收集菌体抽提质粒, 用1.2.1 中引物进行PCR 验证正确后确定转入表达宿主中。
1.2.4 摇瓶发酵 从甘油管中以2%的接种体积分数接种入LB 液体培养基中(含20 μg/mL 四环素抗性),37 ℃、200 r/min 培养8~10 h。 以5%接种体积分数至TB 培养基中,在37 ℃培养2 h 后转入33 ℃培养48 h。 发酵完毕后离心10 min,弃去菌体沉淀,转速为12 000 r/min,取发酵上清液即为酶液。
1.2.5 麦芽糖淀粉酶活力的测定及蛋白质检测酶活测定方法使用DNS 法[12],配置1%的可溶性淀粉溶液,取1 mL 于试管中,加入50 mmol/L、pH 5.5的NaH2PO4-Na2HPO4缓冲液900 μL, 于60 ℃预热10 min 后加入100 μL 酶液反应10 min,反应以加入3 mL DNS 进行终止,在100 ℃沸水中煮沸7 min 进行显色, 冷却后加入10 mL 水至终体积为15 mL,于540 nm 处测量吸光值。 麦芽糖淀粉酶酶活单位定义为:在上述条件下,每分钟催化产生相当于1 μmol葡萄糖所需的酶量为一个淀粉水解活力单位[9]。 使用SDS-PAGE 对麦芽糖淀粉酶进行检测。
1.2.6 菌浓(OD600)的测定 用分光光度计在600 nm处进行吸光值的测量, 此时应将发酵液稀释得当,菌浓(OD600)=稀释倍数×600 nm 处的度数。
1.2.7 摇瓶发酵中培养基、培养条件对重组菌产酶的影响 考察多种酵母粉、工业蛋白胨、大豆蛋白胨、棉籽粉、玉米浆、酵母浸膏6 种氮源、酵母浸膏和大豆蛋白胨的氮源复配对产酶的影响。 氮源分别为5.0、10.0、15.0、20.0、25.0、30.0 g/L;甘油、葡萄糖、蔗糖、麦芽糖、可溶性淀粉、玉米糊精6 种碳源,分别为1.0,5.0、10.0、15.0、20.0、25.0 g/L; 初始pH 分别为5.5、6.0、6.5、7.0、7.5、8.0、8.5;发酵温度分别为33、37、41、45、49 ℃。
1.2.8 对麦芽糖淀粉酶进行纯化 为进一步对麦芽糖淀粉酶进行性质分析,因此对麦芽糖淀粉酶进行纯化。 通过热处理、硫酸铵沉淀、过夜透析、Mono QTM10/100 GL 阴离子交换色谱柱过柱后,麦芽糖淀粉酶可以达到电泳纯。
1.2.9 麦芽糖淀粉酶酶学性质研究
1)最适反应pH 的研究:在60 ℃下,分别测定在 不 同pH 缓 冲 溶 液(2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8、8.5) 配制的可溶性淀粉底物中的水解酶活力,以测得的最高酶活力值为100%,计算相对酶活力,确定最适的反应pH。
2)最适反应温度的研究:在最适pH 的条件下,分别测定在不同温度(30、40、50、60、70、80、90 ℃)下麦芽糖淀粉酶的淀粉水解活力,以测得的最高酶活为100%,计算相对酶活力,确定最适反应温度。
3)在最适温度下麦芽糖淀粉酶半衰期的测定:将麦芽糖淀粉酶置于最适反应温度下,每过一段时间取样,测量酶活,以未处理的酶活力为100%,计算在最适反应温度下酶的半衰期。
4)麦芽糖淀粉酶动力学参数的测定:用最适反应pH 缓冲液配制可溶性淀粉底物, 于最适反应温度下进行酶活的测量。 在上述条件下,配制不同浓度的可溶性淀粉溶液,分别测定麦芽糖淀粉酶初始水解活力,采用GraphPad Prism 5.0 软件,得到米氏(Michaelis-Menten)方程,计算得到Kcat值。
5)麦芽糖淀粉酶比活力的测定:在最适反应条件下测定纯化后麦芽糖淀粉酶酶活,采用考马斯亮蓝染色(Bradford)法测定纯化后酶的蛋白质含量,计算麦芽糖淀粉酶比活力。
2 结果与分析
2.1 重组菌的构建与摇瓶发酵
以质粒opt-amyM/T为模板, 用PCR 仪扩增amyM基因。以质粒pHY300PLK(带有amyE 启动子与YvcE 信号肽)为模板,用PCR 仪扩增出表达载体片段。 扩增出的目的基因及表达载体产物用1.0 g/dL的琼脂糖凝胶电泳检测,目的基因与表达载体片段大小分别约为2 100、5 900 bp。 验证正确后用1.0 g/dL的琼脂糖凝胶进行分离回收。 目的基因片段与表达载体片段用In-Fusion 连接酶连接后转入E.coliJM109 感受态细胞中, 培养并涂布于固体LB 平板上,过夜培养后挑单菌落于LB 液体培养基中,培养8~10 h 后抽提质粒,PCR 验证正确后将质粒送于测序公司, 序列验证正确后转入表达宿主B.subtilisCCTCC M 2016536 中,培养后涂布LB 平板,挑单菌落于LB 液体培养基中,培养后抽提质粒进行验证,确定重组菌株构建成功, 保菌于15%甘油管中,见图1。

图1 麦芽糖淀粉酶琼脂糖凝胶电泳分析Fig. 1 Agarose gel electrophoresis analysis of maltogenic amylases
重组菌进行摇瓶发酵,48 h 后发酵完毕, 离心取发酵上清液即为麦芽糖淀粉酶酶液, 对发酵上清液进行SDS-PAGE 分析,见图2。 相对分子质量69 000附近出现明显的特异性蛋白质条带, 为麦芽糖淀粉酶理论相对分子质量。 测定重组菌胞外酶活力为250.7 U/mL。

图2 麦芽糖淀粉酶蛋白质电泳分析Fig.2 SDS-PAGE analysis of maltogenic amylases
2.2 摇瓶发酵优化
2.2.1 氮源种类对重组菌生长和产酶的影响 分别以酵母粉、工业蛋白胨、大豆蛋白胨、棉籽粉、酵母浸膏及玉米浆代替TB 培养基中的酵母粉和蛋白胨进行氮源优化。固定其质量浓度为15 g/L,其他培养基中成分不变,按1.2.4 进行发酵产酶,见图3。采用酵母浸膏作为氮源时,48 h 胞外酶活最高可达315.68 U/mL, 但此时菌体浓度最低, OD600只能达到3.8 左右; 而大豆蛋白胨作为培养基中惟一氮源时,酶活只能达到270.64 U/mL,但是此时菌体浓度能达到5.8 左右, 是这几种氮源中最能促进菌体生长的氮源。

图3 氮源种类对重组菌生长和产酶的影响Fig. 3 Effects of various nitrogen sources on biomass and maltogenic amylases production
2.2.2 氮源复配对重组菌生长和产酶的影响 以总氮源为15 g/L,分别以酵母浸膏7.5 g/L 与同样质量浓度的酵母粉、工业蛋白胨、大豆蛋白胨、棉籽粉及玉米浆作为复合氮源。 如图4 所示,当酵母浸膏与大豆蛋白胨进行复配后,48 h 胞外酶活最高可达329.67 U/mL,且其OD 为4.5,因此采用酵母浸膏与大豆蛋白胨复合氮源作为重组菌的氮源。
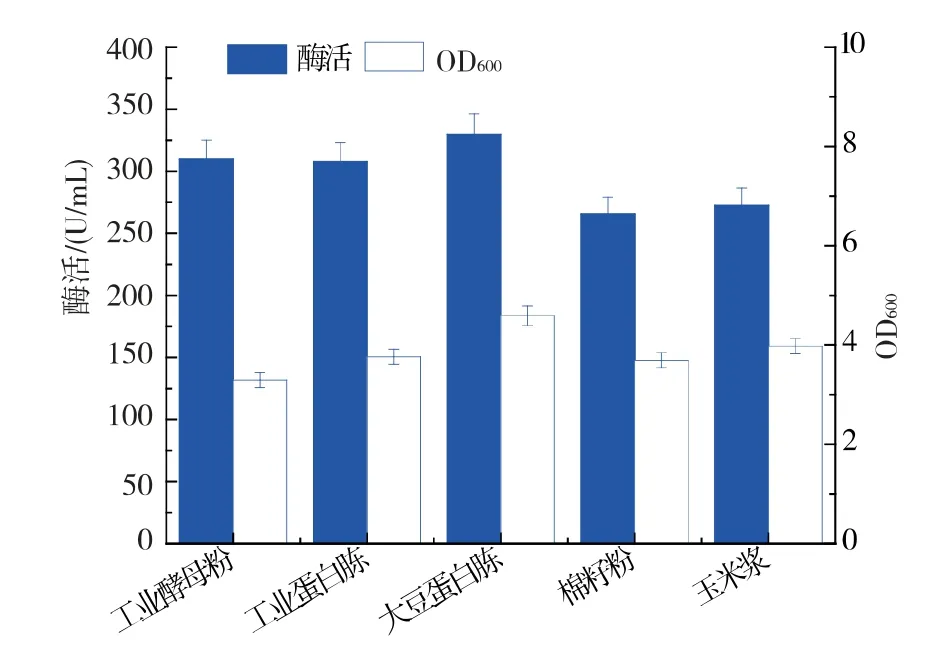
图4 氮源复配对重组菌生长和产酶的影响Fig. 4 Effect of nitrogen source compounding on biomass and maltogenic amylases production
2.2.3 复配时大豆蛋白胨与酵母浸膏的质量浓度对菌体生长和产酶影响 因酵母浸膏对菌体产酶影响最大, 因此首先以5 g/L 大豆蛋白胨分别与5、10、15、20、25、30 g/L 酵母浸膏进行复配作为总氮源进行摇瓶发酵,见图5。随着酵母浸膏质量浓度的升高,菌体生长也不断增加。 在酵母浸膏质量浓度为15~25 g/L 之间时, 菌体产酶最为适宜且相差不大,但氮源质量浓度在25 g/L 以下时菌体生长不好,因此以25 g/L 酵母浸膏为最适。 在此基础上,以25 g/L酵母浸膏分别与1、5、10、15、20、25、30 g/L 大豆蛋白胨进行复配作为总氮源进行摇瓶发酵,见图6。随着大豆蛋白胨质量浓度的升高, 菌体生长更加良好, 但是当大豆蛋白胨的质量浓度超过15 g/L 时,菌体生长开始出现下降趋势,菌体的生长反而受到了抑制,可能是因为氮源的质量浓度过高导致。 而菌体产酶随着大豆蛋白胨质量浓度的升高而降低,其中以5 g/L 大豆蛋白胨最佳。 因此以25 g/L 酵母浸膏与5 g/L 大豆蛋白胨作为培养基中的复合氮源,酶活可达345 U/mL。

图5 复配时酵母浸膏的质量浓度对菌体生长和产酶影响Fig. 5 Effect of yeast extract concentration on biomass and maltogenic amylases production

图6 复配时大豆蛋白胨的质量浓度对菌体生长和产酶影响Fig. 6 Effect of soy peptone concentration on biomass and maltogenic amylases production
2.2.4 碳源种类对重组菌和产酶的影响 选择2.2.3 中优化出的复合氮源作为培养基中的氮源,以5 g/L 的甘油、葡萄糖、蔗糖、麦芽糖、可溶性淀粉、玉米糊精分别作为培养基中惟一碳源进行摇瓶发酵,结果见图7。以葡萄糖或甘油为碳源时,菌体的生长浓度及产酶都很相近,而其他种类的碳源产酶均低于这两种碳源,表明葡萄糖和甘油对枯草芽孢杆菌的生长和产酶均具有良好的作用。 而在甘油和葡萄糖中,以甘油为惟一碳源时菌体产酶最佳,最高酶活为345.7 U/mL。
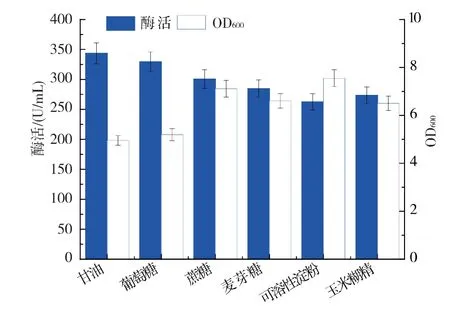
图7 碳源种类对重组菌和产酶的影响Fig. 7 Effect of various carbon source on biomass and maltogenic amylases production
2.2.5 碳源质量浓度对重组菌和产酶的影响 以甘油为培养基中惟一碳源进行最佳碳源质量浓度的探究。 以优化好的复合氮源作为惟一氮源,分别以1、5、10、15、20、25 g/L 的甘油作为培养基中惟一碳源,结果见图8。菌体的生长浓度显示不同碳源质量浓度对其影响并不大,但是随着甘油质量浓度的升高,菌体产酶逐渐下降,推测枯草芽孢杆菌在低质量浓度碳源下更利于产酶,以5 g/L 的甘油为最佳。

图8 碳源质量浓度对重组菌和产酶的影响Fig. 8 Effect of carbon source concentration on biomass and maltogenic amylases production
2.2.6 初始pH 对重组菌生长和产酶的影响 确定了培养基中的氮源和碳源后,为了进一步优化重组菌最适生长产酶条件, 确定初始pH 对重组菌的影响, 使用磷酸和氨水对初始培养基的pH 进行调整并进行摇瓶发酵。 如图9 所示,随着pH 的升高,菌体浓度逐渐下降,推测枯草芽孢杆菌在偏酸的环境中更易生长, 酶活在pH 6.5 处达到最高, 随着pH的升高或者降低都逐渐降低, 因此确定最佳初始pH 为6.5,此时麦芽糖淀粉酶胞外酶活为357.7 U/mL。
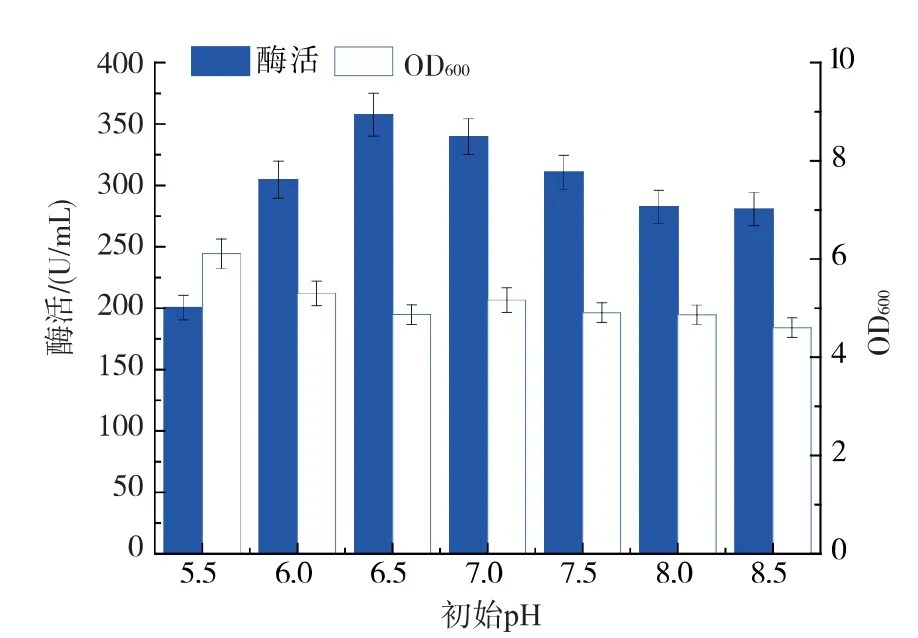
图9 初始pH 对重组菌生长和产酶的影响Fig. 9 Effect of initial pH on biomass and maltogenic amylases production
2.2.7 温度对重组菌生长和产酶的影响 培养温度对菌体生长和产酶过程都具有很大的影响, 适宜的温度会使菌体保持良好的活力, 促进菌体产酶。 用上述优化好的条件,研究温度对重组菌的影响。 如图10 所示,研究33、37、41、45、49 ℃下重组菌生长和产酶情况。 随着温度的升高,菌体的生长浓度逐渐降低,可见在高温下,菌体生长情况并不良好。 但是随着温度升高, 菌体产酶逐渐增加,在41 ℃达到最佳,为396 U/mL;随后逐渐下降,在49 ℃出现大幅度的下降, 因此确定41 ℃进行摇瓶发酵为最佳。

图10 温度对重组菌生长和产酶的影响Fig. 10 Effect of temperature on biomass and maltogenic amylases production
2.3 麦芽糖淀粉酶酶学性质的鉴定
2.3.1 最适反应pH 的研究 将麦芽糖淀粉酶置于不同pH (2.5~8.5)缓冲液中测定酶活力。 如图11 所示, 麦芽糖淀粉酶在pH 3.5~7 之间均保有60%以上的酶活力。低于3.5 及高于7 时,酶活力迅速下降,在pH 5.5 时最适。表明麦芽糖淀粉酶的适应pH 范围较广,且在偏酸环境下更为适宜。

图11 最适反应pH 值Fig. 11 Optimal pH
2.3.2 最适反应温度的研究 将麦芽糖淀粉酶置于pH 5.5 下,于不同温度(30~90 ℃)中测量酶活,结果见图12。 60 ℃为最适反应温度,50~80 ℃下均保留有80%以上的酶活, 且低于40 ℃时酶活较大幅度下降。 由此可见,麦芽糖淀粉酶的适应温度范围较广,且更适宜于高温。
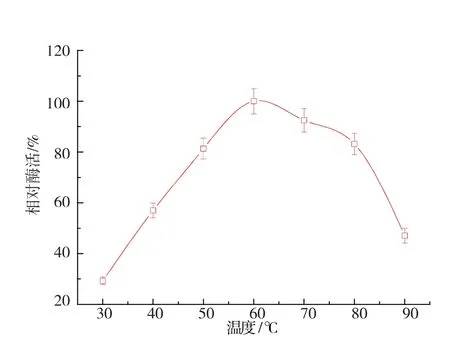
图12 最适反应温度Fig. 12 Optimal temperature
2.3.3 最适温度下的麦芽糖淀粉酶半衰期的测定将麦芽糖淀粉酶置于60 ℃水浴锅中, 每隔一段时间取样测量酶活, 以确定麦芽糖淀粉酶的半衰期,见图13。麦芽糖淀粉酶在60 ℃下,半衰期高达325 h 之久,十分稳定。

图13 重组麦芽糖淀粉酶的温度稳定性Fig. 13 Temperature stability of recombinant maltogenic amylase
2.3.4 对麦芽糖淀粉酶的动力学参数及比酶活的测量 用麦芽糖淀粉酶最适pH 缓冲液配制不同质量浓度的淀粉底物, 在最适反应温度下进行反应,测量麦芽糖淀粉酶的动力学参数,Km为0.95 g/L,比酶活为2 646 U/mg。 通过一系列纯化操作,将麦芽糖淀粉酶进行纯化,见图14,可见麦芽糖淀粉酶已纯化至电泳纯。

图14 麦芽糖淀粉酶纯化至电泳纯Fig. 14 Purification of maltogenic amylase
在最适条件下测量纯化后麦芽糖淀粉酶酶活,并用考马斯亮蓝测定其蛋白质含量,得到麦芽糖淀粉酶比酶活。
3 讨 论
麦芽糖淀粉酶在麦芽糖浆的制备中有很好的作用,其具有多底物特异性,对于麦芽三糖、淀粉及一些寡糖均具有水解作用[20]。 近年来随着烘焙食品的逐渐发展,烘焙食品的贮藏周期短是急需要解决的一个问题。
由于TB 培养基营养丰富, 较为适合枯草芽孢杆菌发酵生产外源蛋白质[19],所以在TB 培养基基础上进行发酵优化。 在本研究中,酵母浸膏和大豆蛋白胨分别作为单一氮源时, 前者有菌体浓度不高、后者有酶活方面略差的缺点,因此使用酵母浸膏与大豆蛋白胨作为复合氮源。 相比较初始摇瓶培养温度,重组菌在41 ℃产酶最好,酶活最高,可能因麦芽糖淀粉酶来自于嗜热脂肪芽孢杆菌,本身在高温下酶的折叠性较低温下好。
经酶学性质的研究,发现枯草芽孢杆菌中表达的麦芽糖淀粉酶比在大肠杆菌中的适应pH 范围和温度范围都更加广泛,实际应用时更有优势。 在烘焙食品方面,除了麦芽糖淀粉酶,还有一些淀粉酶也可以水解淀粉生成麦芽糖及糊精,但是其最适温度都存在过低或过高使得在加工过程中及加工过程后灭活的过程中出现问题。 而麦芽糖淀粉酶的最适温度处于一个较为适宜的水平,既不会因为加工过程中温度较高而失活, 又能在加工后被有效灭活,不引起淀粉的过度分解致使面团发黏,因此其抗淀粉老化能力较好,可以有效地保持面包的弹性及新鲜程度。 尽管麦芽糖淀粉酶在大肠杆菌中的表达可高达4 379 U/mL[9],但是以大肠杆菌为宿主发酵生产的麦芽糖淀粉酶不宜用于食品工业,枯草芽孢杆菌作为一个具有安全性及分泌潜力的宿主菌,对产生麦芽糖淀粉酶并用于食品烘焙行业是非常具有竞争力的。
作者采用B.stearothermophilus来源的麦芽糖淀粉酶基因在枯草芽孢杆菌中进行表达,通过优化重组菌的发酵条件,确定了麦芽糖淀粉酶摇瓶发酵的最佳培养基及温度等,同时对麦芽糖淀粉酶的酶学性质及动力学参数进行了简单的测量,为其在食品行业的应用奠定了基础。
4 结 语
将B.stearothermophilus来源的麦芽糖淀粉酶基因在枯草芽孢杆菌中进行克隆表达, 在TB 培养基中摇瓶发酵48 h 后, 麦芽糖淀粉酶活力可达250.7 U/mL。 在此基础上对重组菌摇瓶发酵条件进行优化,确定重组菌发酵最适宜条件为:氮源(酵母浸膏25 g/L,大豆蛋白胨5 g/L)30 g/L、甘油5 g/L、初始pH 6.5、培养温度41 ℃。 最佳发酵条件下麦芽糖淀粉酶酶活可达396 U/mL。测定麦芽糖淀粉酶最适反应温度为60 ℃、最适pH 为5.5,麦芽糖淀粉酶的反应温度和pH 的适应范围都很广泛、在60 ℃下半衰期为325 h、动力学参数Km为0.95 g/L、比活为2 646 U/mg,在食品等工业上都具有良好的应用前景。
