一株Bifidobacterium longum CCFM760 的生理特性、安全性评价和基因分析
2020-05-11应聪萍张秋香
应聪萍, 陈 卫, 张 灏, 张秋香
(江南大学 食品学院,江苏 无锡214122)
益生菌广泛应用于乳制品、保健品、功能性食品、药品、日用品及饲料等制品中。 卫生部2010 年发布了《可用于食品的菌种名单》,可食用益生菌包括乳杆菌属、双歧杆菌属和链球菌属在内的3 个菌属大类的21 种菌种[1]。 截至2016 年,这份名单进行了多次更新,目前已有10 个菌属大类的35 种菌种被列入可食用菌种名单[2-3]。 双歧杆菌作为重要的可食用益生菌之一,可以调节肠道微生态、预防或缓解胃肠道疾病。 而双歧杆菌能否发挥作用取决于其在通过胃肠道过程中存活的能力、以及与胃肠道中的病原体持续存在和竞争的能力。 Ng 等人[4]研究表明,双歧杆菌能够抑制病原菌侵入肠道。 此外,益生菌菌株与病原菌的拮抗活性与其个体独特的代谢特性和环境氧气含量有关[5]。 Annuk 等人[6]研究发现,特定种类的乳酸细菌的分泌化合物取决于生长期间的氧气张力,说明抗氧化能力在一定程度上影响双歧杆菌有益代谢物的合成。 值得关注的是,双歧杆菌菌株在商业化前需要进行抗生素耐药性检测来对菌株的安全性进行评价。 目前已有的研究发现,大多数双歧杆菌对万古霉素、萘啶酸、新霉素、多粘菌素B、卡那霉素、庆大霉素、链霉素和灭滴灵具有耐受能力[7]。 基因组序列保留了对微生物进行生物学研究的关键基本信息, 通过相关基因测序,可以对菌株的糖代谢、抗氧化能力和抗生素耐药性等进一步分析说明。 因此,在开发益生菌产品时,进一步考虑益生菌菌株的生理特性、益生功能和安全性评估等问题十分重要。
Bifidobacterium longumCCFM760 菌株分离自江苏省无锡市滨湖区两岁健康幼女粪便。 前期研究发现,其具有缓解便秘功能,现已保藏于中国微生物菌种保藏管理委员会普通微生物中心(CGMCC No.15032)。 作者对其进行生理特性研究、安全性评价和相关基因分析,并以商业菌株B. animalissubsp.lacticBB12 为对照, 来更加详细的了解B. longumCCFM760 菌株的各项指标,为进一步开发利用该菌株提供数据支持,并为广大消费者及临床提供参考。
1 材料与方法
1.1 试剂及培养基
低聚果糖(95%)、低聚异麦芽糖(90%):保龄宝生物股份有限公司;低聚半乳糖(90%):量子高科生物股份有限公司;低聚乳果糖(90%):日本明治公司;低聚木糖(95%):龙力生物科技股份有限公司;乳酮糖(99.3%):EMD Chemicals;牛乳寡糖(98%):实验室自制;胰蛋白胨、酵母粉:OXOID 公司;胃蛋白酶:生工生物工程(上海)股份有限公司;胰蛋白酶、牛肉膏、葡萄糖、吐温-80、三水磷酸氢二钾、无水乙酸钠、柠檬酸氢二铵、七水硫酸镁、一水硫酸锰、琼脂条、L-半胱氨酸盐酸盐、氯化钠、氢氧化钠、盐酸:国药集团化学试剂公司;总SOD 活性检测试剂盒(WST-8 法):碧云天生物技术;BHI 肉汤:青岛海博生物科技股份有限公司。
改良MRS 培养基[8](1 L):牛肉膏10 g,胰蛋白胨10 g,酵母粉5 g,葡萄糖20 g,无水乙酸钠5 g,MgSO4·7H2O 0.1 g,MnSO4·H2O 0.05 g, 柠檬酸氢二铵2 g,K2HPO4·3H2O 2.6 g,吐温-80 1 mL,L-半胱氨酸盐酸盐1 g, 调节pH 为6.8±0.2,115 ℃灭菌20 min。固体培养基额外添加12~20 g/L 琼脂。
LB 培养基[9](1 L):胰蛋白胨10 g,酵母粉5 g,氯化钠10 g,121 ℃灭菌15 min。
改良MRS-低聚糖培养基: 以低聚糖代替MRS培养基中的葡萄糖,添加量为5 g/L。
人工模拟胃肠液参照Wang L[12]等人的方法配置。
1.2 菌株来源
Bifidobacterium longumCCFM760、B.animalissubsp.lacticBB12、Escherichia coli、Staphylococcus aureus、Listeria monocytogenes、Enterococcus faecium、E.faecalis: 均为作者所在实验室保藏。 其中,B.longumCCFM760 为一株专利菌株, 菌株保藏号为CGMCC No.15032。
1.3 生长和产酸能力测定
将培养过夜后的双歧杆菌以2%的接种体积分数至改良MRS 培养基中,振荡混匀,37 ℃厌氧培养20 h 后,采用倾注法进行菌落计数,检测该发酵液中的活菌数,测定培养结束后发酵液的pH。
1.4 人工模拟肠胃液耐受性测定
参考Wang L 等人[10]的方法,将实验菌株以2%的接种体积分数接种至改良MRS 培养基中,37 ℃培养20 h,进行平板计数。菌液于5 000 r/min 离心2 min, 用生理盐水清洗沉淀两次后重悬至5 mL 的人工胃液中,调节菌数浓度为109CFU/mL,混合均匀于37 ℃培养,3 h 后取样进行平板计数。 同时取1 mL 菌液离心,以5 mL 人工肠液重悬,混合均匀后于37 ℃培养,2、4、8 h 后分别进行平板计数。 存活率计算公式如下:
存活率X=(lgN1/lgN0)×100%
式中,N0:原始菌液的活菌CFU 数;N1:人工胃液或
肠液处理后的活菌CFU 数。
1.5 抑菌能力测定
参照Diao 等人[11]的方法采用牛津杯法测定双歧杆菌对肠道菌,包括食源性肠道致病菌(E. coli、S. aureus、L. monocytogenes) 以 及 肠 道 固 有 菌(E. faecium、E. faecalis) 的抑制能力。 将厌氧培养20 h 的双歧杆菌离心,取上层清液。 将肠道菌接种在相应固体培养基上(大肠杆菌、金黄色葡萄球菌为LB;单增李斯特菌为BHI;粪肠球菌、屎肠球菌为MRS)进行实验,各做3 个平行,以无菌生理盐水作对照,37 ℃培养24 h 后测量抑菌圈的大小。
1.6 利用功能性低聚糖的偏好性检测
选择低聚半乳糖(GOS)、低聚果糖(FOS)、低聚木糖(XOS)、低聚乳果糖(LS)、乳酮糖(Lac)、牛乳寡糖(BMOs)和低聚异麦芽糖(IMO)7 种益生元等量代替葡萄糖进行实验,添加量为5 g/L。 将活化3 代的双歧杆菌发酵液接种到相应的改良MRS-低聚糖培养基中,培养20 h 后测定发酵液的pH 值,分别以改良MRS 培养基和不含糖的MRS 培养基作为阳性和阴性对照。
1.7 抗生素耐受能力测定
参照MIC protocal ISO10932-2010[12]的方法,对B. longumCCFM760 进行克林达霉素、利福平、链霉素、万古霉素、卡那霉素、四环素、庆大霉素、红霉素、氯霉素、新霉素、氨苄青霉素、甲氧苄氨嘧啶、利奈唑胺和环丙沙星14 种抗生素的最小抑制浓度测定。 以方法里的一株B. longumATCC®15707TMa为对照,并以欧洲食品安全局(EFSA)制定的菌体抗生素截止值标准[13]为耐受性判断依据。
1.8 总SOD 活性检测
调节CCFM760 菌悬液浓度到108CFU/mL,取1 mL 菌液于8 000 r/min、4 ℃离心10 min, 上清液即为培养上清液;沉淀用预冷的无菌PBS 洗涤1~2遍,加入1 mL 无菌PBS,超声破碎10 min(400 W,处理时间5 s、间隔时间5 s),显微镜下检查没有完整菌体,离心后上清液即为菌体无细胞提取物。 新鲜改良MRS 培养基作为空白对照, 使用总SOD 活性检测试剂盒(WST-8 法)测定菌株的总SOD 活性。
1.9 菌株相关基因分析
将B. longumCCFM760 送华大基因进行基因组草图测序,通过Linux 系统自动识别测序结果,并通过SOAPdenovo 软件进行基因组拼接、组装。 分别下载GenBank 上的nr 数据库、 欧洲生物信息中心的Swiss-Prot 蛋白质数据库到本地服务器, 对预测基因的功能进行注释, 并下载NCBI 的COG 和String数据库对预测基因进行功能分类信息、结构域信息的二次注释。 根据注释结果分析该菌株的低聚糖代谢、抗生素抵抗和厌氧相关基因情况。
2 结果与讨论
2.1 生长和产酸能力测定
双歧杆菌的生长和产酸能力强弱与其发挥益生功效相关,良好的生长活力在促进短链脂肪酸等有益代谢产物积累的同时还可以节约发酵成本。 较强的产酸能力不仅能产生抑制某些致病菌的作用,还有助于食品加工和风味的形成, 如酸奶的凝乳。从表1 可以看出,B. longumCCFM760 的生长和产酸能力均高于B. animalissubsp.lacticBB12。
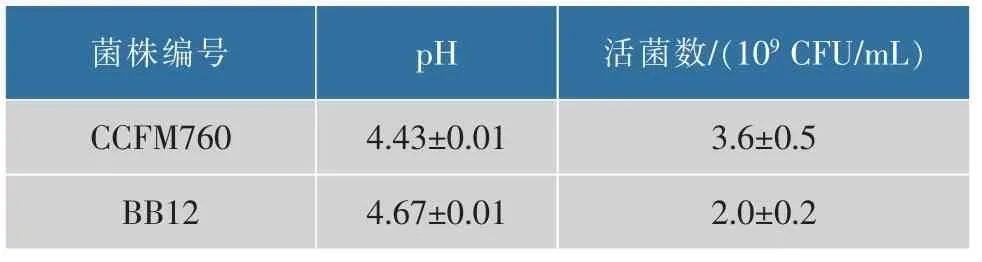
表1 双歧杆菌菌株的生长产酸能力Table 1 Growth and acid production of Bifidobacteria strains
2.2 人工模拟胃肠液的耐受能力测定
益生菌被机体摄入后发挥益生功效需要通过胃转运存活,并且到达结肠的数量足以促进定殖或能直接赋予宿主有益的作用[14]。 在通过胃肠道的过程中,益生菌遭受不利生理条件如胃酸刺激和蛋白酶水解等,生存活力可能会受到损害。 因此,人工模拟胃肠液耐受能力是筛选检验益生菌的标准之一。由表2 可以看出,B. longumCCFM760 在pH 3.0 的人工模拟胃液中3 h 存活率高达(99.85±0.10)%,略高于B. animalissubsp.lacticBB12。Izquierdo 等人[15]的研究发现,4 株商业长双歧杆菌菌株的在人工模拟胃液(pH 3.0)中存活率在87%~99%之间,分离自人类粪便的4 株长双歧杆菌的存活率则介于1%~97%;高鹏飞等人[16]筛自内蒙古儿童的3 株长双歧杆菌的耐胃酸能力为10%~95%。相比之下,B. longumCCFM760 在目前的研究中耐人工模拟胃液能力处于顶尖水平。 在人工模拟肠液中,B.longumCCFM760和B. animalissubsp.lacticBB12 的存活率随培养时间的延长呈下降趋势,8h 后存活率分别为(73.21±1.25)%和(84.86±2.92)%。 总体而言,B. longumCCFM760具有较好的人工模拟胃肠液耐受性,有利于后期进一步开发研究。

表2 双歧杆菌菌株对人工模拟胃肠液的耐受性Table 2 Tolerance of Bifidobacteria strains to simulated gastric and small intestinal juices
2.3 抑菌能力测定
益生菌菌株的一个重要特性是它们能够通过竞争性排斥、氧化还原电位降低、细菌间聚集、产有机酸、细菌素和过氧化氢等的代谢产物来达到抑菌的目的[17],该能力对于肠内微生物群的调节与治疗非常重要。 金黄色葡萄球菌和单增李斯特菌主要通过速冻食品进入人体从而引发相应疾病,大肠杆菌则存在于较多种类食品和水中。 通过研究发现,B.longumCCFM760 对两种食源性致病菌E. coli和S. aureus有显著的抑制作用, 对L. monocytogenes和肠道固有菌E. faecalis、E. faecium没有抑制作用, 总抑菌能力与市售菌株B. animalissubsp.lacticBB 12 相当,见表3。韩俊燕[9]对筛选自婴儿粪便的16 株长双歧杆菌进行抑菌实验,发现大部分菌株能够抑制E.coli,一半菌株能选择性抑制E. faecalis、E. faecium,只有3 株菌具有抑制L. monocytogenes能力; 赵佳锐[18]等人研究了3 株长双歧杆菌的抑菌能力,发现均能抑制E.faecium和L.monocytogenes,其中有两株能抑制S.aureus。相对而言,B.longumCCFM760 的抑菌能力与大部分长双歧杆菌的抑菌谱比较接近。

表3 双歧杆菌菌株的抑菌能力Table 3 Antibacterial ability of Bifidobacteria strains
2.4 利用功能性低聚糖的偏好性测定和相关基因分析
功能性低聚糖不能被人体吸收,从而到达肠道为肠道菌群供给营养, 且能选择性刺激益生菌生长。双歧杆菌主要定殖于人或动物肠道的下游[19],因而对功能性低聚糖的利用能力在一定程度上反应该株菌的生存能力。 由图1 可以看出,相比于无糖对照组, 两株菌均能在一定程度上利用7 种低聚糖, 使终pH 降低。B. longumCCFM760 对GOS 和XOS 的利用能力最好,培养基终pH 能达到4.30 以下, 与葡萄糖对照组持平;FOS、IMO 和LS 次之,培养基终pH 在4.50 左右; 对BMOs 和Lac 的利用能力最弱,培养基终pH 分别为4.89、4.97。 此外,除了牛乳寡糖和低聚异麦芽糖,B. longumCCFM760 对其它低聚糖的利用程度均高于B. animalissubsp.lacticBB12,表明该菌株具有良好的低聚糖利用能力。
菌株对功能性低聚糖的利用能力,与其基因组编码多种与糖运输、代谢有关的基因及其相应的调控蛋白质有关。 通过分析菌株基因组发现, 根据COG 功能编码分类,B.longumCCFM760 基因组中含有11.5%的编码碳水化合物代谢相关功能的蛋白质([G] carbohydrate transport and metabolism),如αgalactosidase、β -galactosidase、sugar ABC transporter permease、α-mannosidase 等,高于B.longumNCC2705(5.0%左右)[20]和B.animalissubsp.lactisV9(9.8%)[19],见表4。这也从基因水平解析了B. longumCCFM760利用低聚糖能力强的原因。
2.5 抗生素耐受能力测定和相关基因分析
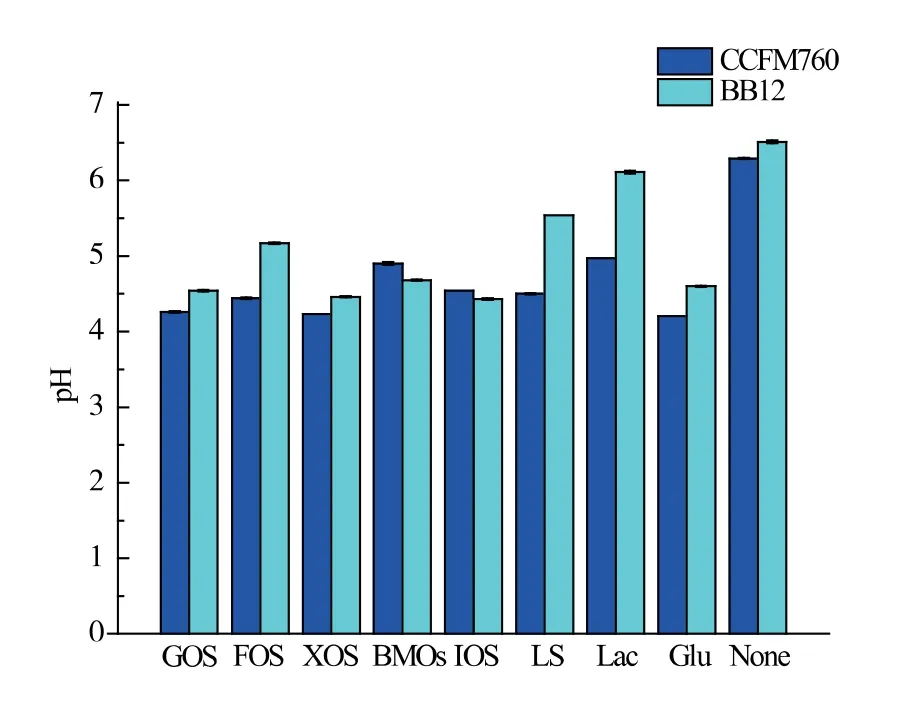
图1 双歧杆菌菌株对功能性低聚糖的利用情况Fig. 1 Utilization of Bifidobacteria strains to functional oligosaccharides
评价益生菌菌株安全性的一个重要指标是抗生素的耐药性,尤其是获得性耐药性[21-22]。 因此,应尽可能地选择具有最低耐药性的菌株作为食品或饲料添加剂使用。 参照ISO10932-2010 标准对B. longumCCFM760 菌株的抗生素最小抑制质量浓度进行测定, 结果见表5。 除甲氧苄氨嘧啶没有可供对比值外, 其他13 种抗生素对B. longumCCFM760 菌株的最小抑制质量浓度均低于参照菌株和EFSA 截止值。 此外,利用nr 数据库、Swiss-Prot 数据库、String数据库对B. longumCCFM760 基因组进行比对,预测其可能含有甲氧西林、林可霉素、柔红霉素/阿霉素、四环素、博来霉素和糖肽类抗生素(如万古霉素)的抗性基因,但结合最小抑制质量浓度的数据,发现B. longumCCFM760 对四环素和万古霉素均敏感,说明菌株含有某种抗生素基因并不意味着能耐受该种抗生素,可能该基因并不能表达。 陈霞[19]的研究发现,B. anmalissubsp.lactisBB12 不能耐受利福平、红霉素、青霉素、万古霉素,而对庆大霉素、卡那霉素、环丙沙星、链霉素、新霉素、四环素表现出较强的耐受性,虽然目前还没有特定用于衡量双歧杆菌药敏性的比较广泛的标准, 但是与商业化双歧杆菌相比,B. longumCCFM760 总体的抗生素抗性较弱,具有良好的抗生素耐受优势。 总的来说,B.longumCCFM760 是安全的,可用于食品药品行业。
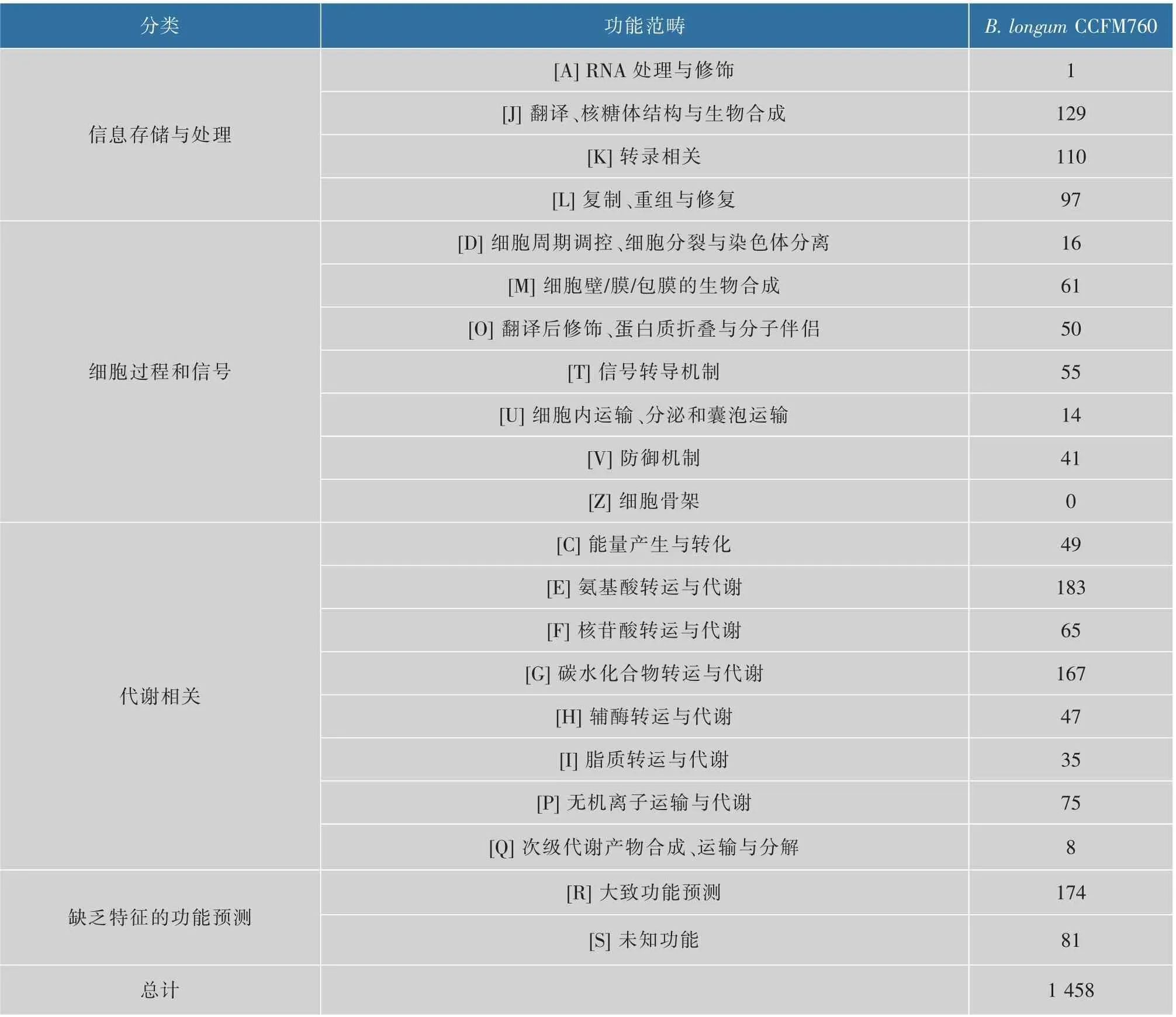
表4 B. longum CCFM760 所有基因COG 分类Table 4 COG categories for all genes in B. longum CCFM760
2.6 总SOD 活性检测和厌氧呼吸相关基因分析
抗氧化能力是某些乳酸菌所具有的特性,这种特性可能有助于乳酸菌在肠内定殖以及在炎症过程中保护肠粘膜免受过度的氧化应激[23]。 一般抗氧化发挥作用的酶包括超氧化物歧化酶、硫氧还蛋白过氧化物酶、谷胱甘肽过氧化物酶和过氧化氢酶等。 通过总SOD 活性检测来相对衡量B.longumCCFM760 抗氧化能力,结果见表6。 发现B.longumCCFM760 的培养上清液中总SOD 活性高于B. animalissubsp.lacticBB12, 而它的菌体无细胞提取物中SOD 活性则低于B. animalissubsp.lacticBB12。 为进一步探究菌株的抗氧化能力, 对其厌氧呼吸相关基因进行分析。 1992 年,Shimamura[24]就已在B. longum中发现其含有NADH oxidase 和NADH peroxidase 以及一些少量的过氧化物歧化酶。B. longumCCFM760 基因组中也预测到相同酶的基因以及参与负调控超氧阴离子生成的酶,此外,还包括NADH oxidase 同工酶以及具有氧化损伤修复功能蛋白质的编码基因,如thioredoxin reductase、methionine-R-sulfoxide reductase/methionine-S-sulfoxide reductase、peptide methionine sulfoxide reductase 等。 这说明B.longumCCFM760具有一定的抗氧化能力,有利于今后规模化生产。
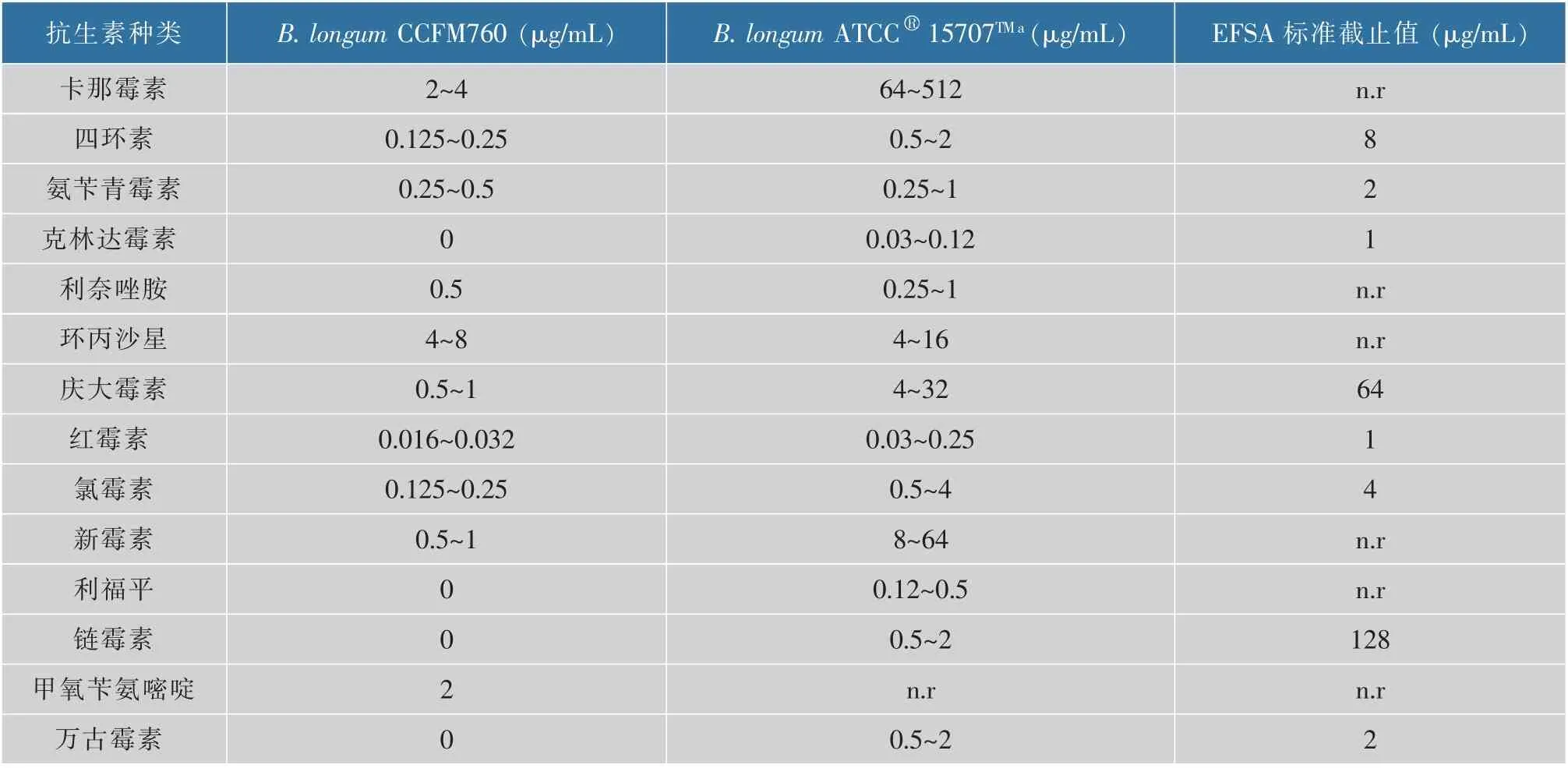
表5 14 种抗生素对B. longum CCFM760 菌株的最小抑制质量浓度Table 5 Minimum inhibitory concentration of 14 antibiotics on B. longum CCFM760 strain
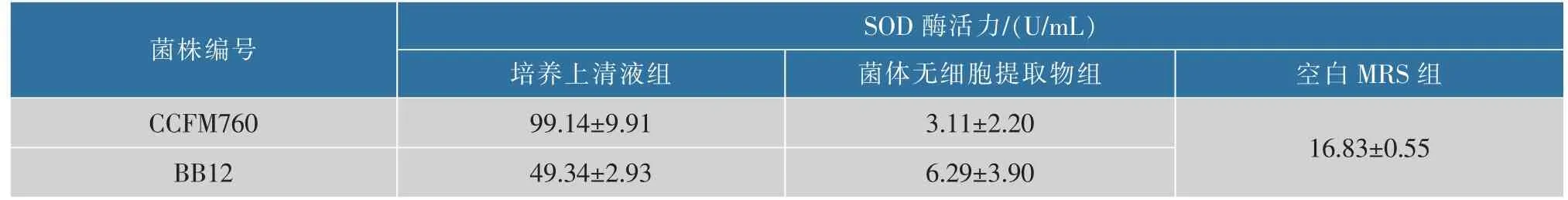
表6 双歧杆菌菌株的总SOD 活性Table 6 Total SOD activity of Bifidobacteria strains
3 结 语
通过对具有益生功能的B. longumCCFM760 菌株进行生理特性研究、 安全性评价和相关基因分析,发现B. longumCCFM760 具有良好的生长产酸能力,对人工模拟胃肠液的耐受能力较强,在经过11 h 的实验后存活率在(73.21±1.25)%,对两种食源性致病菌E.coli和S.aureus有显著的抑制作用,利用低聚糖能力强,且基因组中含数量较多编码低聚糖利用相关的基因,总SOD 活性为(99.14±9.91)U/mL,可适度耐氧。 此外,13 种抗生素对B. longumCCFM760 最小抑制质量浓度均小于相应标准,说明该菌株是安全的,可潜在的用于生物制药产品或作为膳食补充剂使用。 总体而言,B. longumCCFM760菌株是一株具备良好开发应用前景的益生菌菌株。
