响应面法优化胶红酵母伴生的维生素C 混菌发酵培养基
2020-05-11吕淑霞张云鹤于晓丹
廖 林, 吕淑霞, 张云鹤, 姚 硕, 张 良, 马 镝, 林 英, 于晓丹
(沈阳农业大学 生物科学技术学院,辽宁 沈阳110866)
维生素C(VC)是一种重要的人体必需维生素,在医药、食品、饲料、化妆品等领域广泛应用。 混菌发酵转化L-山梨糖为2-酮基-L-古龙酸(2-KGA)是二步发酵法[1]生产VC 工艺的核心过程。早期报道的VC 混菌发酵体系是由氧化葡萄糖酸杆菌(G.oxydans)和条纹假单胞杆菌(P. striata)组成[2]。 其中,氧化葡萄糖酸杆菌为产酸菌, 条纹假单胞杆菌为伴生菌。Urbance 等[3]对产酸菌进行表型和基因型分析后,将其归类为一个新的Ketogulonigenium属,vulgare种,即普通生酮基古龙酸杆菌(K. vulgare,K.v)。 目前,工业上生产VC 常用的伴生菌主要为原核微生物中的芽孢杆菌属,如巨大芽孢杆菌(B. megaterium)、苏云金芽孢杆菌(B. thuringiensis)和蜡样芽孢杆菌(B. cereus)[4]等,而用真核微生物作为伴生菌却鲜有报道。 作者所在实验室筛选到1 株能高效促进K. vulgare产2-KGA 的真核微生物——胶红酵母(R.mucilaginosa)。 由于现有的发酵培养基是以某些芽孢杆菌作为伴生菌,其营养成分可能无法满足胶红酵母(R.m)与产酸菌(K.v)组成新菌系的生长与产酸。 因此,作者采用响应面法对现有VC 混菌发酵培养基成分进行优化,以充分发挥新菌系发酵潜力,最终提高2-KGA 的产量。
1 材料与方法
1.1 试验材料与仪器
1.1.1 试验材料 土样: 沈阳东陵龙尾湖淤泥;菌种:普通生酮基古龙酸菌(K. vulgare),作者所在实验室保存。
1.1.2 主要仪器设备 万分之一电子天平:赛多利斯科学仪器北京有限公司;LDZX-30KBS 立式压力蒸汽灭菌器: 上海申安医疗器械厂;HPS-160 生化培养箱: 哈尔滨市东联电子技术开发有限公司;HZQ-C 空气浴振荡器:哈尔滨市东联电子技术开发有限公司;BH-2 显微镜:OLYMPUS;ST2100 pH 计:奥豪斯仪器常州有限公司;JW-2017HR 高速冷冻离心机: 安徽嘉文仪器装备有限公司;S1000TMThermal Cycler:BIO-RAD;Universal Hood Ⅱ凝胶成像系统:BIO-RAD;DL-CJ-2ND-Ⅱ洁净工作台:北京东联哈尔滨仪器有限公司;JY600C 电泳仪: 北京君意东方电泳设备有限公司。
1.1.3 培养基 基础发酵培养基(g/L):L-山梨糖80,玉米浆15, 尿素12,KH2PO41,MgSO40.2,CaCO35;pH 6.7~7.0。
种子培养基(g/L):L-山梨糖20,葡萄糖2,尿素1,玉米浆5,CaCO31;pH 6.7~7.0。
YPD 培养基:酵母膏1 g/dL,蛋白胨2 g/dL,葡萄糖2 g/dL。 制备固体培养基,加入2 g/dL 琼脂粉。
培养基所用试剂均为分析纯, 配制时均以1 mol/L NaOH (HCl) 调节pH 为6.7, 然后再加入CaCO3搅拌均匀,L-山梨糖单独在121 ℃灭菌25 min。
1.2 试验方法
1.2.1 目标伴生菌的富集培养 取约5 g 淤泥,放入盛有50 mL 无菌水的150 mL 三角瓶中, 振荡30 min,将泥土上的微生物分散在无菌水中,4 ℃静置1 h后,取100 μL 涂布在YPD固体平板培养基上,28 ℃恒温倒置培养2~3 d,从中挑选表面光滑的菌落(目标伴生菌), 于新的YPD 固体平板培养基上划线培养, 从长出的单菌落上挑取一环接种于装有20 mL YPD 液体培养基的250 mL 三角瓶中,180 r/min、28℃培养24 h,得到待选的目标伴生菌的菌悬液。
1.2.2 目标伴生菌与产酸菌的混合发酵培养 取2 mL经种子培养基活化的产酸菌K. vulgare,接种于装有20 mL 发酵培养基的250 mL 三角瓶中, 同时接入0.5 mL 目标伴生菌的菌悬液,180 r/min、28 ℃混菌发酵培养96 h 达到终点。
1.2.3 绘制目标伴生菌的菌株生长曲线 用YPD固体培养基对目标伴生菌菌株进行活化培养24 h后,10%接种于20 mL YPD 液体培养基的250 mL三角瓶中,28 ℃、180 r/min 恒温振荡培养, 每3 小时取样1 mL 培养液,4 000 r/min 离心5 min, 取沉淀,加1 mL 蒸馏水洗涤,4 000 r/min 离心5 min,取沉淀,加1 mL 蒸馏水混匀后,取样稀释,650 nm 波长下测OD 值,以蒸馏水为对照。 另以时间为横坐标,OD650值为纵坐标,绘制目标伴生菌菌株生长曲线。
1.2.4 2-酮基-L-古龙酸测定 采用碘量法测定[6]。
1.2.5 菌株初步鉴定 目标伴生菌的初步鉴定主要对照真菌鉴定手册[7],依据菌株的菌落形态和个体形态特征进行归类与鉴定。
1.2.6 菌株分子鉴定 形态学鉴定是传统的方法,为确保鉴定的准确性, 需结合分子鉴定。 利用ITS(Internal Transcribed Spacer) 序列进行菌种鉴定是目前较多采用的方法。 ITS 序列位于rRNA 编码基因18 S、5.8 S 和28 S 之间的小基因片段,具有高拷贝数, 整个序列的长度范围在600~800 bp, 利用rDNA 通用引物能够很容易被扩增出来。因此,rDNA在微生物的鉴定应用中,具有检测微生物种水平的多态性特征。
取目标伴生菌的菌悬液,按照文献[8]的方法提取基因组DNA。 PCR 引物为ITS4/ITS5,ITS4:5’-TCCTCCGCTTATTGATATGC-3’;ITS5:5’-GGAAG TAAAAGTCGTAACAAGG-3’ 由上海生工生物工程有限公司合成。PCR 扩增DNA,反应体系为20 μL:MIX 混合液10 μL,引物各1 μL,模板DNA 2 μL,ddH2O 6 μL。 PCR 反应程序为:94 ℃预变性2 min,94 ℃变性35 s,60 ℃退火35 s,72 ℃延伸1 min,30个循环,72 ℃延伸10 min,4 ℃保存。回收PCR 产物并测序,以BLAST 程序进行DNA 序列比对。
1.2.7 响应面试验设计
1)单因素试验:以基础发酵培养基中各个成分为试验因素,通过固定其它成分因素不变,每次只研究一个变化因素来进行单因素试验。 以基础发酵培养基中各个成分的不同添加量为试验水平, 以2-KGA产量为试验指标,设计得到6 因素5 水平的因素水平表,见表1。
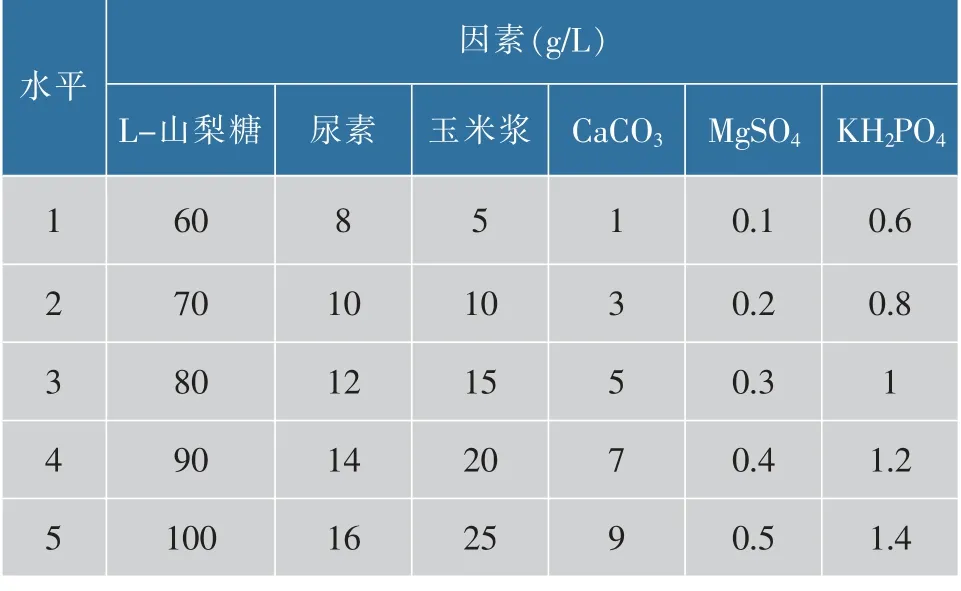
表1 单因素试验因素与水平Table 1 Factors and levels in single factor test
2)响应面试验:在单因素试验的基础上,借助Design Expert 8.0.6 软件,采用Box-Behnken Design(BBD)[9-10]设计原理,选取L-山梨糖、尿素、玉米浆、CaCO3、MgSO4、KH2PO4添 加 量 为 试 验 因 素, 以2-KGA 产量为指标,进行响应面分析,得到6 因素3水平编码表,见表2。
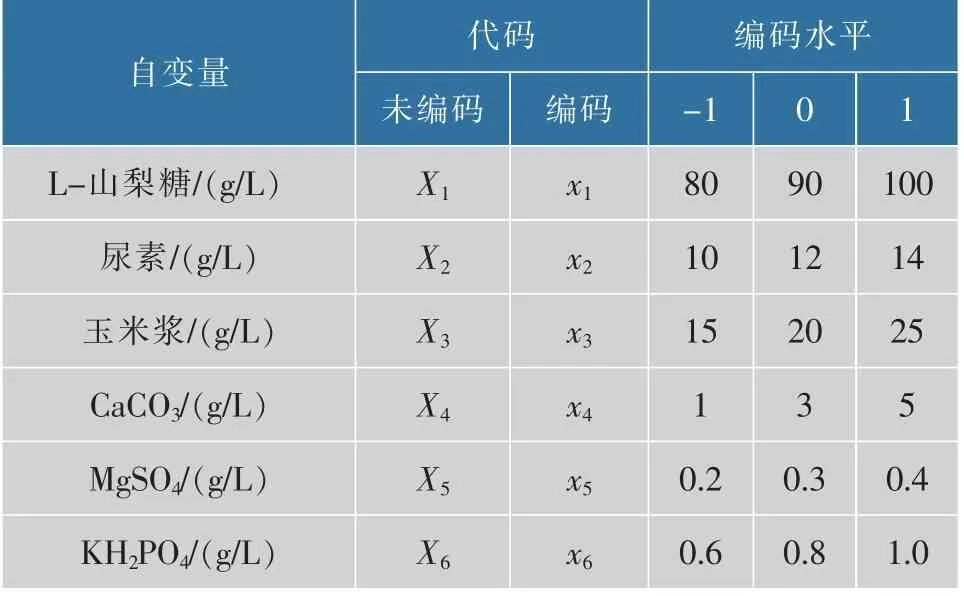
表2 试验因素水平及编码Table 2 Factors, levels and codes of response surface tests
3)响应面模型验证试验:以响应面试验优化后的培养基条件进行VC 混菌发酵,重复3 次,所得平均值与系统预测值越接近则模型越可靠。
2 结果与分析
2.1 菌株的形态特征
按照1.2.1 中的方法, 筛选得到一株能够作为K. vulgare伴生菌的菌株,将其命名为A8,以进行后续实验。
分离纯化后得到的菌株A8, 在YPD 固体平板培养基上划线和涂布培养3 d。 通过菌落形态特征可知,菌株A8 呈粉红色,菌落直径大小为4~6 mm,边沿整齐,表面光滑、湿润、发亮、呈奶酪状,生长较快,质地细腻柔软,见图1。在显微镜下观察菌株A8 的细胞呈椭圆形,以出芽方式进行无性繁殖,见图2。 经形态特征初步鉴定,菌株A8 属于酵母菌类。
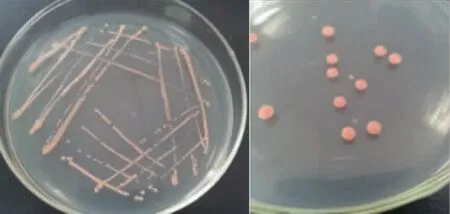
图1 菌株A8 的菌落形态Fig. 1 Colony morphology of strain A8

图2 菌株A8 的细胞形态Fig. 2 Cell morphology of strain A8
2.2 菌株的分子鉴定
为进一步鉴定菌株A8,以其基因组DNA 为模板,利用真菌ITS rDNA 通用引物ITS4/ITS5 进行PCR 扩增,电泳检测得到长度约为750 bp 的PCR扩增产物,见图3。 从图3 可知,DNA 的扩增效果较好,符合常规的ITS rDNA 序列长度,可以用来测序。
将扩增的菌株A8 ITS rDNA 序列送至北京六合华大基因科技股份有限公司测序,测序后去除载体及引物序列,共610 bp,正向序列结果为:
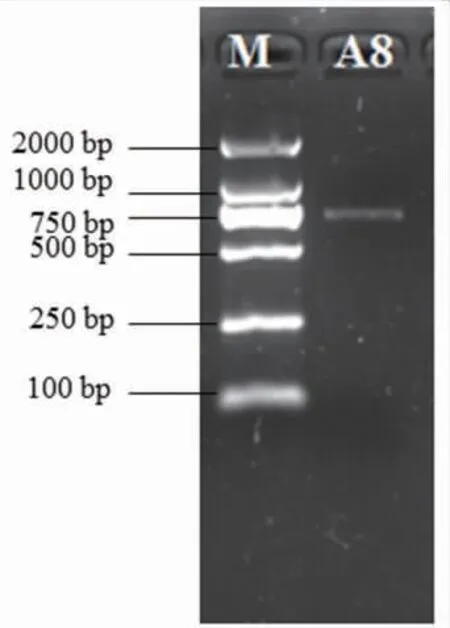
图3 菌株A8 ITS rDNA 的PCR 产物电泳图谱Fig. 3 Electrophoresis of PCR production of ITS rDNA from strain A8
CCG TAAACTACTGCGGAGACATTAGTGATAT AGGACGTCCAACTTAACTTGGAGTCCGAACTCTCA CTTTCTAACCCTGTGCACTTGTTTGGGATAGTAACT CTCGCAAGAGAGCGAACTCCTATTCACTTATAAAC ACAAAGTCTATGAATGTATTAAATTTTATAACAAA ATAAAACTTTCAACAACGGATCTCTTGGCTCTCGC ATCGATGAAGAACGCAGCGAAATGCGATAAGTAA TGTGAATTGCAGAATTCAGTGAATCATCGAAT C T TTGAACGCACCTTGCGCTCCATGGTATTCCGTGGA GCATGCCTGTTTGAGTGTCATGAATACTTCAACCC TCCTCTTTCTTAATGATTGAAGAGGTGTTTGGT TTC TGAGCGCTGCTGGCCTTTACGGTCTAGCTCGT TCG TAATGCATTAGCATCCGCAATCGAACTTCGGATTG ACTTGGCGTAATAGACTATTCGCTGAGGAATTCTA GTCTTCGGATTAGAGCCGGGTTGGGTTAAAGGAA GC TTCTAATCAGAATGTCTACATTTTAAGATTAGA TCTCAAATCAGGTAGGACTACCCGCTGAACTTAAG CATATCAATAAGCGGAGGAA
最后将测定的序列在NCBI 数据库中进行BLAST 比对分析,结果显示菌株A8 的基因序列与胶红酵母菌(Rhodotorula mucilaginosa)同源性为100%,结合形态学鉴定,确定菌株A8 为胶红酵母菌,命名为(Rhodotorula mucilaginosaA8,R. mucilaginosaA8)。进一步查询,该菌在通常情况下对动物和人体不致病[11-13]。 另外,为了研究菌株A8 的发育系统在微生物种群中的地位,根据BLAST 比对结果,下载同源性99%以上序列, 采用MEGA 6.06 构建系统发育树,见图4。
2.3 菌株A8 的生长特性
菌株A8 在28 ℃YPD 液体培养基中生长,最初的6 h 内生长比较缓慢, 属于延滞期;6~18 h 其生长量呈对数增长,进入对数生长期;18~48 h 处于稳定阶段, 此时菌株呈现波动性增长,48 h 时菌体生长量达到最大值, 之后菌体生物量逐渐降低,进入衰亡期,见图5。
2.4 单因素试验结果
按照表1 进行单因素试验, 得出了各试验因素成分添加量对2-KGA 产量的柱形图。 再根据BBD试验设计原理,选择在单因素试验中2-KGA 产量最优的3 个水平值进行后续响应面优化试验设计。

图4 基于菌株A8 ITS rDNA 序列构建系统发育树Fig. 4 Phylogenetic trees based on the ITS rDNA sequences of strain A8
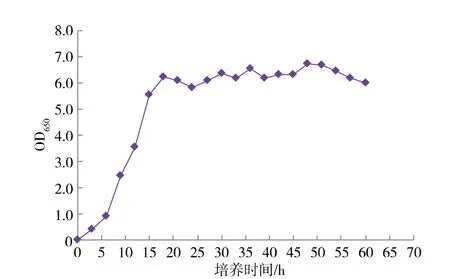
图5 菌株R. mucilaginosa A8 的生长曲线Fig. 5 Growth curve of strain of R. mucilaginosa A8
2.4.1 L-山梨糖添加量对2-KGA 产量的影响 L-山梨糖是混菌发酵生产VC 前体2-KGA 的原料。在工业生产中, 投糖量过低会造成其他资源的浪费,而过高的糖质量浓度又会抑制发酵菌系的细胞生长与产酸。 糖质量浓度在100 g/L 时,2-KGA 产量最高,但与80 g/L 和90 g/L 的糖质量浓度比较,其酸产量相差不大,见图6。按照BBD 设计原理,选择糖质量浓度为80、90、100 g/L 共3 个水平进行后续设计。
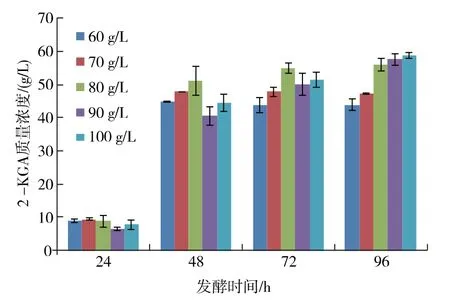
图6 不同L-山梨糖添加量对新菌系K.v+R.m A8 产酸的影响Fig. 6 Effect of L- sorbitol concentration on 2-KGA production by a new mixed culture of K.v+R.m A8
2.4.2 尿素添加量对2-KGA 产量的影响 在微生物生长过程中,尿素不仅作为氮源,而且也作为一种生理碱调节微生物生长的pH 环境[14]。 在发酵终点,不同尿素添加量对2-KGA 产量影响较大,见图7。按照BBD 设计原理, 选择尿素质量浓度为10、12、14 g/L 共3 个水平进行后续设计。
2.4.3 玉米浆添加量对2-KGA 产量的影响 玉米浆中含有多种氨基酸等物质供菌体生长,是影响2-KGA 产量的重要因素之一[15]。 在发酵终点时,玉米浆质量浓度对2-KGA 产量没有太大影响, 但是不同质量浓度的添加量可以起到缩短发酵周期的作用,见图8。 按照BBD 设计原理,选择玉米浆质量浓度为15、20、25 g/L 共3 个水平进行后续设计。
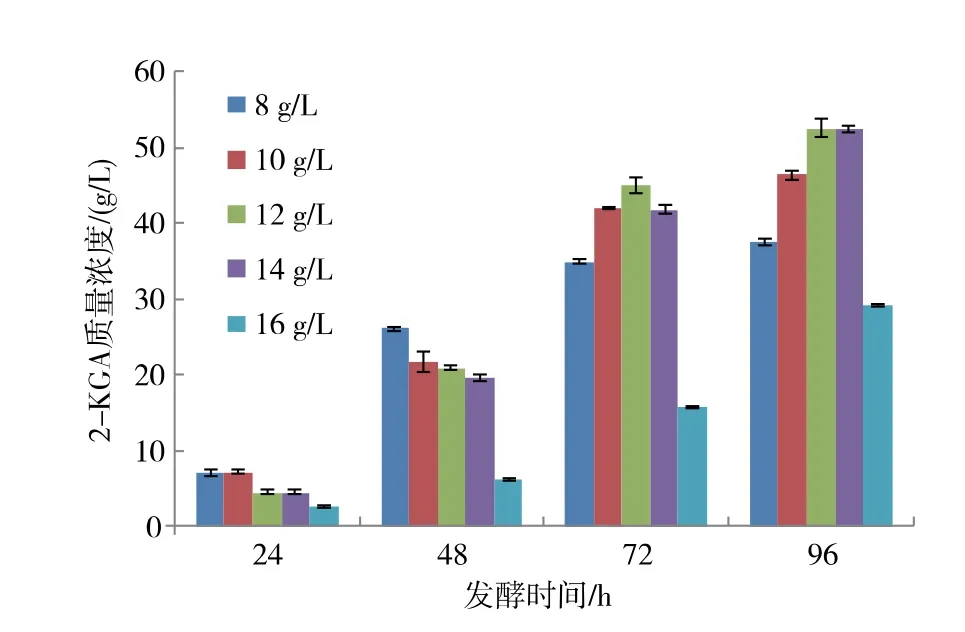
图7 不同尿素添加量对新菌系K.v+R.mA8 产酸的影响Fig. 7 Effect of urea addition amount on 2-KGA production by a new mixed culture of K.v + R.m A8

图8 不同玉米浆添加量对新菌系K.v+R.m A8 产酸的影响Fig. 8 Effect of corn liquor amount on 2-KGA production by a new mixed culture of K.v+R.m A8
2.4.4 CaCO3添加量对2-KGA 产量的影响 在发酵培养基中添加CaCO3的主要目的是为了缓冲发酵液中的酸,避免造成酸的反馈抑制作用。 不同的CaCO3添加量可以缩短发酵周期,见图9。按照BBD设计原理,选择CaCO3质量浓度为1、3、5 g/L 共3 个水平进行后续设计。
2.4.5 MgSO4添加量对2-KGA 产量的影响 据文献报道[6,16-17],2-KGA 在还原酶的作用下生成L-艾杜糖酸, 而高质量浓度的MgSO4可激活2-KGA 还原酶,使2-KGA 还原成L-艾杜糖酸,导致2-KGA 产量下降。 MgSO4质量浓度为0.4 g/L 时,2-KGA 产 量最高,见图10。 按照BBD 设计原理,选择MgSO4质量浓度为0.2、0.3、0.4 g/L 共3 个水平进行后续设计。

图9 不同CaCO3 添加量对新菌系K.v+R.m A8 产酸的影响Fig. 9 Effect of CaCO3 amount addition on 2-KGA production by a new mixed culture of K.v+R.m A8
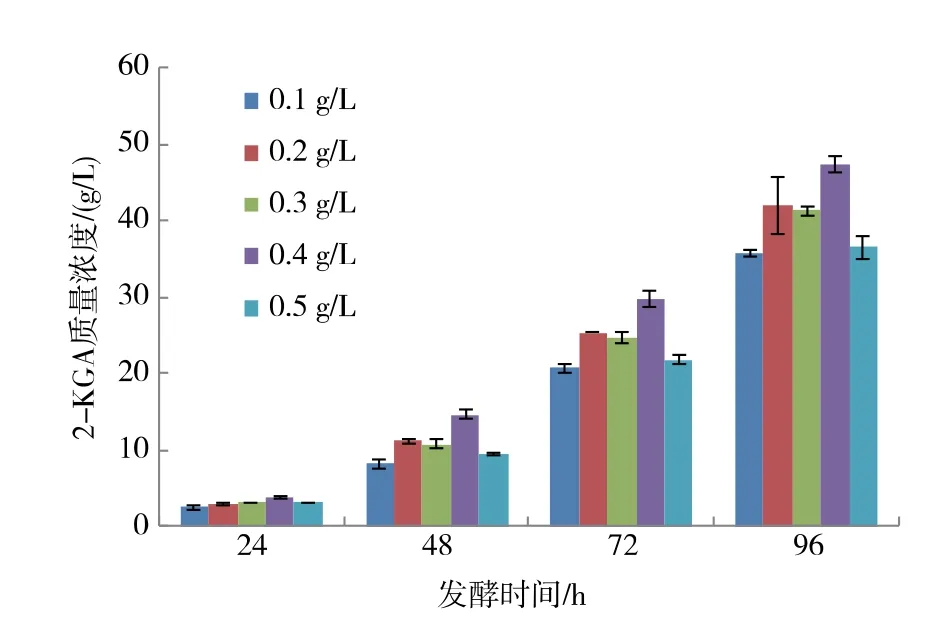
图10 不同MgSO4 添加量对新菌系K.v+R.m A8 产酸的影响Fig. 10 Effect of MgSO4 amount on 2-KGA production by a new mixed culture of K.v+R.m A8
2.4.6 KH2PO4添加量对2-KGA 产量的影响 KH2PO4是培养基中的常用成分, 磷和钾促进芽孢的形成,且K+能调节细胞渗透压,保持酶活性,磷是核酸的重要组成元素, 同时对pH 值也有一定缓冲作用。在发酵终点时,不同KH2PO4添加量对2-KGA 产量影响较大, 见图11。 按照BBD 设计原理, 选择KH2PO4质量浓度为0.6、0.8、1.0 g/L 共3 个水平进行后续设计。
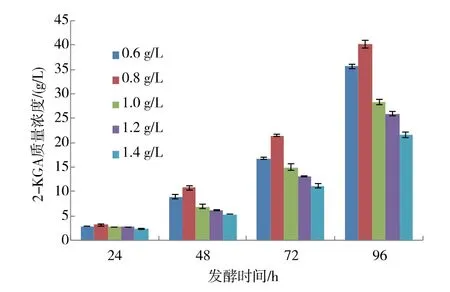
图11 不同KH2PO4 添加量对新菌系K.v+R.m A8产酸的影响Fig. 11 Effect of KH2PO4 amount on 2-KGA production by a new mixed culture of K.v+R.m A8
2.5 响应面试验结果
按照1.2.7 中方法, 采用BBD 原理对表2 中数据进行响应面设计, 得到要分两批次进行的54 组不同因素组合试验,试验结果见表3。
对表3 中的数据进行多项回归分析,获得2-KGA产量对6 个编码自变量L-山梨糖(x1)、尿素(x2)、玉米浆(x3)、CaCO3(x4)、MgSO4(x5)、KH2PO4(x6)的二次多项回归方程模型(1):
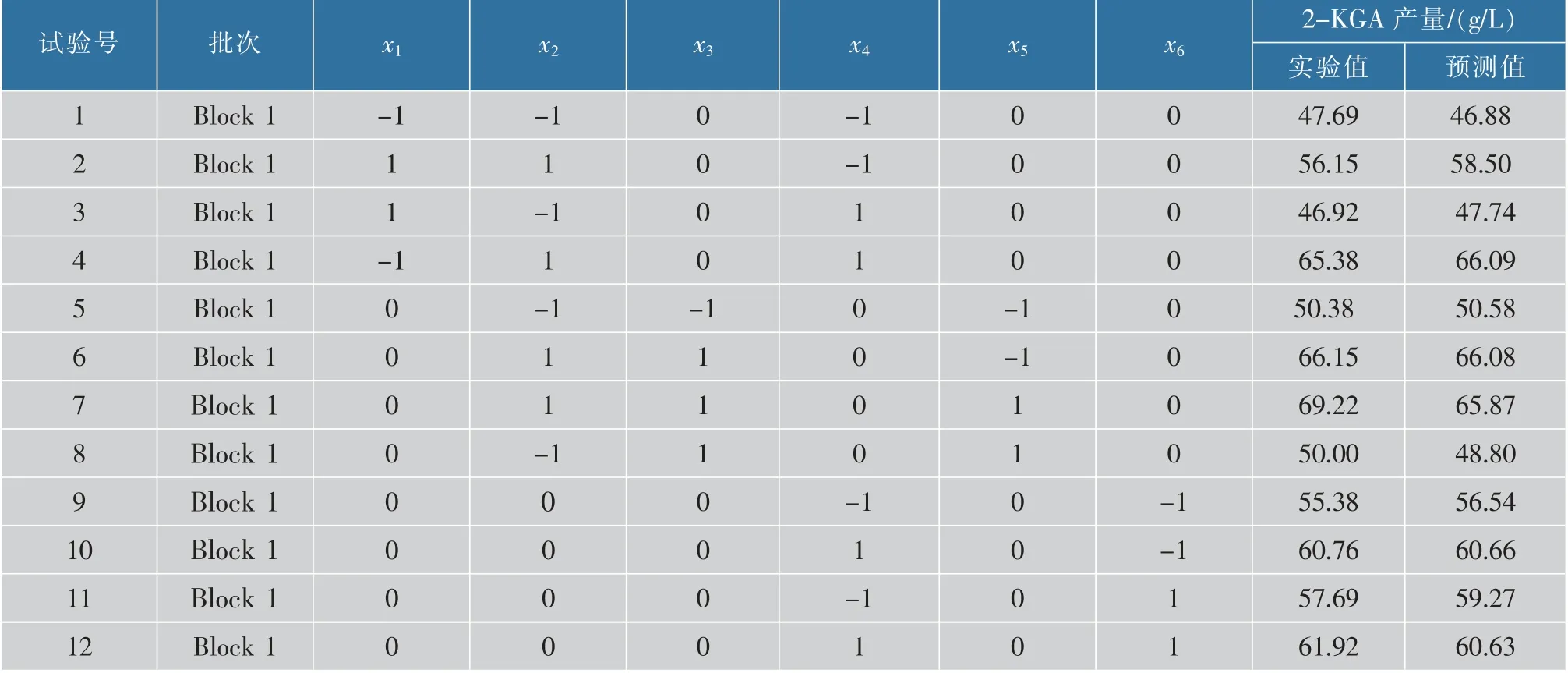
表3 BBD 实验设计及结果Table 3 Design and results of Box-Behnken Design

(续表3)

式中,Y:2-KGA 质量浓度 (g/L);x1:L-山梨糖质量浓度(g/L);x2:尿素质量浓度(g/L);x3:玉米浆质量浓度(g/L);x4:CaCO3质量浓度(g/L);x5:MgSO4质量浓度(g/L);x6:KH2PO4质量浓度(g/L)。
2.5.1 回归方程方差分析 对模型方程回归系数进行显著性检验分析,结果见表4。
对模型方差分析结果表明,相关系数R2=0.954 6,校正系数R2Adj=0.905 5,本实验所选用模型(1)具有极度显著性(P<0.000 1),说明该方程与实际情况拟合良好, 可以用该方程代替真实实验点进行分析。对回归方程系数进行显著性检验,x1、x2对产酸有极显著影响(P<0.001),x4、x22对产酸有高度显著影响(P<0.01),x12对产酸有显著影响(P<0.05),其他项系数均不显著。 依据系数估计值,因素的主效应关系为:x1=1.78,x2=8.28,x3=0.032,x4=1.15,x5=0.42,x6=0.62, 尿素>L-山梨糖>CaCO3>KH2PO4>MgSO4>玉米浆。 在α=0.05 显著水平下剔除不显著项后,对模型(1)进行优化可得模型(2):
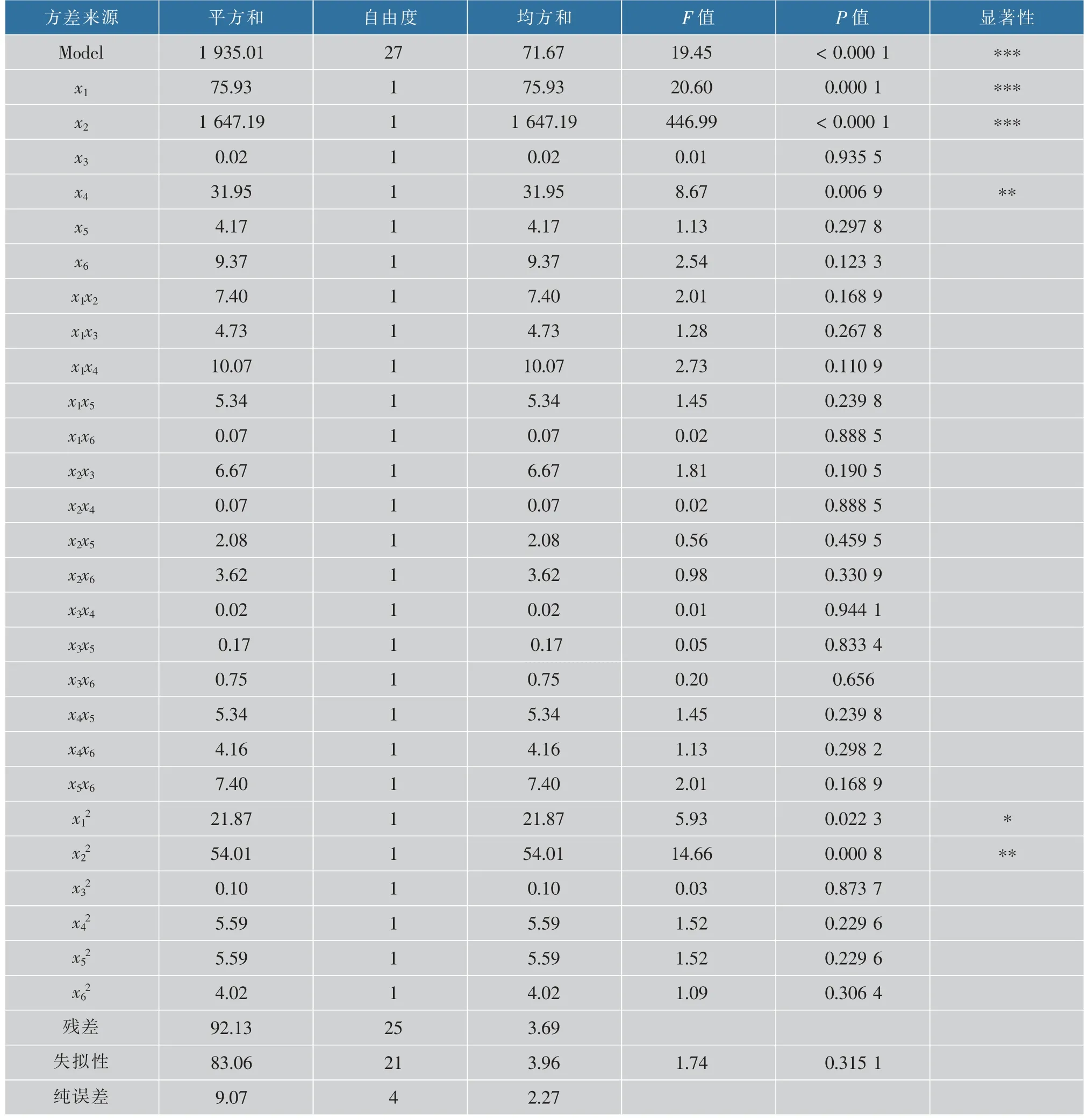
表4 回归方程方差分析Table 4 Analysis of variance for the fitted regression equation with 2-KGA yield as a function
Y=58.71-1.78x1+8.28x2+1.15x4-0.96x1x2+0.79x1x4-0.096x2x4-1.46x12-2.29x22+0.096x32-0.74x42+0.74x52+0.62x62
式中,Y:2-KGA 质量浓度 (g/L);x1:L-山梨糖质量浓度(g/L);x2:尿素质量浓度(g/L);x3:玉米浆质量浓度(g/L);x4:CaCO3质量浓度(g/L);x5:MgSO4质量浓度(g/L);x6:KH2PO4质量浓度(g/L)。
2.5.2 响应面分析与优化 根据BBD 模型探讨各因素及其交互作用对2-KGA 产量的影响。 选取显著性影响因素L-山梨糖、尿素、CaCO3为研究对象,得出两因素交互作用对产酸影响的3D 曲面图,见图12。 可知,低水平和高水平的影响因素都不利于酸产量的提高, 其中尿素对酸产量的影响最为显著,表现为曲线较陡。在各因素中,尿素与L-山梨糖的交互作用最为显著,从变化速率来看,尿素组分的主效应大于L-山梨糖。由此可知,在试验水平内,适当的增加尿素添加量有利于酸产量的提高。
2.5.3 响应面模型验证试验结果 为了检验响应面模型预测值的准确性,利用优化后的发酵培养基条件(L-山梨糖80 g/L、尿素14 g/L、玉米浆15 g/L、CaCO31.58 g/L、MgSO40.3 g/L、KH2PO41.0 g/L) 进行3 组平行试验,产酸量分别为69.85、70.27、70.12 g/L,平均值为70.08 g/L, 与模型预测值70.38 g/L 基本一致,说明试验所用模型能够较好地预测实际发酵产酸情况。
3 结 语

图12 两因素交互作用对2-KGA 产量的影响Fig. 12 Effect of cross-interaction between two factors on 2-KGA production
经形态学鉴定和分子鉴定,确定新筛选出的伴生菌株A8 为胶红酵母(R. mucilaginosa)。 菌株A8在最初的6 h 内生长处于延滞期;6~18 h 处于对数生长期;18~48 h 处于稳定期,48 h 之后进入衰亡期。 通过单因素试验优化、响应面法分析以及试验验证,得出新菌系发酵培养基为:L-山梨糖80 g/L、尿素14 g/L、 玉米浆15 g/L、CaCO31.58 g/L、MgSO40.3 g/L、KH2PO41.0 g/L。 利用优化后的培养基对新菌系进行VC混菌发酵,2-KGA 产量为70.08 g/L, 转化率达81.3%,显著高于工业生产菌系G. oxydans+B. megaterium2980 的产酸质量浓度55.38 g/L[17]。 在二步发酵法研究初期, 从L-山梨糖到2-KGA 的转化率仅为39.7%[18]。 仲崇斌等[19]以掷孢酵母作为伴生菌与氧化葡萄糖酸杆菌组成新混菌体系, 转化率达66.81%。徐婷婷等[20]以短小芽胞杆菌HJ-04 为伴生菌进行混菌产酸研究,在发酵终点48 h 时,产酸质量浓度达76.9 mg/mL(糖质量浓度94.95 mg/mL),转化率约为75.2%。 吕淑霞等[18]以枯草芽孢杆菌A9 为伴生菌进行发酵产酸研究时, 糖酸转化率达到了94%左右。郭礼强等[21]利用紫外线(UV)、亚硝基胍(NTG)及两者的复合诱变方法选育得到一株苏云金芽孢杆菌UN-366,转化率达到89.2%。在促K. vulgare产酸能力及转化率方面, 胶红酵母A8 显著高于B.megaterium2980、 掷孢酵母以及短小芽胞杆菌HJ-04,而与枯草芽孢杆菌A9 比较则较弱,因此,接下来应着手于胶红酵母A8 和枯草芽孢杆菌A9 的对比研究,找出真核微生物和原核微生物促产酸能力差异的原因。 另外, 经诱变后的苏云金芽孢杆菌UN-366 能使转化率达到89.2%, 后续可以借鉴此方法来对胶红酵母A8 进行诱变处理, 以更进一步提升其促进K. vulgare产酸的能力。 最后伴生菌株胶红酵母A8 在通常情况下对动物和人体不致病,可以与K. vulgare组成新菌系,用于工业生产。
