淀粉酶对竹黄菌固态发酵产竹红菌素的影响
2020-05-11高瑞杰邓华祥李韵雅管政兵廖祥儒蔡宇杰
高瑞杰, 邓华祥, 李韵雅, 管政兵, 廖祥儒, 蔡宇杰*
(1. 江南大学 工业生物技术教育部重点实验室, 江苏 无锡214122;2. 江南大学 生物工程学院, 江苏 无锡214122)
竹黄(Shiraia bambusicola)是中国常见的一种药用真菌,寄生于特定的竹子的嫩枝上[1],其主要分布在中国的南部省份,国外的日本和斯里兰卡也有报道[2-3]。
2008 年,第10 版的《真菌字典》将竹黄归属到子囊菌门(Ascomycota),座囊菌纲(Dothideomycetes),格孢菌目(Pleosporales)中科地位未确定的竹黄属[4]。 Cheng 等研究人员通过对竹黄菌的18S rRNA和ITS-5.8S rRNA 的序列进行分析, 提议将竹黄菌归属于格孢菌科(Phaeosphaeriaceae)[5]。
作为中国一种传统的中药材,竹黄菌的子座中含有多种具有生理活性的物质。 竹红菌素是竹黄中最主要的红色色素组分,同时也是竹黄中最重要的生物活性物质,是由多种苝醌类化合物所组成。 目前市场上的竹红菌素软膏产品,主要是由昆明振华制药厂和云南白药大理制药厂两家制药厂家生产,其有效成分就是竹红菌素。 竹红菌素作为一种优良的光敏剂, 在特定的光照条件下能够产生活性氧,包括超氧自由基和单线态氧。 丰富的活性氧可以引起细胞的高氧化压力, 损伤包括脂质、DNA 和蛋白质等生物大分子,进而杀死细胞[6-8]。 竹红菌素光敏活性的研究成为竹红菌素研究的热点,国内外多个团队在这一方面展开了大量的研究工作。 竹红菌素及其衍生物在抗菌、抗病毒、抗艾滋、抗癌(肝癌、肺癌、乳腺癌等)方面展现出良好的医疗效果[9-14]。
目前市场上的竹红菌素主要是从竹黄子座中分离获得,然而天然野生竹黄由于地域分布极不平衡,生长季节短暂,产量低而限制了竹红菌素的开发利用,因而通过生物发酵法获取竹红菌素成为研究热点。 相对于液态发酵而言,作为丝状真菌的竹黄菌在进行固态发酵时具有很大的优势:能量消耗低,生产成本低;无废水排放,污染小;体积生产率高且不易染菌; 一些应用无需进行提取纯化等工艺,例如作为着色剂可直接添加于饲料应用。 因而通过固态发酵的方法来生产竹红菌素成为本课题的研究重点。
作者所在课题组前期筛选到的竹黄菌Shiraiasp. SUPER-H168[15]能够稳定高产竹红菌素,通过对其进行固态发酵方面的初步探究,经过对8 种农作物的筛选后,发现玉米是生产竹红菌素的最佳固态发酵基质[16]。玉米糁是由玉米的胚乳部分破碎制成,淀粉是玉米胚乳的主要组成成分, 玉米淀粉是由75%的支链淀粉和25%的直链淀粉组成。 为了提高对底物玉米淀粉的利用率,缩短发酵周期,提高竹红菌素的产量,作者采用固态发酵的方法,研究了固态基质的初次搅拌、搅拌时间间隔、外加淀粉酶(包括细菌高温α 淀粉酶、细菌中温α 淀粉酶、真菌α 淀粉酶和糖化酶)对竹红菌素产量的影响,以期为商业规模化生产竹红菌素提供有益的参考及帮助。
1 材料与方法
1.1 菌种
竹黄菌 (Shiraia bambusicola)SUPER-H168:作者所在实验室保藏[15]。
1.2 培养基
斜面保藏培养基(g/L):马铃薯200,葡萄糖20,琼脂20;pH 自然。
液态种子培养基(g/L):马铃薯200,葡萄糖20,KH2PO42,MgSO4·7H2O 0.5;pH 自然。
固态发酵培养基(250 mL 锥形瓶):玉米糁(粒径0.8~1 mm)25 g, 麦秸秆3 g, 葡萄糖5%,NH4Cl 1% ,CuSO40.05% ,CaCl20.10% ,KH2PO40.05% ,K2HPO40.01%,MgSO40.20%, 初始含水量50%,初始pH 自然[17]。
上述培养基均在121 ℃下湿热灭菌20 min。
1.3 方法
1.3.1 孢子悬液的制备 斜面种子在30 ℃下培养5~7 d 至长出大量黑色孢子, 用20 mL 无菌水冲洗下黑色孢子,并用玻璃珠将黑色孢子充分打碎并配置成106个/mL 的孢子悬浮液。
1.3.2 种子液的培养 将1.3.1 所述的孢子悬液2 mL 接种于50 mL 的液态种子培养基中, 在30 ℃、200 r/min 的条件下振荡培养24 h 以制备固态发酵的种子液。
1.3.3 固态发酵的培养 将2 mL 的种子液接种于固态发酵基质中,在30 ℃的条件下培养15 d。 在进行固态基质搅拌优化之前,每两天对基质进行一次搅拌。
1.3.4 竹红菌素的测定方法 将固态发酵物进行搅拌后取样,放置在烘箱中70 ℃烘干直至恒质量,准确称取1.00 g,用研钵研碎,接着使用30 mL 无水乙醇在80 ℃下浸泡提取两次,抽滤后得澄清液,用旋转蒸发仪浓缩蒸干后,用甲醇溶解并且适当稀释至一定浓度,稀释后体积为V,然后用分光光度计在465 nm 处测定吸光值, 根据回归方程y=0.036 4x+0.044 1(R2=0.999)计算色素的含量,其中y为吸光值,x为色素的质量浓度(mg/L)。经换算后得到每克干固态基质的竹红菌素的产量为x·V,单位为mg/g(每克干固态基质)。
1.3.5 初次搅拌及搅拌间隔时间的优化 首先对
初次搅拌时间进行优化,分别为第1 天、第2 天、第3 天和第4 天,此时随后的搅拌间隔时间为2 d。 在初次搅拌时间确定后, 进行搅拌间隔时间的优化,分别为12、24、36、48 h。
1.3.6 外加淀粉酶的优化 将固态发酵初始和发酵第3 天作为淀粉酶的加入时间点。 4 种淀粉酶包括细菌高温α 淀粉酶、细菌中温α 淀粉酶、真菌α淀粉酶和糖化酶,均购买于江苏锐阳生物科技有限公司。 4 种淀粉酶分别在固态发酵初始或者第3 天加入,其中高温α 淀粉酶是在固态基质灭菌之前加入到基质中,于95 ℃保温30 min。 在对各淀粉酶的添加计量进行优化之前,α 淀粉酶的使用添加量为4 U/g (固态干基质), 糖化酶使用添加量为50 U/g(固态干基质)。细菌中温α 淀粉酶和真菌α 淀粉酶添加计量的优化:1、2、3、4、5、6 U/g (固态干基质);糖化酶添加计量的优化:10、20、30、40、50、60 U/g(固态干基质)。
α 淀粉酶和糖化酶两种酶对竹红菌素产量的协同作用也进行了进一步的探究。 在研究完外加淀粉酶的影响后,发现中温α 淀粉酶和糖化酶对竹红菌素的产量的影响显著。 利用响应面设计进一步探究细菌中温α 淀粉酶和糖化酶的最佳添加搭配。 采用软件Design-expert 8.2 进行实验设计和数据分析,响应面三维图采用Origin 8.1 进行模拟合成。 得到二次多项式方程后,进而计算出细菌中温α 淀粉酶和糖化酶的最佳添加浓度。 实验方案设计中的中心组合设计因素和水平及编码见表1。
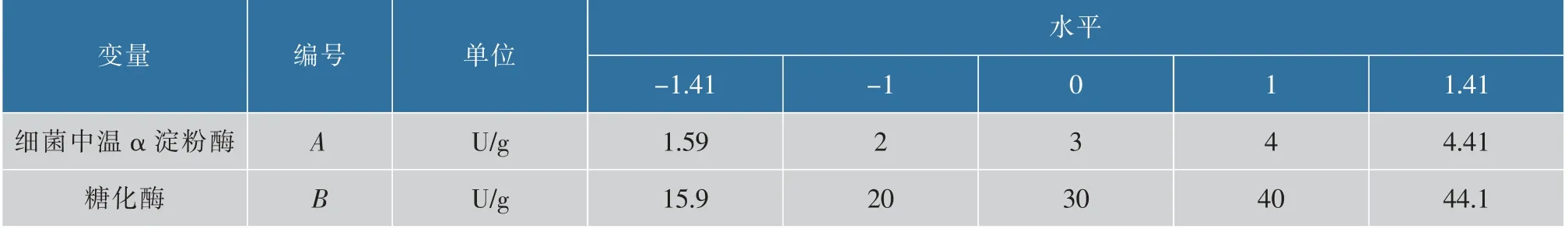
表1 响应面分析因素及水平Table 1 Factors and levels of the variables for response surface methodology experiment
2 结果与分析
2.1 初次搅拌的优化
搅拌是固态耗氧发酵最重要的参数之一,它可以通过固体基质表面液体和气体形成的分界面的气体传输,以确保温度和气体等传热和传质的均一性。 在丝状真菌进行固态发酵的过程中,搅拌会破坏真菌的菌丝, 尤其是在固态接种发酵后的初期,菌丝在固体基质中正处于延伸定殖并最终覆盖整个固体基质的阶段,过早的搅拌会干扰破坏菌丝的延伸, 不利于菌丝的延伸及固态发酵的顺利进行,因而本实验先对固态发酵的初次搅拌进行了优化。由图1 可知,当在第3 天进行初始搅拌时,竹红菌素的产量达到最高水平23.85 mg/g。 随着初始搅拌从第1 天到第4 天进行的变化,可以观测到生物量也随之增加, 尤其是在第4 天进行初始搅拌时,整个固态基质表面附着着大量白色气生菌丝,且固态基质结块严重,不利于搅拌的进行。
2.2 搅拌间隔时间的优化
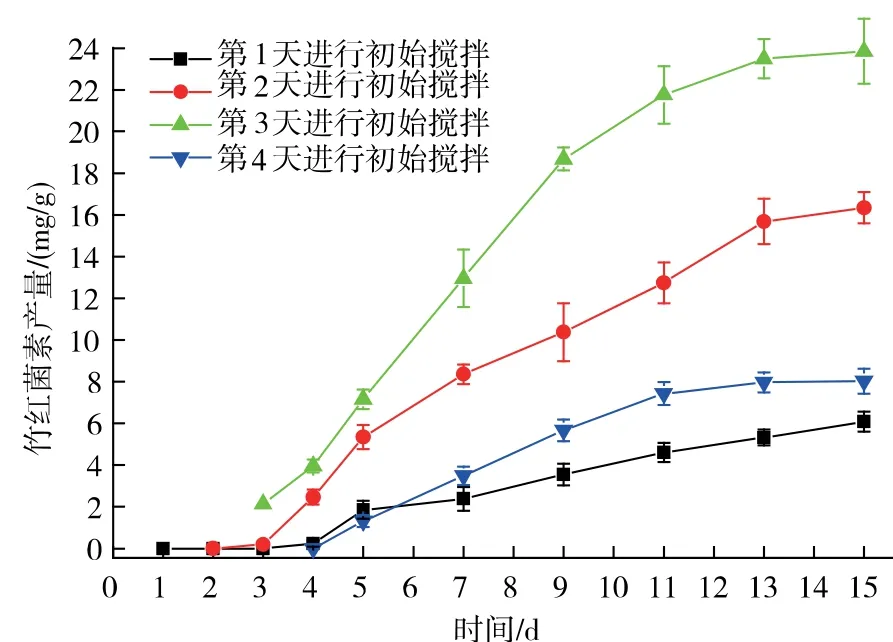
图1 初始搅拌对竹红菌素产量的影响Fig. 1 Effect of first agitation time on hypocrellin production
在第3 天确定为最佳初始搅拌时间后,进一步对搅拌间隔时间进行了优化,结果见图2。当搅拌间隔时间为36 h 时, 竹红菌素的产量达到最高水平25.37 mg/g, 搅拌间隔时间过短或过长都不利于竹红菌素的产生。 搅拌间隔时间过短时,搅拌对菌丝的损伤较大以至于影响到竹红菌素的产量;当搅拌间隔时间过长时,固态基质结块严重,不利于气体流通和温度传递,也不利于竹红菌素的产生。
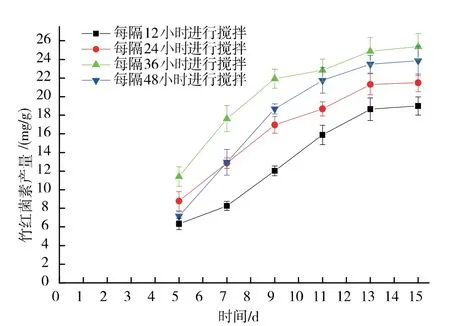
图2 搅拌间隔时间对竹红菌素产量的影响Fig. 2 Effect of intermittent agitation time on hypocrellin production
2.3 外加单一淀粉酶的优化
基于搅拌优化的结果,选定固态发酵初始和发酵第3 天作为淀粉酶的加入时间点。 与对照组相比,4 种淀粉酶的7 种加入方式都在不同程度上提高了竹红菌素的产量,见图3。中温α 淀粉酶或真菌α 淀粉酶在发酵初始时加入要比发酵第3 天加入的竹红菌素产量要高。 其中细菌中温α 淀粉酶在发酵初始时加入,竹红菌素产量达到45.10 mg/g。当糖化酶在发酵初始时加入,竹红菌素产量(32.40 mg/g)要低于在发酵3 d 时加入(39.94 mg/g)。 细菌高温α淀粉酶的加入处理,固态基质结块非常厉害且难于进行搅拌处理, 竹红菌素产量只有29.37 mg/g,因此,细菌高温α 淀粉酶没有进行进一步的研究处理。
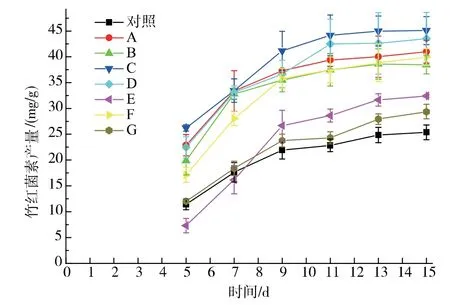
图3 外加单一淀粉酶对竹红菌素产量的影响Fig. 3 Effect of different amylase addition on hypocrellin production
2.4 淀粉酶添加量的优化
在选定细菌中温α 淀粉酶、真菌α 淀粉酶和糖化酶进行进一步研究后,对3 种淀粉酶的使用添加量进行了优化。中温α 淀粉酶和真菌α 淀粉酶选定在发酵初始时加入,糖化酶选定在发酵3 d 后加入。当细菌中温α 淀粉酶的使用添加量为3 U/g 时,竹红菌素产量达到48.12 mg/g; 当真菌α 淀粉酶的使用添加量为4 U/g 时, 竹红菌素产量达到41.99 mg/g,见图4。 2 种α 淀粉酶加入处理所造成的竹红菌素产量的不同, 可能是由于2 种酶的最适pH 和最适温度的不同造成的,同时说明细菌中温α 淀粉酶在固态发酵的条件下具有更好的活性,更利于竹黄菌固态发酵产竹红菌素的进行, 因而选择细菌中温α淀粉酶以进一步研究其对竹红菌素产量的影响。

图4 α 淀粉酶添加量对竹红菌素产量的影响Fig. 4 Effect of dose of α -amylase addition on hypocrellin production
当糖化酶的使用添加量为30 U/g 时,竹红菌素的产量达到40.64 mg/g。 伴随着糖化酶使用添加量由30 U/g 到60 U/g 的增加, 竹红菌素的产量逐渐下降,见图5。 可能是由于酶量增加后,水解产生的大量葡萄糖造成了底物抑制。
2.5 淀粉酶协同加入的优化
两种α 淀粉酶(细菌中温α 淀粉酶和真菌α 淀粉酶)和糖化酶的协同作用对竹红菌素产量影响的探究。 当α 淀粉酶在发酵初始时加入而糖化酶在发酵3 d 后加入时, 竹红菌素的产量要高于α 淀粉酶和糖化酶二者同时在发酵初始时加入的处理。当中温α淀粉酶和糖化酶在发酵初始时同时加入,竹红菌素的产量被抑制到21.01 mg/g,对照组为25.37 mg/g。 当中温α 淀粉酶在发酵初始时加入而糖化酶在发酵3 d 后加入时,竹红菌素的产量达到最高,为55.26 mg/g,同时固态发酵周期由15 d 缩减到13 d,见图6。
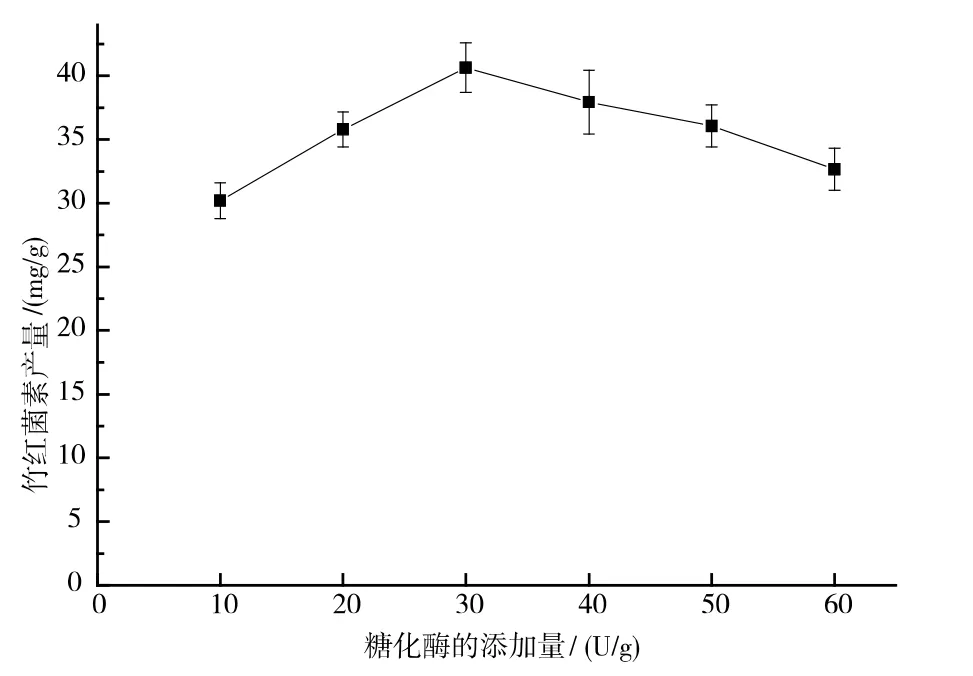
图5 糖化酶添加量对竹红菌素产量的影响Fig. 5 Effect of dose of glucoamlase addition on hypocrellin production
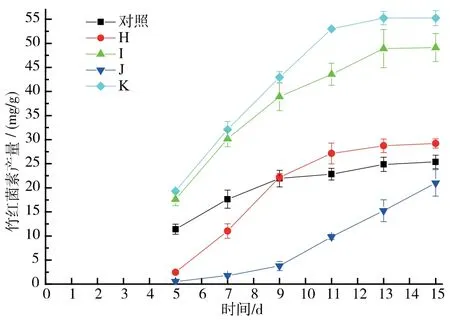
图6 淀粉酶协同加入对竹红菌素产量的影响Fig. 6 Effect of synergistic effect of two α-amylases and glucoamylase on hypocrellin production
2.6 细菌中温α 淀粉酶和糖化酶的响应面实验
通过上述的实验研究,发现细菌中温α 淀粉酶和糖化酶对竹红菌素的产量影响较大,因而选择添加这两种淀粉酶进行响应面研究,结果见表2。
利用软件Design-Expert 8.0.6 对表2 中的实验数据进行二次多项回归拟合,获得回归方程为:
Y=68.93-2.19A-0.75B-2.64AB-7.27A2-8.06B2其中Y为响应值(竹红菌素产量,mg/g);A(细菌中温α 淀粉酶,U/g)和B(糖化酶,U/g)为响应变量。
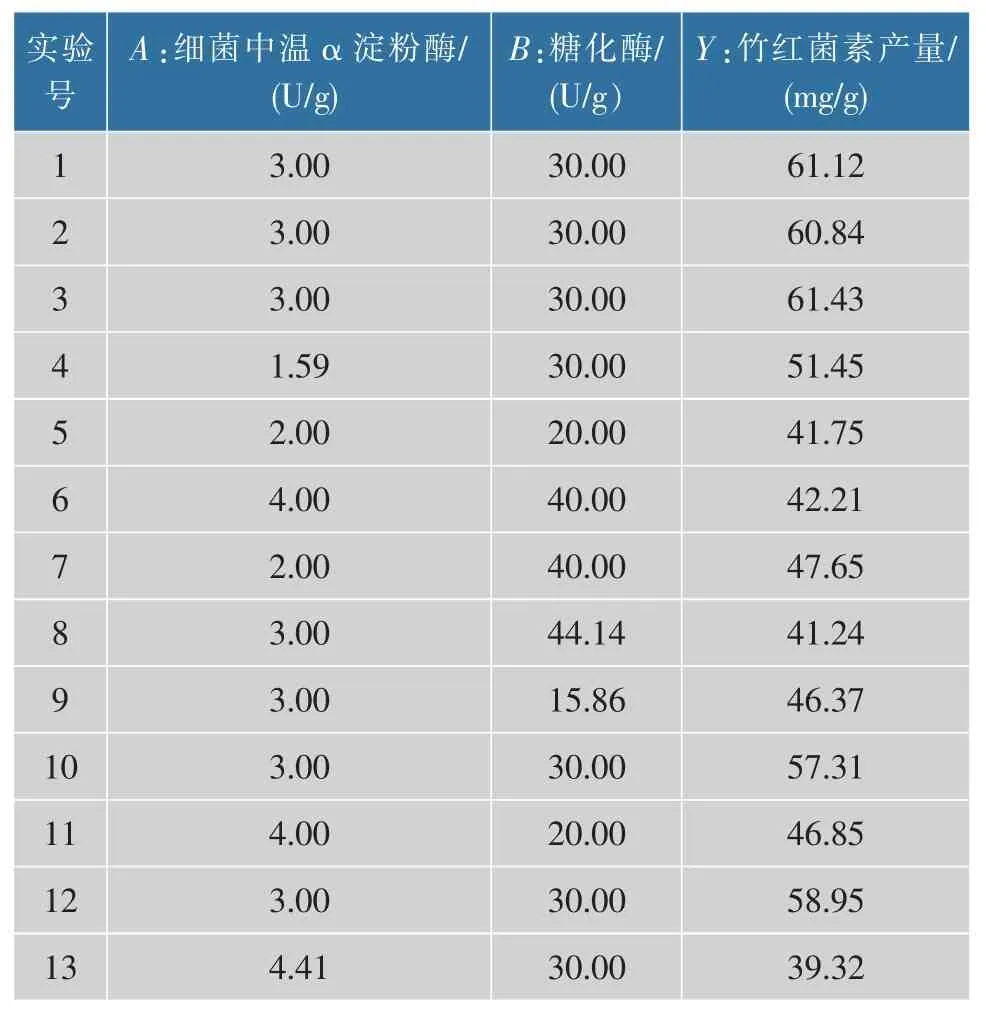
表2 实验设计方案及实验结果Table 2 Experimental design matrix and yields of hypocrellin
从回归方程的系数分析,其所对应的抛物面开口向下, 因而Y具有最大响应值。 利用软件对表2的数据进行分析, 结果见表3。 该模型的P值为0.000 5,远小于0.05,说明此模型在95%的概率水平是显著的;同时模型的失拟项不显著(p=0.081 7,大于0.05), 说明未知因素对该模型预测的实验结果的干扰强度比较小, 不必要再引入更多的因素;相关系数R2=0.933 5,说明响应值的变化在93.35%的概率上是由该模型决定的;R=0.966 1, 说明实验中竹红菌素的产量的实际值与模型预测值有96.61%的一致性。 因此,该模型能较准确的预测出竹红菌素的产量。
对回归方程进行求导,结合图7 的响应面三维图,求得该模型的最大响应值为60.10 mg/g,此时对应的中温α 淀粉酶和糖化酶的添加量分别为2.85、
29.78 U/g。
经过响应面实验优化,确定固态发酵中细菌中温α 淀粉酶和糖化酶的添加量分别为2.85、29.78 U/g。 为了验证预测结果的精准性,在此添加量下进行固态发酵以进行验证实验。 在验证实验中,竹红菌素的产量达到60.74 mg/g,与预测值接近,可见该模型能够较好的反应细菌中温α 淀粉酶和糖化酶的使用添加量对固态发酵产竹红菌素的影响。
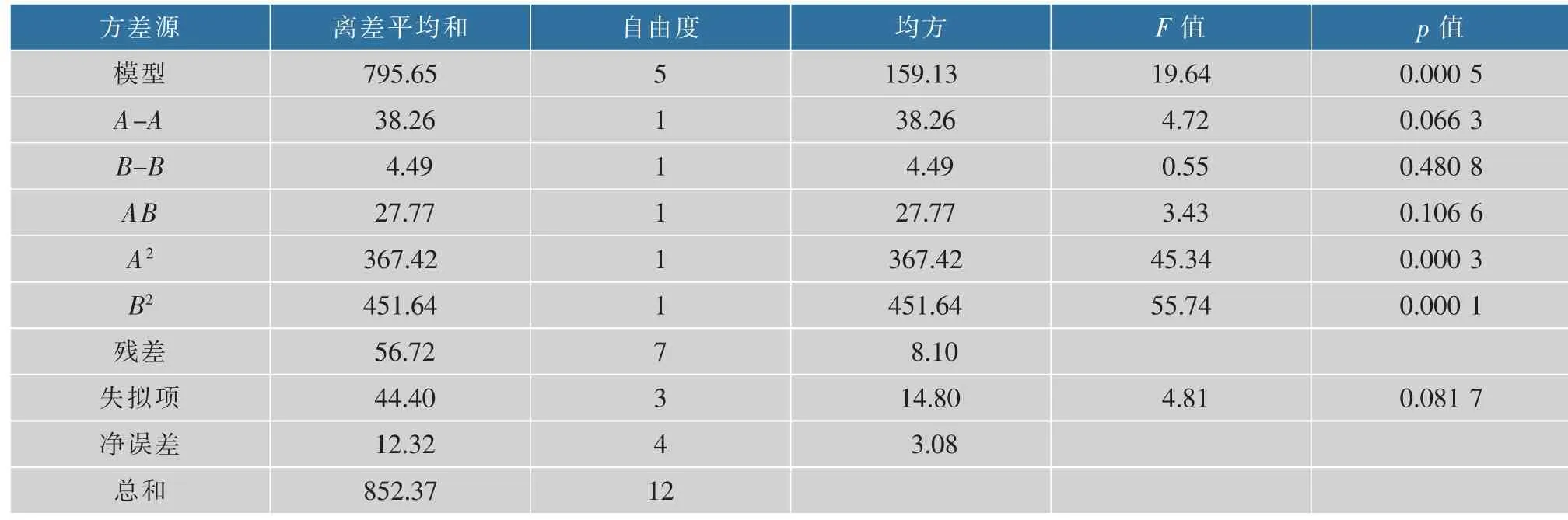
表3 二次多项式回归模型的方差分析Table 3 Analysis of variance for response surface quadratic model
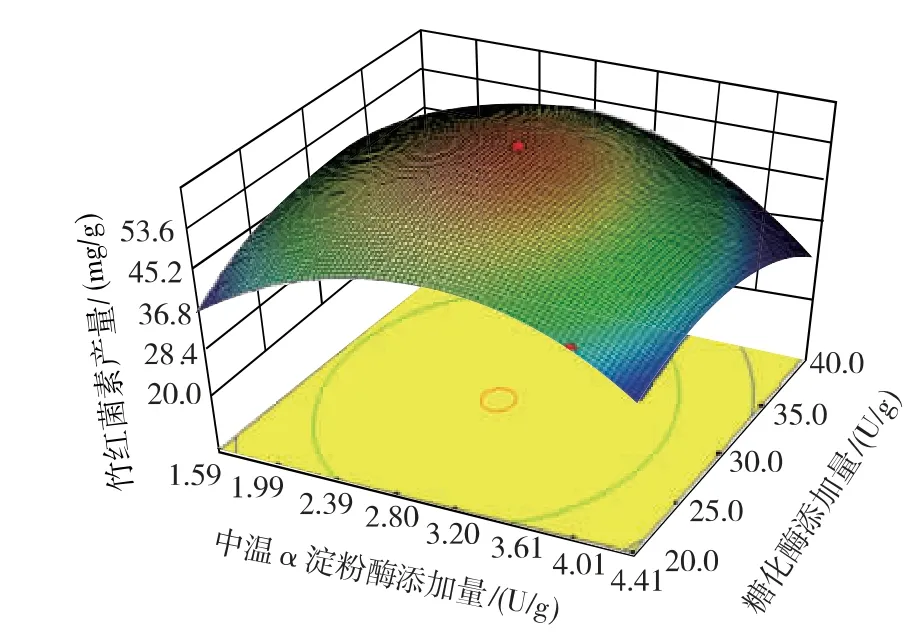
图7 响应面三维图Fig. 7 Three dimensional graph of the surface response plot
3 结 语
作者在竹黄菌产竹红菌素的固态发酵过程中,研究了搅拌(初始搅拌和搅拌间隔时间)和外加淀粉酶对竹红菌素产量的影响。 确定了固态发酵的最佳搅拌方案和外加淀粉酶的种类及添加量:初始搅拌在发酵第3 天进行, 此后的搅拌间隔时间为36 h, 外加淀粉酶以细菌中温α 淀粉酶和糖化酶的复合添加为最佳,其中细菌中温α 淀粉酶在固态发酵初始阶段加入,添加量为2.85 U/g,糖化酶在发酵第3 天加入,添加量为29.78 U/g。 经过搅拌和外加淀粉酶的研究后,竹红菌素的产量到达了60.74 mg/g,是先前竹红菌素产量[17]报道的3.66 倍,并且固态发酵的周期由15 d 缩减到了13 d。
